复方柴金解郁片对抑郁症失眠大鼠脑内GABA受体表达的影响
刘 灿,黄会珍,赵洪庆,邹蔓姝,王叶情,李春艳,王宇红,李强翔
(1.湖南中医药大学,中药粉体与创新药物国家重点实验室培育基地/科技创新中心,湖南 长沙 410208;2.宁夏医科大学附属人民医院,宁夏 银川 750001)
抑郁症是一种常见的精神障碍疾病。这种疾病已经影响了全球3亿多人,我国抑郁症发病率约为5.23%[1]。据统计近90 %的抑郁症患者有睡眠障碍[2],失眠是最常见的睡眠障碍之一,根据“精神疾病诊断和统计手册”第四版的标准,全球失眠率约为6%-10%[3],已成为重大的公共卫生问题。因此,有效的防治抑郁症失眠对于抑郁症的病程和结局有重要意义。
目前,抑郁症失眠的发病机制尚未完全阐明,其发生可能与脑内谷氨酸(glutamate,Glu)和γ-氨基丁酸(gamma-amino butyric acid,GABA)含量异常导致氨基酸的比值失衡有关[4-5]。本实验阳性药选择文拉法辛和地西泮两种西药合用治疗,使患者产生心理抵抗,且相较于西药治疗抑郁症,中药治疗抑郁症立足于整体调节、辨证论治,可实现多环节、多靶点、多途径调控,具有标本兼治、疗效明显、安全有效等优势。复方柴金解郁片由柴胡、贯叶金丝桃和姜黄等中药组成,具有“疏肝理气、健脾养心、安神解郁”的功效,主要治疗及预防肝郁脾虚、心神失养所致的轻中度抑郁症伴有失眠。故本文通过慢性不可预见性轻度应激(chronic unpredictable mild stress,CUMS)联合睡眠剥夺制作抑郁症失眠大鼠模型,复方柴金解郁片进行干预,利用旷场、糖水偏好和戊巴比妥钠阈上和阈下剂量实验评价复方柴金解郁片对抑郁症失眠模型大鼠行为学的影响,并从Glu/GABA比例失调方面评价其保护海马和下丘脑的机制。
1 材料与方法
1.1 实验动物SPF级♂ SD大鼠72只,体质量(180-220) g,购自湖南斯莱克景达实验动物有限公司,生产许可证号SCXK(湘)2016-0002,饲养于湖南中医药大学SPF级动物房中,使用许可证号为SCXK(湘)2019-0009。实验条件为:室温(25±2)℃、房间相对湿度(50±5)%、保持12 h/12 h光暗周期,动物自由摄取食物与水。
1.2 试剂与仪器盐酸文拉法辛缓释胶囊(批号:AG6898A,规格:75 mg/粒),购自湖南中医药大学第一附属医院,生产厂家:Pflzer Ireland Pharmaceuticals,分包装厂家:惠氏制药有限公司;地西泮片(批号:181006,规格:2.5 mg/片),购自湖南中医药大学第一附属医院,生产厂家:山东信谊制药有限公司;复方柴金解郁片浸膏(临床成人生药量为90 g·d-1,每克浸膏相当于3.92 g生药),由湖南中医药研究院提供;兔抗GABAAR多克隆抗体(批号:bs-4112R)、兔抗GAD67多克隆抗体(批号:bs-1302R),购自北京博奥森生物技术有限公司;Glu酶联免疫试剂盒(批号:20200505);GABA酶联免疫试剂盒(批号:20200505),购自上海晶天生物科技有限公司。梯度PCR仪购自杭州晶格科学仪器有限公司;超微量核酸蛋白浓度测定仪购自英国Bio Drop公司;T10BS25型全自动匀浆仪购自德国IKA公司;ECO型PCR扩增仪购自美国illumina公司;Chemi Doc XRS+Imager型化学发光系统购自美国BIO-RAD公司。
1.3 抑郁症失眠模型的建立[6-7]d 1-14除空白组外均进行CUMS,包括:① 禁食24 h;② 禁水24 h;③ 4 ℃冰水浴4 min;④ 倾笼45 ℃;⑤ 噪音4 h;⑥ 潮湿垫料24 h(200 mL/笼);⑦ 昼夜颠倒24 h;⑧ 电压70 V,电流2 mA,足底电击1 min;⑨ 夹尾1 min。每天1-2种刺激,同种刺激不能连续出现。从d 15开始,进行多平台水环境睡眠剥夺,根据前期对比观察72 h快速睡眠剥夺和慢性睡眠剥夺这两种方式,本实验采用慢性睡眠剥夺,每天15 ∶00-9 ∶00(+1)进行18 h睡眠剥夺,连续21 d,剥夺箱为103 cm×56 cm×30 cm的玻璃水箱,箱内置11个直径为6.5 cm圆形平台,大鼠在平台上进入快动眼睡眠(rapid eye movement sleep,REMS)时全身的肌张力下降,头部及毛发接触到水面而不能完全入睡,达到睡眠剥夺的目的。正式造模前5 d对大鼠进行每天30 min适应性平台站立训练。睡眠剥夺箱上放有带凹槽的不锈钢丝制成的笼盖,笼盖上面可以放置饮用水和饲料,大鼠可自行饮水和摄食。失眠造模期间均不间断抑郁造模。
1.4 分组与给药采用CUMS联合慢性睡眠剥夺的方法制备抑郁症失眠大鼠模型,按体质量采用随机数字分组法分为6组,每组12只,分别为空白组,模型组,阳性药组(盐酸文拉法辛13.5 mg·kg-1+地西泮0.9 mg·kg-1),复方柴金解郁片高(10.8 g·kg-1)、中(5.4 g·kg-1)、低(2.7 g·kg-1)剂量组,均为灌胃给药。空白组和模型组给予等体积蒸馏水,其他组给予相应供试品,1次/d,连续35 d,给药体积10 mL·kg-1体质量。
1.5 行为学实验
1.5.1旷场实验 采用80 cm×80 cm×40 cm的黑色敞箱,箱底用白线等分为25个正方形格子。将大鼠从中央一格放入,待适应30 s后观察记录4 min内大鼠水平活动次数、垂直站立次数和粪便粒数。每只鼠实验结束后,用纸擦拭干净并喷洒75%酒精,以免影响下一只鼠行为。
1.5.2糖水偏好实验 在正式实验前进行糖水嗜好训练,每只鼠笼放置2个相同规格饮水瓶。D 1两瓶均为1%糖水,d 2换成1%糖水和双蒸水各1瓶,隔1 h交换二者位置。D 3禁食禁水,24 h后进行糖水偏好测试。测试总时间为2 h,前1 h为左边蔗糖水右边蒸馏水,后1 h为左边蒸馏水右边蔗糖水。统计2 h内大鼠蔗糖水消耗量,糖水偏嗜度/%=2 h内蔗糖水总消耗量/(2 h内蔗糖水总消耗量+2 h内蒸馏水总消耗量)×100%。
1.5.3戊巴比妥钠诱导大鼠睡眠实验(1)戊巴比妥钠阈上剂量观察:每组取6只大鼠用于此实验,阈上剂量为35 mg·kg-1。观察各组大鼠翻正反射消失和恢复情况,记录以下数据:① 注射戊巴比妥钠时间;② 入睡时间:以1 min内翻正反射消失为标准;③ 觉醒时间:以30 s内翻正反射恢复为标准。计算入睡潜伏期和睡眠时长,入睡潜伏期=入睡时间-注射戊巴比妥钠时间;睡眠时长=觉醒时间-入睡时间。(2)戊巴比妥钠阈下剂量观察:每组取6只大鼠用于此实验,阈下剂量为18 mg·kg-1。记录每组大鼠入睡只数。
1.6 氨基酸类神经递质含量的测定行为学实验后将各组大鼠迅速断头并于冰上取脑,分离海马和下丘脑组织,液氮速冻,匀浆,离心后取上清液检测Glu和GABA含量,采用酶联免疫吸附法(ELISA),本实验使用的是双抗体夹心法测定抗原。实验过程按照ELISA试剂盒说明书进行。
1.7 Western blot检测取各样本海马和下丘脑,称重,按RIPA裂解液+PMSF(蛋白酶抑制剂) ∶组织=5 ∶1匀浆,离心测定仪测定上清中蛋白浓度。取上清液,将上清液用PBS稀释10倍后再进行测定。随后,于SDS-PAGE凝胶加样孔内加入等量变性蛋白样本,进行蛋白电泳。转膜,封闭1 h。并加入GABAAR、GABABR和GAD67,4 ℃过夜孵育一抗。稀释比例为1 ∶800。次日,回收一抗,洗膜结束,加入二抗稀释液(1 ∶2 000),水平摇床室温孵育1 h。最后,使用TBST溶液中,洗膜10 min×3次。并用ECL进行显色。所得蛋白条带的图像分析采用ImageJ软件。
1.8 qRT-PCR检测取下丘脑、海马样本按50 mg加入1 mL TRIzol的比例进行冰上匀浆。按氯仿 ∶TRIzol=1 ∶5加入200 μL氯仿,离心15 min,匀浆液分为3层,上层水样为RNA溶液,中间白色固体状为DNA、蛋白质,下层是有机层。吸取上层液体,加入同等体积异丙醇,离心15 min,EP管底部的片状白色物质即为RNA。加入50 μL 75 %乙醇吹打3次,加10 μL无酶水溶解,使用核酸蛋白浓度测定仪测定RNA浓度和纯度。按Thermo试剂盒说明将将RNA逆转录成cDNA。按扩增试剂盒的说明对目的基因进行扩增。测定目的基因和内参β-actin的PCR产物Cq值,待测基因的mRNA相对表达量采用2-△△Cq法计算。引物具体信息见Tab 1。

Tab 1 Primer sequence of target genes

2 结果
2.1 行为学检测
2.1.1旷场实验 Tab 2结果显示,d 14,与空白组相对比,模型组大鼠即表现出水平活动次数和站立次数减少,粪便粒数增加,有抑郁趋势;d 35,与空白组相对比,模型组大鼠即表现出水平活动次数和站立次数减少(P<0.05或P<0.01),粪便粒数明显增加(P<0.05);与模型组比较,阳性药组大鼠自主活动次数增加(P<0.01),粪便粒数明显减少(P<0.05),复方柴金解郁片高、中剂量组大鼠表现出自主活动增加(P<0.05或P<0.01),粪便粒数减少趋势。
2.1.2糖水偏好实验 Tab 3结果显示,d 14,与空白组相比,模型组大鼠糖水偏嗜度明显减少(P<0.01),有抑郁趋势;d 35,与空白组相比,模型组大鼠糖水偏嗜度明显减少(P<0.01);与模型组相比,阳性药组大鼠糖水偏嗜度明显增加(P<0.05),复方柴金解郁片高、中剂量组大鼠糖水偏嗜度有所增加。
2.1.3戊巴比妥钠阈上剂量作用实验 Tab 4结果显示,造模给药期结束后,与空白组相比,模型组大鼠睡眠潜伏期明显增长(P<0.01),睡眠时长缩短(P<0.01);与模型组比较,阳性药组和复方柴金解郁片高、中剂量组大鼠睡眠潜伏期显著缩短,睡眠时长明显增加(P<0.05或P<0.01),低剂量组大鼠睡眠变化的趋势不具有统计学意义。
2.1.4戊巴比妥钠阈下剂量作用实验 Tab 4结果显示,与空白组相比,模型组大鼠在戊巴比妥钠阈下剂量诱导下没有动物入睡;与模型组比较,阳性药组入睡率达66.67%,具有明显提升(P<0.01),复方柴金解郁片高、中剂量组与戊巴比妥钠阈下剂量共同作用诱导大鼠入睡率分别为33.33%、50%,均有明显提高(P<0.05或P<0.01)。
2.2 氨基酸类神经递质含量
2.2.1下丘脑中氨基酸类神经递质含量 Tab 5结果显示,与空白组比较,模型组大鼠下丘脑中Glu含量明显升高,GABA含量明显降低(P<0.01);与模型组相比,除复方柴金解郁片低剂量组外,其余各给药组均能明显逆转Glu、GABA含量变化(P<0.05或P<0.01)。
2.2.2海马中氨基酸类神经递质含量 Tab 6结果显示,与空白组比较,模型组大鼠海马中Glu含量明显升高,GABA含量明显降低(P<0.01);与模型组相比,阳性药和复方柴金解郁片高、中剂量均能明显逆转Glu、GABA含量变化(P<0.05或P<0.01),与上述下丘脑中结果一致。
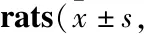
Tab 2 Comparison of autonomous activity ability in n=8)
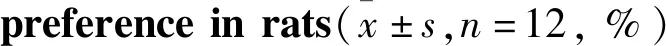
Tab 3 Comparison of sucrose water
2.3 GABA相关蛋白表达
2.3.1下丘脑中GABA信号相关分子蛋白表达 Fig 1、2结果显示,与空白组相比,模型组大鼠下丘脑GAD67、GABAAR、GABABR蛋白表达下降(P<0.05或P<0.01);与模型组比较,阳性药组大鼠下丘脑中各指标表达明显升高(P<0.01),复方柴金解郁片各剂量组对于各指标表达有提高作用。
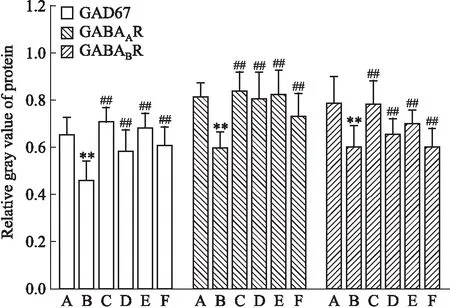
Fig 1 Expression of GAD67,GABAAR,GABABR relative gray value of protein in hypothalamus of n=3)
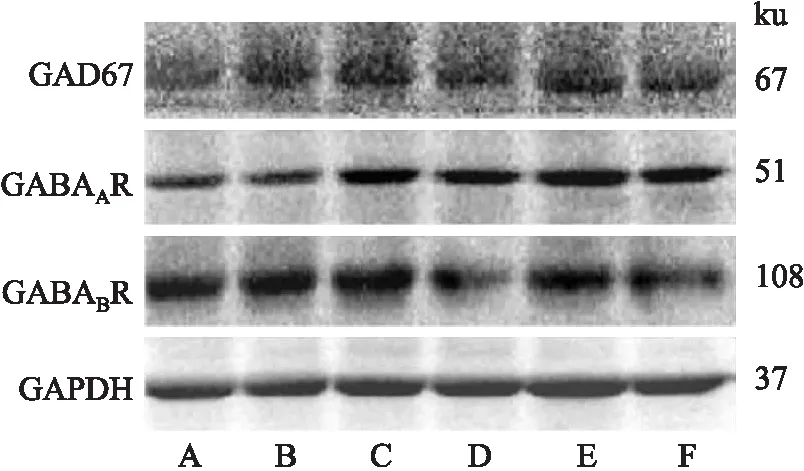
Fig 2 GAD67,GABAAR,GABABR proteinexpression in hypothalamus of ratsA:Control;B:Model;C:Positive drug;D:High;E:Medium;F:Low
2.3.2海马中GABA信号相关分子蛋白表达 Fig 3、4结果显示,与空白组相比,模型组大鼠海马中GAD67、GABAAR、GABABR蛋白表达下降(P<0.05或P<0.01);与模型组比较,阳性药组大鼠海马中各指标表达明显升高(P<0.01),复方柴金解郁片各剂量组对于各指标表达有提高作用。

Fig 3 Expression of GAD67,GABAAR,GABABR relative gray value of protein in hippocampus of

Fig 4 GAD67,GABAAR,GABABR protein expression in hippocampus of ratsA:Control;B:Model;C:Positive drug;D:High;E:Medium;F:Low
2.4 GABA相关分子基因表达
2.4.1下丘脑中GABA相关分子基因表达 Tab 7结果显示,与空白组相比,模型组大鼠下丘脑GAD67、GABAAR、GABABR mRNA表达下降(P<0.01);与模型组比较,阳性药组大鼠下丘脑中各指标基因表达明显升高(P<0.05或P<0.01),复方柴金解郁片各剂量组均能提高各指标基因表达,中剂量效果最为显著。
2.4.2海马中GABA相关分子基因表达 Tab 8结果显示,与空白组相比,模型组大鼠海马GAD67、GABAAR、GABABR基因表达下降(P<0.01);与模型组比较,除复方柴金解郁片低剂量组外,各给药组大鼠海马中各指标基因表达明显升高(P<0.05或P<0.01)。
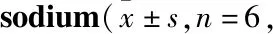
Tab 4 Comparison of hypnotic synergism of suprathreshold and subthreshold dose of pentobarbital min)

Tab 5 Comparison of Glu and GABA contents in rat
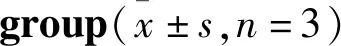
Tab 6 Comparison of Glu and GABA contents in rat hippocampus in each
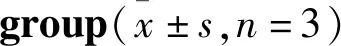
Tab 7 Results of GAD67,GABAAR,GABABR mRNA in hypothalamus of rats in each
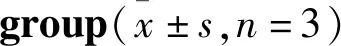
Tab 8 Results of GAD67,GABAAR,GABABR mRNA in hippocampus of rats in each
3 讨论
睡眠障碍是抑郁症标志性症状。异常的睡眠征兆包括慢波睡眠(slow wave sleep,SWS)减少或没有,快速眼动(rapid eye movement sleep,REM)睡眠潜伏期缩短,睡眠觉醒时间增加,呈现更多的碎片化睡眠。目前,临床上针对抑郁症失眠的治疗最为常见的是在使用抗抑郁药基础上合用镇静催眠药,而针对GABA为治疗靶点的抗抑郁症失眠中药药物的研究十分有限。本课题组拟在前期复方柴金解郁片治疗抑郁症机制研究[8]的基础上以期寻找能对抗抑郁症失眠的创新治疗药物。因此,我们设计实验研究复方柴金解郁片在神经系统是否对CUMS联合睡眠剥夺诱导的抑郁症失眠有改善作用及其保护海马和下丘脑的机制。
本实验分别于抑郁造模14 d后和复合造模结束后对各组大鼠进行行为学评价,目的是确定复合模型大鼠在抑郁状态前提下进行失眠造模,从而观察复方柴金解郁片对大鼠抑郁样和失眠行为的改善作用。旷场实验结果显示,复方柴金解郁片高、中剂量组相比于模型组大鼠活动度、对新鲜事物的好奇程度增加,警觉性降低,表明复方柴金解郁片能够明显增加抑郁症失眠大鼠的兴奋性和探究趋势,缓解其紧张恐惧心理。糖水偏好实验结果显示复方柴金解郁片中剂量显著提高了模型大鼠的快感程度。戊巴比妥钠阈上和阈下剂量实验是通过观察受试药物是否能延长戊巴比妥钠的睡眠时间,判断其是否有协同抑制失眠作用。本研究结果表明,复方柴金解郁片中剂量能够缩短模型大鼠的睡眠潜伏期,延长大鼠的睡眠时间,提高大鼠的入睡率。综上行为学实验结果,提示复方柴金解郁片高、中剂量能缓解大鼠的抑郁失眠症状。
海马是下丘脑-垂体-肾上腺(hypothalamic pituitary adrenal,HPA)轴负反馈的调节中枢,参与应激的神经内分泌和情绪调节。下丘脑是HPA轴的一个重要神经内分泌中枢,其通过垂体控制内分泌激素的释放,从前到后分为3个部分:视上区、结节区、乳头区,其中视交叉上核中的神经元几乎全部为GABA神经元主要调控昼夜节律,参与抑郁症失眠症状[9]。这两个脑区被认为是抑郁症失眠发病的关键靶区。

综上,复方柴金解郁片能对抗Glu/GABA比例失衡引起的神经元损伤,保护海马和下丘脑,改善抑郁样行为和失眠状态。其神经保护机制主要是下调兴奋性氨基酸类神经递质Glu、上调GABA通路相关分子GAD67、GABAAR和GABABR,从而加快神经元成熟,促进神经元修复,并最终改善抑郁失眠。

