液体发酵生产灵芝三萜酸的过程调控研究进展
李丽,杨云丽,杨小凡,何伟,袁恺,朱威宇,彭超,何一凡,董银卯,周卫强*
1(北京工商大学 化学与材料工程学院,北京, 100048)2(北京市植物资源研究开发重点实验室,北京, 100048) 3(中粮营养健康研究院有限公司,北京, 102209)
灵芝(Ganodermalucidum)是多孔菌目、灵芝科、灵芝属真菌,被列为九大仙草之一。灵芝三萜酸(简称三萜酸)是灵芝的主要活性成分之一。目前从子实体、菌丝体和孢子中提取得到的三萜酸共有200余种,含有羧基和多羟基结构(图1),是一类高度氧化的脂溶性羊毛甾醇衍生物[1]。三萜酸具有抗癌、抗炎、抑菌、保肝、抗氧化、助睡眠等功效[2-4]。例如灵芝酸A可以抑制大肠杆菌与金黄色葡萄球菌活性、抗乳腺癌[5],同时对脂多糖诱导的炎症因子的释放具有抑制作用[6],灵芝酸D可以降低结肠癌细胞存活率[7],灵芝烯酸F、灵芝酸DM具有抗肿瘤、抗炎活性[8]等。
目前,在中国灵芝生产量超过11万t/年,占世界总产量的70%[9]。灵芝常被加工为保健食品进行销售,在我国注册上市的灵芝保健品已有600余种。此外,灵芝还可被加工为药品、生物辅料、化妆品等[10]。例如,灵芝与其他物质进行发酵,得到发酵液可制作成饮品,灵芝孢子粉破壁后被加工成胶囊或者提取孢子油等成分[11]。2019年11月,灵芝作为药食同源物质进行试点工作,研究论证将灵芝纳入食药物质目录管理的可行性。自此,灵芝不仅可以应用于药品和保健食品中,而且也可以应用于普通食品中,灵芝的需求量日益增长。
灵芝三萜酸主要存在于灵芝子实体、孢子粉和液体发酵的菌丝体、发酵液中。灵芝子实体生长周期长,受季节影响,而且土壤污染、农药使用等增加了安全风险。而液体发酵技术可以在短时间内培养灵芝菌丝体,使其快速生长,定向促进灵芝三萜酸积累,具有发酵周期短、发酵成本低廉、发酵条件易精确控制,并可工业化生产等优点[12]。因此,液体发酵技术成为目前获取三萜酸的有效手段及研究热点。但是与灵芝子实体相比,液体发酵技术获得的三萜酸种类较少、含量较低,所以系统研究三萜酸的发酵调控工艺,对进一步提高三萜酸的产量具有重要意义。本文从发酵过程调控角度,阐述并探讨了发酵条件和外源物质干预对灵芝三萜酸的调控机制,为提高三萜酸产量提供发酵技术参考。
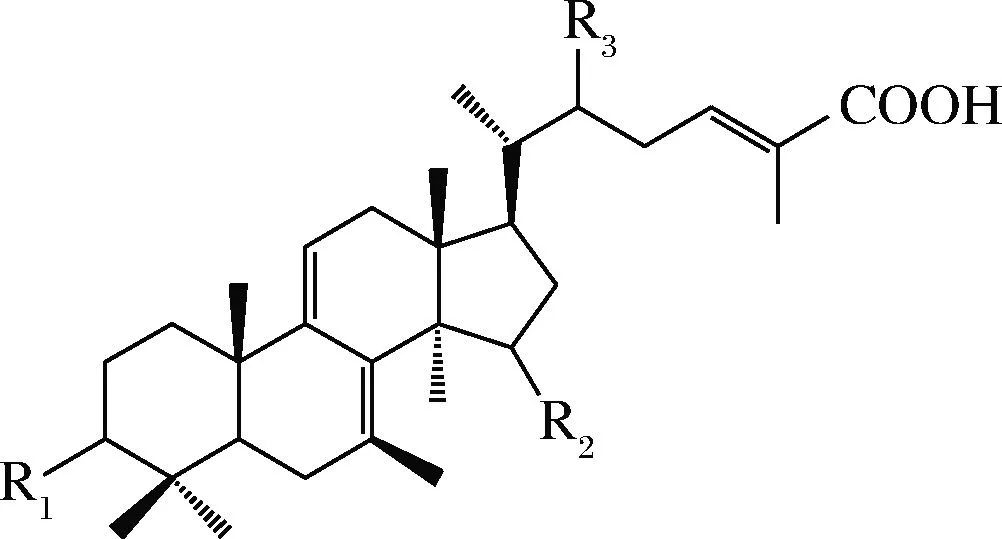
图1 灵芝菌丝体内常见的三萜酸骨架Fig.1 Triterpenic acid skeleton in the mycelium of Ganoderma lucidum
1 发酵条件对灵芝液体发酵法产三萜酸的影响
1.1 较高温度促进灵芝三萜酸的产生
温度是影响微生物生长代谢的重要因素之一。温度改变会影响微生物体内各种生化反应,进而影响其生长繁殖以及物质代谢。其一,升高温度会加快灵芝菌丝体对葡萄糖的消耗速度,加快菌丝体快速进入生长对数期[13]。FENG等[14]采用5 L发酵罐研究了23、26、29和32 ℃下G.lucidumG0119的恒温深层液体发酵过程。在23~29 ℃,随着温度上升,灵芝菌终点生物量增加,当温度提高至32 ℃时,灵芝菌终点生物量降低。从发酵全过程来看,29 ℃下恒温深层液体发酵最有利于灵芝三萜的合成,达到2.54 mg/100mg DW。但是发酵0~80 h,较高的发酵温度可以缩短菌丝体生长延滞期,快速进入灵芝三萜积累阶段。
其二,温度会影响灵芝生长发育以及代谢酶活性[15]。灵芝菌丝体生长适合温度一般是26~30 ℃[16],而灵芝代谢酶最佳活性温度一般高于菌丝体最适生长温度[15]。刘月芹等[15]研究发现,与对照组(30 ℃培养条件)对比, 32、34、36 ℃培养灵芝生物量均呈下降趋势,但是胞外灵芝酸产量增加,其中在34 ℃培养下发酵12 d,灵芝酸含量比对照组提高了20.58%。ZHANG等[17]将二级种子液在42 ℃热胁迫处理0~24 h,发现热胁迫12、24 h后的胞内总灵芝酸分别增加了65%、80%,鲨烯比对照组高1.9、2.3倍,羊毛甾醇比对照组高2、3倍。在热胁迫12 h后,灵芝酸合成关键基因hmgr、sqs比对照组高2、3.5倍。
较高温度加速发酵前期灵芝菌的生长速度,提高灵芝酸合成酶活性,从而缩短三萜酸合成的延滞期。根据发酵液温度构建灵芝生长及三萜酸合成动力学模型,制定变温策略,使发酵前期合成三萜酸延滞期缩短,发酵后期菌丝体积累量提升,以提高三萜酸的比合成速率。
1.2 弱酸性环境促进三萜酸的合成
pH会影响灵芝细胞膜通透性,从而影响营养物质吸收、产物分泌以及三萜酸合成相关酶的活性[18]。在PalRim信号途径传递过程中,pH升高激活转录因子PacC/Rim 101的表达,从而调控三萜酸的合成。研究发现PacC沉默菌株中灵芝酸含量、sqs和ls的转录水平、鲨烯和羊毛甾醇含量均明显提高,表明PacC抑制三萜酸的生物合成[19]。在中性和碱性环境下PacC大量转录表达,所以在酸性环境更利于三萜酸合成。旷思敏等[20]对初始pH进行单因素实验,灵芝三萜酸含量随着pH增加呈现先增加后下降的趋势,pH值为5.5时,胞外三萜酸达到最大值,为266.79 mg/L。pH值为6.0时,胞内三萜酸达到最大值,为257.98 mg/L。FANG等[21]发现初始pH值为5.5时,胞内灵芝酸含量最高,为1.25 mg/100mg DW,而当初始pH值为6.5时,胞外三萜酸含量达到最大值,为207.9 mg/L;结果差异可能是由于菌种不同导致。WANG等[22]采用两阶段pH控制策略实现了三萜酸的高浓度积累。通过0~72 h时控制pH值为5.07,72~144 h时控制pH值为4.37,三萜酸最大质量浓度达到449.37 mg/L。潘江安等[23]根据灵芝菌丝体的比生长速率和灵芝胞内三萜的比合成速率综合因素,制定了四阶段pH控制策略,大幅提高了胞内三萜的产量,达到279.59 mg/L,比对照(pH自然)和pH 4.5时分别提高了47.72%和17.52%。
上述实验证明,灵芝在弱酸环境(pH 4~6.5)时利于三萜酸的合成。主要原因是当发酵环境呈弱酸性时,PacC转录表达受到抑制,三萜酸合成关键酶表达上调,从而促进灵芝三萜酸的合成。
1.3 低溶氧促进三萜酸的合成
灵芝属于好氧型真菌,菌体的生长需要较高浓度溶氧[16],较低溶氧则有利于灵芝酸合成[24]。TANG等[25]发现当溶氧为25%时,有利于灵芝菌丝体生长,当溶氧浓度为10%时,有利于灵芝酸合成。
FANG等[26]采用振荡静置两阶段方式对灵芝进行培养。将灵芝先振荡培养4 d后再静置培养12 d,与振荡培养16 d相比,灵芝酸产量从1.36 mg/100mg DW提高到3.19 mg/100mg DW。徐轶宁[27]对静置培养过程中分子机制进行研究,发现静置培养过程中灵芝酸合成关键酶基因hmgr,sqs,ls的表达量分别比振荡培养时高1.9、4.3、2.1倍。振荡静置两阶段培养方式,振荡为静置阶段提供菌丝量和合成三萜酸的基础,静置阶段使三萜酸合成关键酶基因转录增强,促进三萜酸的合成。
在微量泵技术操作中,护理评估及宣教不全面是常见的错误之一,有可能导致护理不良事件的发生。护理评估主要对患者、药物、环境等进行评估,是护理程序的第一步,而护理宣教是贯穿在整个操作过程中对患者进行健康教育,包括药物作用、仪器使用及注意事项等,这些在护理操作过程中必不可少。本结果提示,年资越高的护理人员,出错率越低,可能是随着工作时间的延长,护理人员在患者疾病观察、治疗和护理方面临床经验越丰富,沟通能力越强,因此,在操作过程中出错率越低[10]。而低年资的护理人员知识储备不足,工作能力相对较低,对评估和宣教的重点内容把握不足,不能将理论知识应用于实践,因此,宣教不够全面[11]。
发酵转速改变影响溶氧以及剪切力变化。赵娜等[28]将灵芝以150 r/min培养1.5 d后降为 100 r/min培养,其灵芝三萜产量比对照组(150 r/min 恒转速)高了21%,其灵芝三萜含量高达 58.65 mg/g。这是因为降低转速减少了体系中溶氧量,从而促进菌丝体内灵芝三萜积累。低搅拌转速会降低剪切力,影响发酵液混合以及氧传递,导致溶氧量降低。张伟[29]研究发现低剪切力组(剪切力为0.154~1.234 m/s)灵芝酸含量和产量比高剪切力组(剪切力0.154 ~2.161 m/s)分别提高85%和276%,其灵芝酸含量和产量分别为3.53 mg/100mg DW和798.0 mg/L。
通气量直接影响菌体对培养基中溶解氧摄取,因此在发酵过程中需要合适的通气量。冯杰等[30]采用5 L发酵罐研究通气量对三萜酸合成影响。实验结果显示8、10 L/min通气量使菌体生长的迟滞期缩短,快速进入稳定期,稳定期时三萜酸的合成速率明显提高。研究发现,8 L/min通气量,三萜得率最大,为2.33 mg/100mg DW,比4、6、10 L/min 通气量的灵芝三萜得率分别提高了1.39、0.99、0.84倍。孙金旭[31]采用通气量为0.4 L/(L·min)时,灵芝酸产量达到最大,为171.26 g/L。由此可见,适中通气量对于菌丝体生长和三萜酸合成有明显促进作用。
振荡静置两阶段方式、搅拌转速/剪切力以及通气量会影响发酵液中的溶氧浓度,发酵后期降低转速或者通气量,达到降低溶氧目的,使灵芝细胞产生活性氧(reactive oxygen species,ROS)信号,以提高三萜酸合成酶表达,促进三萜酸合成。
1.4 指数补料方式利于三萜酸的合成
补料培养具有富集高密度菌体、改善发酵环境、降低培养基底物抑制等特点,被广泛用于发酵次级代谢产物生产中[32]。不同补料发酵方式对灵芝生长及三萜酸合成具有较大影响。冯杰等[33]对比了间歇式补料、恒速补料、变速补料、指数补料培养对三萜酸合成的影响。研究发现,采用指数补料方式补充葡萄糖得到三萜含量最高,达到4.58 mg/100mg DW。在发酵过程中,补料葡萄糖速率随着菌丝体干重指数增加呈指数方式增加,特别是发酵后期为菌丝体合成三萜酸提供能量。指数补料方式更适合灵芝生长和三萜酸合成。TANG等[34]开发了分批补料发酵策略,当残糖质量浓度在5~10 g/L时,补加15 g/L乳糖,灵芝酸产量达到330.2 mg/L,有效提高了灵芝酸产量。通过在过程中补料碳源(葡萄糖/乳糖),减少初始糖浓度,可以避免较高糖浓度对三萜酸合成抑制。在发酵过程中补充糖为灵芝菌丝体合成三萜酸提供能量,从而提高总三萜酸的产量。
在发酵过程中,pH、温度、溶氧、补料方式等发酵过程参数是影响灵芝发酵三萜酸合成关键因素。综合考虑灵芝菌丝体的比生长速率和灵芝胞内三萜的比合成速率,将各个因素分阶段调控灵芝发酵,或者在某个因素控制发酵的基础上结合其他影响因素,对液体发酵提高三萜酸含量具有参考意义。
2 外源物质对三萜酸的调控
13C同位素标记证明灵芝三萜酸是通过甲羟戊酸途径(mevalonate pathway,MVA)合成[35]。三萜酸主要通过三个阶段合成(图2)。第一阶段:前体物质法尼基焦磷酸生成。第二阶段:羊毛甾醇骨架生成。第三阶段:不同三萜酸的生成。羊毛甾醇经过氧化、羟基化和糖基化后生成不同结构的三萜酸。在灵芝三萜酸合成上游途径中有4种关键酶,分别为3-羟-3-甲基戊二酰辅酶A 还原酶(3-hydroxy-3-methylglutaryl coenzyme A reductase,HMGR)、法尼基磷酸合酶(farnesyl pyrophosphate synthase,FPS)、鲨烯合成酶(squalene synthase,SQS)、羊毛甾醇合酶(lanosterol synthase,LS)[36],在下游途径中,CYP450参与合成各种结构灵芝三萜酸[37]。
研究发现,在发酵体系中加入一些外源物质干预三萜酸合成途径,是获取高浓度三萜酸有效策略。本文阐述了中草药、金属离子、植物激素、油脂类化合物及其他物质对三萜酸合成的影响。
2.1 添加中草药双向液体发酵
我国中草药资源丰富,所含活性物质多样。采用双向发酵技术,将中药添加到发酵液中,可为灵芝生长提供营养基质并影响灵芝细胞壁通透性,促进菌丝体生长和三萜酸合成。
朱强等[38]发现添加6 g/L甘草后灵芝胞内三萜量达到最大值,为0.238 g/L;添加8 g/L甘草后胞外三萜量达到最大值,为0.653 g/L。比未添加甘草组分别提高了179.49%和204.91%;李小娟等[39]也证明了甘草水提物对三萜合成具有促进作用。枸杞、金银花、桔梗、板蓝根水提物对灵芝菌丝体胞内外三萜合成均有促进作用。其中1 g/L枸杞水提物使得胞内三萜含量最高,达87.02 mg/L,0.25 g/L枸杞水提物得到胞外三萜含量最高为140.22 mg/L。另有研究报道枸杞、金银花、桔梗的醇提物也显著促进胞内外三萜的合成[40]。所以中草药提取物并非是作为有效碳源促进三萜酸合成,可能是中草药活性成分对三萜酸合成影响。从中草药种类来看,不同中草药其活性物质有所差异,而且提取液中活性物质成分复杂,对胞内外三萜酸影响并不是某个成分直接影响,而是各种成分综合效应的结果。
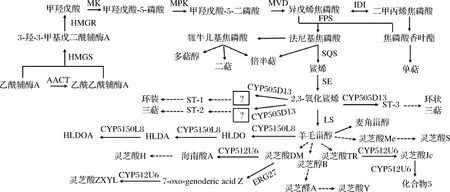
AACT-乙酰辅酶A乙酰转移酶;HMGs-3-羟基-3-甲基戊二酰CoA合酶;HMGR-3-羟基-3-甲基戊二酰CoA还原酶;MK-甲基戊酸激酶; MPK-甲羟戊酸激酶;MVD-甲羟戊酸脱羧酶;IDI-异戊烯焦磷酸异构酶;FPS-法尼基磷酸合酶;SQS-鲨烯合酶;SE-鲨烯环氧酶;LS-羊毛甾醇合酶图2 灵芝三萜酸合成途径Fig.2 Synthesis pathway of ganoderma triterpene acid
鱼腥草和杜仲对胞内三萜合成具有一定抑制作用,但是可以促进胞外三萜酸合成;而党参、茶叶对灵芝菌丝体胞内三萜酸合成有促进作用,但是抑制胞外灵芝三萜酸合成[39]。其原因可能是中草药的添加影响了灵芝细胞壁某些成分的合成代谢, 使灵芝细胞壁通透性增加/减少,另者是中草药能促进/抑制胞外三萜酸的合成代谢。目前已有研究表明,与灵芝细胞壁合成相关基因(mapk4、SWI6、Skn7、14-3-3蛋白)影响灵芝三萜酸合成[41-44],可通过检测中草药对灵芝细胞壁相关蛋白表达的影响,进而判断中草药是否影响细胞壁的合成或者通透性来调控三萜酸的合成或分泌。
2.2 添加金属离子
金属离子在真菌的生长发育以及代谢中具有重要作用,不仅参与细胞生长、调节细胞通透性、作为酶的辅因子参与次级物质代谢[45],而且影响细胞内外离子平衡,进而引起胞内Ca2+浓度上升,触发钙信号,调节三萜酸代谢[46]。
根据研究报道,在发酵培养基中添加10 mmol/L Ca2+,总灵芝酸产量、灵芝酸Mk、灵芝酸T,灵芝酸S和灵芝酸Me比对照组提高了3.7、2.6、4.5、3.2、3.8倍,含量分别为86.45、2.55、10.90、2.79、5.08 mg/g DW[47]。LI等[48]在发酵过程中将氮源限制与Ca2+添加相结合,比单独添加Ca2+更能提高灵芝酸产量。此外,添加Na+、Mn2+均可促进灵芝酸的合成。添加Ca2+、Na+、Mn2+后,灵芝酸合成基因hmgr,sqs和ls以及钙感应蛋白基因cam,cna和crzl的转录水平均显著上调,说明添加Ca2+、Na+、Mn2+是通过激活Ca2+信号通路和三萜酸合成关键酶基因的转录水平来提高三萜酸产量[47, 49- 50]。Cu2+在3 mmol/L下,灵芝酸合成量最高,其含量高于对照组91%[51],鲍锐[52]在培养基中添加100 mol/L硫酸铜作为Cu2+供体,灵芝酸产量达到207.773 mg/L,是对照组的1.57倍。铜离子通过增强ROS和Ca2+信号转导,并上调ls和sqs的转录水平诱导三萜酸的合成。
微量的稀土元素镨与镧同样具有明显的诱导三萜酸合成的作用。当两者在0.1 mmol/L时,胞内三萜的产量分别达到347.59、398.49 mg/L,分别为对照组的1.67、1.91 倍;当在0.001 mmol/L时,胞外三萜产量分别达到610.08、489.22 mg/L,分别为对照组的2.03、1.63 倍[53]。
2.3 添加植物激素
植物激素具有调节真菌生长、次级代谢产物合成以及诱导孢子萌发的作用[54]。在众多植物激素中,茉莉酸甲酯(methyl jasmonate,MeJA)研究较为深入。REN等[55]在发酵第6天向培养基中添加254 μmol/L MeJA,根据Rt-PCR检测发现,灵芝酸合成途径相关酶基因(hmgr、mvd、fps、sqs、ls)的转录水平上调,从而诱导灵芝酸的合成,灵芝酸含量达到4.52 mg/100mg DW,比对照组提高了45.3%。辛燕花等[56]使用100 μmol/L的 MeJA对灵芝菌进行诱导,发现诱导后的胞内灵芝酸是对照组的1.93倍,胞外灵芝酸产量是对照组的2.21倍。另有研究表明,50 μmol/L的MeJA会导致细胞氧化还原酶失衡,进而产生ROS信号,参与调控灵芝酸生物合成。此外,MeJA可以诱导细胞色素P450氧化还原酶合成[57],细胞色素P450氧化还原酶含量增加也进一步表明MeJA可以促进灵芝酸的合成。
叶丽云等[58]在灵芝液体发酵第12天时添加150 μmol/L水杨酸(salicylic acid,SA),对关键酶分析发现,fps、sqs和ls的表达量上调,导致三萜含量增加,三萜含量达到45.74 mg/g,比对照组高37.19%。LIU等[59]发现SA是通过抑制线粒体复合体Ⅲ的活性,增加了ROS的生成,从而诱导三萜的生物合成。
乙烯作为重要的植物激素,对灵芝生长及三萜酸合成具有促进作用。因乙烯很难处理,乙烯利会释放出乙烯,所以在植物中常用乙烯利(又称2-氯乙基磷酸)代替乙烯。使用15.9 mmol/L乙烯利诱导灵芝15.5 h后,灵芝酸产量增加了90%,含量为33 mg/g DW,羊毛甾醇及角鲨烯的含量增加了近2倍。与对照组相比hmgr,sqs和ls的mRNA 水平分别上升了2.6、4.3、3.8倍[60]。
植物激素可能是通过ROS信号转导途径上调灵芝三萜酸合成关键酶基因转录表达,促进三萜酸的合成。
2.4 添加油脂类化合物
油脂类化合物在液体发酵过程中除了作为消泡剂使用,也可作为诱导物质影响真菌细胞膜的结构及通透性或者酶活性,刺激真菌的生长代谢[61]。油酸存在于动植物体内,具有食用安全性,价格低廉等优点。孙冰沁[62]在培养基中添加4.38%(体积分数)油酸,发酵9 d后三萜产量达287.67 mg/100mL。进一步发现,添加油酸后,合成灵芝三萜的sqs和cyp450关键基因表达上调,从而促进三萜的合成。FENG等[63]发现,添加30 mL/L油酸,得到三萜的产量为1.076 g/L。姚强等[64]研究发现亚油酸对三萜合成具有较强的促进作用, 当添加量为2.0 g/L 时, 胞内、胞外三萜量分别达到394.23、551.32 mg/L,比对照组分别提高了1.13、1.12 倍。同时研究者还发现硬脂酸与棕榈酸对三萜酸的产生具有抑制作用。对薏苡仁油成分分析发现,薏苡仁油含有89.54%酸类物质,其中油酸占比高达49.26%,亚油酸占比为31.94%,棕榈酸占比为17.83%,硬脂酸占比为0.97%[65]。LIU等[66]在发酵培养基中添加1.5 g/L薏苡仁油发酵6 d后,总灵芝酸含量79.90 mg/g,比对照组增加1.29倍。进一步研究发现,薏苡仁油诱导灵芝合成的CYP450酶比对照组增加了153%,NO、H2O2浓度也增加了5.37、6.23 倍,导致细胞内NO、ROS信号被激活。薏苡仁油通过促进CYP450酶的表达以及NO、ROS双信号串联转导途径调控三萜酸合成。
由于脂肪酸链的长短以及饱和度的不同导致油脂类化合物诱导三萜酸合成的效果不同[67]。植物油中富含不同类型及不同比例脂肪酸,对三萜酸的诱导效果也会有所差异,植物油对三萜酸的诱导应该是其所含的不同脂肪酸共同作用的效果。
2.5 其他干预物质
苯巴比妥是一种典型的P450诱导剂,能增加多种植物细胞色素P450酶的转录[68]。LIANG等[69]研究发现,添加100 μmol/L苯巴比妥能诱导总灵芝酸含量增加,为41.4 mg/g DW。与对照组相比,灵芝酸Mk,灵芝酸T,灵芝酸S,灵芝酸Me分别增加了47%,28%,36%,64%。醋酸是醋的主要成分,相对于其他诱导剂对人体的安全性较高。研究发现,5 mmol/L的醋酸可促进三萜酸生物合成的中间代谢物羊毛甾醇和鲨烯合成,并显著上调合成途径中sqs、ls、hmgs和cyp51的mRNA转录水平,使灵芝酸含量提高了92.4%,为3.98/100mg DW[70]。阿斯匹林通过Hog-1磷酸化介导灵芝细胞凋亡并诱导ROS大量产生,诱导三萜酸的大量合成。据报道,4 mmol/L阿斯匹林能显著提高lanosta-7,9(11), 24-trien-3α-01-26-oic acid(灵芝酸 24)和总灵芝酸的产量,分别为515.2、5 385 μg/100mg DW[71]。
灵芝在野外生长于木材中,木材中含有的木质素、纤维素以及半纤维素等可为灵芝生长提供能量,灵芝分泌木质纤维素酶降解木材中纤维素成分[72],纤维素部分解聚为微晶纤维素,1.5%微晶纤维素显著增加hmgr、sqs、ls表达水平,三萜含量显著提高了85.96%[73]。王俊杰等[74]研究发现培养基中添加15 g/L微颗粒Talc时,总灵芝酸含量达到1.51 mg/100mg DW,灵芝酸Mk,灵芝酸T和灵芝酸Me的含量最高为6.02、5.08、1.71 μg/100 mg DW,分别是对照组的1.6、4、1.9和1.4倍,并且鲨烯和羊毛甾醇含量比对照组高2.60、4.20倍,灵芝酸生物合成途径关键基因fps和cyp5150l8的表达量分别比对照组高2.35、1.53倍。
目前,液体发酵过程中添加诱导剂是提高三萜酸产量的主要策略。研究表明,一些中草药提取物(例如甘草、枸杞、金银花等)、MeJA、SA、油酸、大豆油、薏苡仁油、金属离子等均可通过增强信号转导并促进关键酶基因表达从而诱导三萜酸合成。但是中草药原产地不同导致效果存在差异,茉莉酸甲酯、水杨酸等价格昂贵,金属离子可能会产生安全性问题,因此需要通过实验才能筛选出安全性高、价格低廉且效果明显的诱导剂。
3 讨论
灵芝三萜酸具有抗癌、抗炎、免疫调节、助睡眠等多种药理作用,是开发药品及保健品的重要原料。液体发酵技术可以短时间制备三萜酸并且可大规模工业化生产,助力相关三萜酸产品的产业化发展。三萜酸合成是灵芝对外源胁迫防御反应的一部分,受环境条件和诱导物质调控。将发酵条件和外源物质模拟环境胁迫,从而促进三萜酸的生物合成。但是不恰当的环境胁迫会造成灵芝菌丝体生长抑制,导致总体三萜酸产量降低。通过综合考虑灵芝菌丝体的比生长速率和三萜酸比合成速率两方面因素,制定出既能促进菌丝体快速生长、缩短三萜酸合成延滞期,又能保证发酵后期三萜酸合成速率达到最大值的最佳发酵工艺。
外源物质的添加可诱导灵芝三萜酸的合成。一方面需要筛选出安全有效的诱导物质,制定最佳添加工艺(添加时间与添加量)。另一方面,三萜酸的合成过程涉及两个或多个协同信号通路,需要对各种诱导信号的转导机制进行研究,有助于提高三萜酸产量。目前,已有研究利用基因工程技术操作对三萜酸合成途径中关键酶基因过表达,转录因子进行基因修饰提高了三萜酸的产率。为此,将基因工程操作与诱导干预相结合的技术,或许可以作为提高三萜酸发酵生产的新策略。

