超声-酶法提取的豆腐柴低酯果胶理化性质及结构表征
刘昕,张驰,薛艾莲,赵吉春,曾凯芳,2,明建,2*
1(西南大学 食品科学学院,重庆,400715)2(西南大学 食品贮藏与物流研究中心,重庆,400715)
果胶是一种具有复杂结构的水溶性膳食纤维,可作为增稠剂、稳定剂、乳化剂广泛应用于食品、医药及化妆品行业。根据其酯化度可将果胶分为低酯果胶和高酯果胶。在制备凝胶时,低酯果胶需要的糖含量大大低于高酯果胶,因可用于减肥产品及特殊人群食品的制备而倍受关注。天然来源的低酯果胶极少,往往需要通过高酯果胶脱酯获得。豆腐柴(PremnamicrophyllaTurcz),又名“臭黄荆”,广泛分布于我国长江以南地区,是一种药食兼用野生植物。豆腐柴叶含有丰富的果胶、蛋白质及10多种氨基酸、粗纤维、β-胡萝卜素、黄酮类等营养成分,具有热量低、抗炎、抗衰老、降胆固醇、增强免疫力和排毒等功效,营养价值极高[1]。研究表明,豆腐柴叶中果胶含量达35%,可成为低酯果胶的潜在来源[2]。对豆腐柴低酯果胶进行探究不仅有助于大力开发豆腐柴资源,还可为我国果胶工业的发展提供新方向。
超声破碎提取技术是基于超声波的空化效应发挥作用,超声波促使提取液产生若干气泡,在气泡破裂的瞬间产生巨大的能量致使果胶溶出。超声破碎技术不仅能大幅提升产物得率,还能有效节省提取时间,如WANG等[3]对传统法、超声法提取柑橘果胶的效率进行比较,研究表明超声法在温度降低13.3 ℃,时间缩短37.78%的前提下,果胶得率提高了16.34%。酶法提取果胶可通过降解植物细胞壁,促进果胶基质溶出速率。在工业生产中,酶法提取可使用温和的提取剂,有效避免传统法提取中工业废水带来的污染[4]。因此,将超声破碎技术同酶法提取相结合,可有效提高豆腐柴果胶得率,缩短提取时间。目前,豆腐柴果胶研究主要集中于提取工艺的优化以及如半乳糖醛酸、酯化度等基本理化性质的测定。尚未见到探究超声-酶两步法提取的豆腐柴果胶理化特性及结构表征的研究。
因此,本研究以豆腐柴为原料,采取超声-酶两步法提取果胶,对其半乳糖醛酸、酯化度、色度等基本性质进行检测,通过高效液相色谱法测定其分子质量及单糖组成,采用傅里叶红外扫描(Fourier transform infrared spectroscopy,FTIR)、差示量热扫描 (differential scanning calorimeter,DSC)、热重扫描(Thermogravimetry,TG)、扫描电镜(scanning electron microscope,SEM)、X射线(X-ray diffraction,XRD)等对其结构进行表征,并对其流变特性、抗氧化活性进行探究,以期为豆腐柴低酯果胶的开发及综合利用提供理论依据。
1 材料与方法
1.1 材料与试剂
豆腐柴叶,由巫山县天煜奇叶农业开发有限公司提供。将豆腐柴叶清洗,晾干,微波灭酶,粉碎过60目筛后保存于干燥器中备用。
柠檬酸、柠檬酸钠、草酸铵、乙醇(均为分析纯),成都科龙化工试剂有限公司。
1.2 仪器与设备
SCIENTZ-1500F超声波分散仪,宁波新芝生物科技股份有限公司;LGJ-10真空冷冻干燥机,北京松原华兴科技有限公司;UltraScan Pro测色仪,美国Hunter Lab公司;Phenom Pro扫描电子显微镜,荷兰Phenom World公司;X′Pert PRO X射线衍射仪,荷兰帕纳科公司;TG209F1热重分析仪,德国耐驰公司;Spectrun100傅里叶红外光谱仪、DSC 4000差示扫描量热仪,美国Perkin Elmer公司;MCR302流变仪,奥地利安东帕公司。
1.3 实验方法
1.3.1 豆腐柴果胶的制备
取6 g豆腐柴叶粉末于烧杯中,以1∶60(g∶mL)的料液比加入6 g/L草酸铵溶液。经前期预实验优化,设置超声功率为525 W,超声时间为8 min。将处理后的样液离心(4 000 r/min,15 min),抽滤分离上清液与豆腐柴渣。取豆腐柴渣于烧杯中,加入2%(质量分数)的纤维素酶,以1∶60(g∶mL)的料液比加入0.05 mol/L的柠檬酸-柠檬酸钠缓冲液。在50 ℃下搅拌15 min后,沸水浴灭酶5 min。将样液离心(4 000 r/min,15 min),抽滤,将其上清液与超声处理得到的上清液混合浓缩后,加入浓缩液同体积的乙醇,4 ℃下静置过夜。用少量乙醇、纯水先后洗涤果胶后,冷冻干燥,于干燥器中保存备用。
1.3.2 豆腐柴果胶一般营养成分
采用间羟基联苯法测定豆腐柴果胶中总糖醛酸含量,根据ZOUAMBIA等[5]的方法略做修改;Folin-酚法测定豆腐柴果胶中的总酚含量[6];考马斯亮蓝法测定豆腐柴果胶中蛋白质含量[7];苯酚-硫酸法测定豆腐柴果胶中总糖含量[7];滴定法测定豆腐柴果胶酯化度[8]。
1.3.3 单糖组成分析
参考刘瑶等[9]的方法并略作修改,采用高效液相色谱法测定豆腐柴果胶单糖组成。
取样品于安瓿瓶中,加入三氟乙酸,于110 ℃下酸解8 h,冷却后用氮吹仪吹干,调样品至中性,用超纯水定容。
分别精密称取各标准单糖,将其等摩尔混合,配制成标准单糖混合溶液。分别吸取400 μL标准单糖混合溶液、水解后样品于离心管中,加入乳糖溶液作为内标,接着加入NaOH溶液和1-苯基-3-甲基-5-吡唑啉酮(3-Methyl-1-phenyl-2-pyrazolin-5-one,PMP)溶液,涡旋振荡,70 ℃水浴反应30 min。加入HCl溶液,再加入1 mL 氯仿反复萃取3次,取水层过0.22 μm水系滤膜,待用。
使用C18色谱柱,采用紫外检测器(波长250 nm),以不同体积分数乙腈分别与0.05 mol/L磷酸盐缓冲溶液作为流动相的A相[φ(乙腈)=15%]、B相[φ(乙腈)=40%],流速为0.7 mL/min,进样体积20 μL。
1.3.4 分子质量测定
参考杨文丽等[10]的方法并略作修改。采用高效体积排阻色谱法测定豆腐柴果胶分子质量,取不同分子质量的葡聚糖标准品及果胶样品0.5 mg,分别溶于1 mL超纯水中,过0.45 μm水膜备用。
使用7.8×300 mm i.d.TSK G4000 PWXL-SEC色谱柱、示差检测器,以体积分数为0.02% NaN3溶液为流动相,设置流速为0.6 mL/min,进样量为20 μL,检测时间为30 min,柱温为40 ℃。
1.3.5 色度测定
参考LIEW等[11]的方法,以白板作为参考,使用测色仪测定果胶样品亮度值CIELab坐标(L*、a*、b*),根据公式(1)和公式(2)计算色相角H及色度C。
(1)
(2)
1.3.6 傅里叶红外光谱扫描
参考OGUTU等[12]的方法。取1~2 mg样品于玛瑙研钵中,按质量比1∶50加入干燥的溴化钾粉末,研细后加入压膜器内制片,扫描范围4 000~400 cm-1,扫描次数32次,分辨率4 cm-1。
1.3.7 差示量热扫描
参考EINHORN-STOLL等[13]的方法并略作修改。取1~5 mg样品于铝盘中,用空铝盘作为参考进行DSC检测。在氮气环境下以10 ℃/min速率升温,检测温度范围为20~300 ℃。
1.3.8 热重分析
参考EINHORN-STOLL等[13]的方法并略作修改。取1~5 mg果胶样品,在氮气环境下进行热重检测,以10 ℃/min速率升温,检测温度为50~600 ℃。
1.3.9 扫描电镜分析[14]
取少量豆腐柴果胶样品,使用导电胶将样品黏于样品台上,清理黏附不牢固的样品粉末。将样品置于离子溅射仪中进行喷金处理后,在10 kV加速电压条件下放大观察样品形态特征并拍照。
1.3.10 X射线衍射
参考KAZEMI等[15]的方法并略作修改,将豆腐柴果胶研磨至粉末状后过200目筛。取少量粉状豆腐柴果胶于承载框内,通过压样使其表面平整紧密。X射线检测条件:衍射角为10°~80°,扫描速率为5°/min。
1.3.11 流变特性测定
参考JIANG等[16]的方法并略作修改。将果胶样品溶于去离子水中配成质量浓度为2.5、5、10、15 g/L的溶液。使用平板探头(直径60 mm),在25 ℃下测量剪切速率(0.1~100 s-1)变化下的表观黏度曲线。
选取质量浓度为10 g/L的果胶溶液为样品,使用平板探头(直径60 mm)在25 ℃下进行动态振荡扫描实验,测定频率在0.1~10 Hz的储能模量(G′)与损耗模量(G″)。
1.3.12 抗氧化性活性测定
(1)DPPH自由基清除率[17]
配制不同浓度的果胶溶液及0.1 mmol/L的DPPH乙醇溶液。将样品与试剂按体积比1:1混合均匀后,避光保存30 min。在517 nm下测定样品吸光值A1及纯水、乙醇混合溶液(1∶1)吸光值A0。按公式(3)计算DPPH自由基清除率:
(3)
(2)ABTS阳离子自由基清除率[17]
制备25 mL ABTS储备溶液(7 mmol/L),其中过硫酸钾溶液2.45 mmol/L,常温下避光反应16 h得到ABTS溶液。用PBS缓冲液(10 mol/L,pH 7.4)稀释ABTS溶液,使其在734 nm处吸光度为0.70±0.02,得到ABTS工作液。分别取1 mL不同浓度果胶样品溶液与3 mL ABTS工作液混合,避光反应10 min。在734 nm下测定样品吸光度A1,以纯水作试剂空白,测定吸光度为A0。按公式(4)计算ABTS阳离子自由基清除率:
(4)
1.3.13 数据分析
每个实验重复2次,每个样品平行测定3次,结果以平均值±标准偏差表示,使用Origin Pro 9.6作图。
2 结果与分析
2.1 豆腐柴果胶得率及基本性质
豆腐柴果胶得率、基本性质及单糖组成如表1所示。通过超声-酶两步法对豆腐柴果胶进行提取,其得率较高,达到35.53%。LU等[18]通过传统酸提法优化制备豆腐柴果胶,在最佳条件下(90 ℃,2 h),其果胶得率为18.25%。相比之下,超声-酶法制备豆腐柴果胶不仅大幅提升得率,还能有效缩短提取时间。
豆腐柴果胶的L*、a*、b*、DE值分别为81.22、1.76、5.39、19.71,其亮度值较高,颜色与白板间存在肉眼可见的差异,略微偏向黄色以及极其微弱的红色。根据H值(71.86°)可知,豆腐柴果胶偏向黄色[19]。其饱和度C值为5.67,表明其饱和度较低[20]。色差指标表明,豆腐柴果胶颜色较亮,呈现浅黄色。
豆腐柴果胶的总酚、总蛋白含量分别为2.73%、2.84%。总糖、总糖醛酸分别达到22.25%、81.17%。豆腐柴果胶酯化度为16.80%,为低酯果胶。这与PAN等[21]的研究结果基本一致,其研究通过草酸铵加热提取法提取豆腐柴果胶,测得其酯化度为13.69%。
豆腐柴果胶分子质量的Mw为27.24 kDa,Mn为15.30 kDa,Mw/Mn为1.78,表明豆腐柴果胶分子质量较低,且较为均一。WANG等[22]对经不同提取法获得的芒果皮果胶进行了表征,相比酸提取,超声提取的果胶分子量降低43%。ZHANG等[23]探究了超声对果胶结构的影响,结果表明超声波可促进果胶分子量的降低。
豆腐柴果胶单糖组成中半乳糖醛酸(trigalacturonic acid,GalA)含量最高,为42.34%。葡萄糖(glucose,Glc)、L-鼠李糖(L-rhamnose monohydrate,Rha)、D-半乳糖(D-galactosamine, Gal)、L-阿拉伯糖(L-arabinose,Ara)及岩藻糖(L-fucose,Fuc)等是主要的中性单糖组成。其中Glc含量最高,达30.16%,这可能是由于纤维素酶对细胞壁的降解导致。果胶结构可分为同型半乳糖醛酸聚糖(homogalacturonan,HG)、鼠李半乳糖醛酸聚糖Ⅰ(rhamngalacturonan-Ⅰ,RG-Ⅰ)及鼠李半乳糖醛酸聚糖Ⅱ(rhamngalacturonan-Ⅱ,RG-Ⅱ)。通过计算相关单糖比例可以评价果胶结构的线性关系,Rha/GalA比值可评价RG对果胶结构的贡献。(Ara+Gal)/Rha值越高,RG-Ⅰ型结构中侧链越长。GalA/(Rha+Gal+Ara+Fuc)可评价果胶线性度(值越大,线性度越高)。豆腐柴果胶的Rha/GalA值(0.10)介于0.05~1.00,其结构主要为RG-Ⅰ型[24]。其(Ara+Gal)/Rha、GalA/(Rha+Gal+Ara+Fuc)值分别为0.95、1.57。经超声提取的柑橘果胶的(Ara+Gal)/Rha为3.68[3],商业苹果果胶GalA/(Rha+Gal+Ara+Fuc)为4.22[25]。单糖组成分析结果表明豆腐柴果胶结构线性度较低,以含有较短侧链的RG-Ⅰ型为主要结构[21,26]。

表1 豆腐柴果胶得率、基本性质及组成Table 1 Yield, basic properties and composition of pectin from Premna microphylla Turcz
2.2 傅里叶红外光谱分析
豆腐柴果胶的红外光谱如图1-a所示。3 194 cm-1处的宽吸收峰对应于多糖中羟基的O—H伸缩振动,2 936 cm-1处的吸收峰对应于CH、CH2、CH3的C—H的伸缩振动。果胶通常在1 600~1 700 cm-1处及1 700~1 800 cm-1处出现特征峰,分别由游离羧基、酯化羧基的振动引起。豆腐柴果胶在1 642 cm-1处具有高透射率,然而并未出现酯化羧基的吸收峰(1 700~1 800 cm-1处),这可能是由于其酯化度较低的原因,这与PAN等[21]研究结果类似。1 403、1 324 cm-1处的吸收峰表明果胶中存在羧基。1 016~1 145 cm-1处的吸收峰是由糖环中的C—O—C、C—O—H振动引起,1 072 cm-1处的信号值主要是由半乳糖、阿拉伯糖等中性糖引起[27]。950~1 200 cm-1图谱较为复杂,被认为是碳水化合物的“指纹”区域[5,28-29]。上述这些特征峰证实了样品中果胶的存在。
2.3 差示量热扫描及热重分析
豆腐柴果胶的DSC、TG图谱如图1-b所示。图中实线为DSC曲线,记录了升温期间反应焓的变化,虚线为TG曲线,记录升温期间果胶重量的改变。根据TG结果可知,豆腐柴果胶随温度提升发生的变化主要可分为40~150 ℃及150~400 ℃2个阶段。第一个阶段中,果胶中的水分受热蒸发引起质量下降,同时,DSC扫描图谱显示其在此阶段(78.6 ℃左右)出现第1个吸热峰。在第二阶段中,DSC图谱中在259.3 ℃出现一个放热峰,TG图谱中显示其质量降低至37.5%。此阶段中,果胶结构受热降解,发生糖苷键断裂、脱羧反应等现象[30-31]。出现峰值的温度越靠右,表明样品具有更好的热稳定性[13]。JIANG等[32]对商品柑橘果胶及柿皮果胶进行了DSC、TG扫描,其吸热峰分别出现在94.05和72.45 ℃,放热峰分别在241.76 ℃和248.26 ℃。相对柿皮果胶而言,豆腐柴果胶吸热峰及放热峰出现位置都更靠右,这表明豆腐柴果胶具有相对较好的热稳定性。
2.4 X射线衍射图谱
豆腐柴果胶的X衍射图谱(图1-c)中有多个尖锐且强烈的峰,在17.0°、30.8°、31.6°、34.4°、38.6°、41.4°、44.3°、47.2°、55.3°出现了明显的尖峰,这与KAZEMI等[15]的结果类似,表明其具有一定的结晶度。相对无定形态果胶,豆腐柴果胶等结晶度较高的果胶具有更大的分子间力,相对更难溶解[11]。受来源及提取方法影响,果胶结晶度有较大差异[31]。如超声提取法可能会增加果胶的结晶度,用超声法制备的茄皮果胶,其X衍射图谱出现尖锐强烈的峰,具有较好的结晶度[33]。
2.5 扫描电镜图像
SEM分析(图1-d)发现,豆腐柴果胶表面相对粗糙,带有一些褶皱,出现较多孔隙。这可能是由于超声及酶处理导致果胶结构破裂,出现孔隙结构。这与XU等[34]测定的结果类似,传统法与超声法提取的柚皮果胶的SEM图像显示,经超声处理过的果胶表面形态发生了较大变化,组织变的多孔并出现了裂缝。
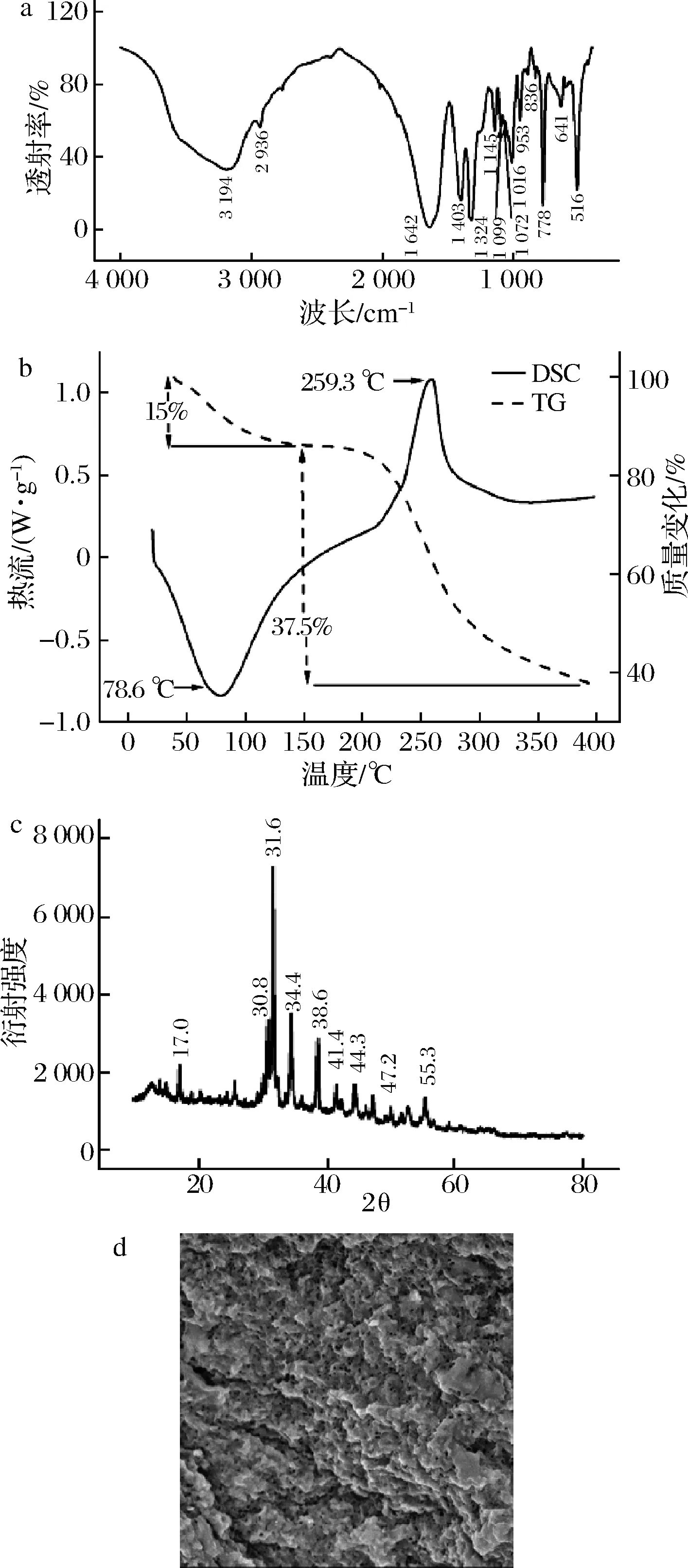
a-FTIR分析;b-DSC、TG图谱;c-XRD图谱;d-SEM图像图1 豆腐柴果胶的结构表征结果Fig.1 The structure characterization results of pectin from Premna microphylla Turcz
2.6 流变特性
图2-a、图2-c分别显示了不同浓度豆腐柴果胶、商品苹果果胶溶液黏度随剪切速率变化的过程。随着剪切速率的增加,不同浓度的2种果胶溶液表观黏度均下降,出现剪切变稀现象,具有明显的非牛顿假塑性特征,这主要是因为果胶分子间力受外界力增加而逐渐减弱[35-36]。果胶黏度对浓度具有依赖性,随着果胶浓度的增加,果胶分子间距离缩短,分子间作用力增加,最终果胶的黏度呈现上升的趋势。在低浓度下,果胶分子间相距较远,彼此无法相互作用而难以形成空间网状结构。随着果胶浓度增加,分子间距离缩短进而相互缠结形成网状结构,增加果胶溶液黏度[37]。相对商品苹果果胶,豆腐柴果胶黏度更低。在无金属离子存在下,果胶黏度随其酯化度增加而增加[38]。因此,酯化度可能是导致2种果胶黏度存在差异的原因(前期测得商品苹果果胶酯化度为68.42%)。
选取质量浓度为10 g/L的豆腐柴果胶、商品苹果果胶溶液进行动态振荡扫描流变学研究,测定果胶溶液的储能模量(G′)和损耗模量(G″)如图2-b、图2-d所示。G′、G″分别又被称作弹性模量、黏性模量,反映样品的弹性及黏性。2种果胶溶液的G′均高于G″,机械响应表现为凝胶状,表现出较好的弹性[39]。tanδ为G″与G′的比值,其值越大,表明样品中黏性成分比重更大,样品呈流体状态[40]。豆腐柴果胶tanδ为0.46左右,商品苹果果胶tanδ为0.12~0.23,相比而言,豆腐柴果胶溶液的流体性质更加明显。

a, c-豆腐柴果胶;b, d-商品苹果果胶图2 豆腐柴果胶的流变特性Fig.2 The rheological properties results of pectin from Premna microphylla Turcz
2.7 抗氧化活性
DPPH自由基含有单电子,可稳定地存在于有机溶液中,其乙醇溶液呈现紫色。ABTS与过硫酸钾可生成ABTS阳离子自由基,其溶液呈现深绿色。果胶等多糖具有一定的抗氧化能力,其分子结构中的还原性末端含有半缩醛羟基,可提供质子还原DPPH自由基及ABTS阳离子自由基,将其转换为无色溶液,降低其在最高吸收波长下的吸光值。
选取质量浓度为0.125、0.25、0.50、1.00、2.00 g/L豆腐柴果胶溶液,测定其DPPH自由基及ABTS阳离子自由基清除率,探究其抗氧化能力,结果如图3所示。在0.125~0.50 g/L,豆腐柴果胶抗氧化性表现出强烈的剂量依赖性,浓度越高,其抗氧化能力越好,两者呈现的线性关系较好。在此范围内计算得出豆腐柴果胶溶液DPPH自由基、ABTS阳离子自由基清除率IC50值分别为0.37、0.34 g/L。IC50值越低证明其抗氧化效果越好。巫永华等[41]测定了牛蒡多糖不同组分的DPPH自由基清除率的IC50值为0.62 g/L。郑恒光等[42]提取的杏鲍菇多糖ABTS阳离子自由基清除率IC50超过3 g/L。
在0.50~2.00 g/L,果胶的自由基清除率增加的趋势减缓。在果胶质量浓度达到2.00 g/L时,豆腐柴果胶的DPPH自由基、ABTS阳离子自由基清除率分别达到87.01%、96.08%。MZOUGHI等[43]测定了一种碱蓬属植物(Suaedafruticosa)果胶的抗氧化活性,其质量浓度为10 g/L时,DPPH自由基、ABTS阳离子自由基清除率分别为69.5%、69%。因此,通过比较可知,豆腐柴果胶具有相对较好的抗氧化活性。

a-DPPH自由基;b-ABTS阳离子自由基图3 豆腐柴果胶的抗氧化性Fig.3 The antioxidant activity results of pectin from Premna microphylla Turcz
3 结论
通过超声-酶法提取豆腐柴果胶得率达到35.53%,证明超声-酶法可有效提高得率,缩短提取时间。获得的豆腐柴低酯果胶呈浅黄色,其表面粗糙,含有较多孔隙。就组成成分而言,豆腐柴果胶杂质含量较低,糖醛酸含量高,GalA、Glc、Rha、Gal、Ara及Fuc是其主要的单糖组成。豆腐柴果胶为较均一的低分子质量果胶,以短侧链的RG-Ⅰ型为主要结构,线性度较低,具有一定的结晶度。超声-酶法提取的豆腐柴果胶分子质量较低,可避免大分子质量果胶难以吸收、溶解度低的问题,具有更优异的生理活性。此外,豆腐柴果胶具有相对较好的热稳定性、流变特性及抗氧化能力。
综上所述,豆腐柴果胶可成为商品低酯果胶的良好来源。未来可将研究重点专注于豆腐柴果胶的生理活性,为豆腐柴果胶产品的开发提供新的方向。

