毛囊角化病九例ATP2A2基因突变研究
于学萍 赵 晴 夏倩倩 孙乐乐 糜自豪 王真真庞 政 于功奇 付希安 刘 红 张福仁,
1滨州医学院,山东烟台,264033;2山东第一医科大学附属皮肤病医院(山东省皮肤病医院,山东省皮肤病性病防治研究所),济南,250022
毛囊角化病(DD)是一种常染色体显性遗传性皮肤病,尽管其表型是可变的,但是具有较高的外显率[1]。DD的临床特征为脂溢性区域的疣状丘疹和斑块、有掌跖角化性凹点和甲营养不良[2]。1993年Craddock等[3]将DD的致病基因突变定位到染色体12q23-q24.1,1999年Sakuntabhai等[4]发现编码肌浆/内质网钙离子-ATP酶2(SERCA2)的ATP2A2基因与DD之间存在很强的相关性。SERCA2是内质网应激的启动因子,在Ca2+稳态中发挥重要作用[5]。到目前为止,已经报道了ATP2A2基因上超过298个变异引起的DD,但没有发现热点突变区域(http://www.lovd.nl/ATP2A2)。根据以前的文献,通过Sanger测序检测到60%~88% DD患者在ATP2A2上有突变[5]。然而,其余12%~40%患者的病因尚未阐明。我们在临床上收集了9例DD患者,通过Sanger直接测序法和全外显子组测序(WES)对患者进行突变检测,确定了基因突变位点。
1 对象与方法
1.1 研究对象 本研究选取来自我院皮肤科门诊的9例患者,最小发病年龄14岁,最大91岁,患者经临床及病理组织检查,确诊为DD,部分患者皮损见图1。患者签署知情同意书并收集病史资料及外周血。同时选取100名健康人作为对照。
1.2 研究方法
1.2.1 DNA提取 本研究经山东省皮肤病性病防治研究所伦理委员会批准,签署知情同意书后,抽取患者及其家属外周血5 mL,同时采集100名无亲缘关系的正常个体外周血5 mL作为对照,-80℃保存。采用DNA提取试剂盒(天根生化科技有限公司,北京)提取基因组DNA,并用全波长紫外/可见光扫描分光光度计ND-8000(Thermo Fisher公司,美国)测定其纯度及含量,将其标化为30 ng/μL的DNA模板。
1.2.2 Sanger测序 在NCBI网站(https://www.ncbi.nlm.nih.gov/tools/primer-blast/)上设计了19对引物,通过聚合酶链式反应(PCR)扩增ATP2A2基因全部21对外显子及侧翼序列,引物交由北京华大基因科技有限公司合成。25 μL PCR反应体系为:PCR taq mix 12.5 μL,dNTP上下游引物各1 μL,DNA模板(30 ng/μL)0.5 μL,ddH2O 10 μL。PCR反应条件:预变性94℃ 10 min,变性94℃ 30 s,退火55~59℃ 45 s,延伸72℃ 10 min,共进行35个循环,最后72℃延伸1 min。PCR产物经1.2%琼脂糖凝胶电泳检测。DNA 测序PCR产物经醋酸钠-乙醇沉淀法纯化后直接于ABI 3130XL基因分析仪(Applied Bio-systems,美国)上进行测序。突变分析所有测序结果经NCBI blast(http://blast.ncbi.nlm.nih.gov/Blast.cgi)数据库进行分析比对,用SIFT及Polyphen-2软件对基因突变进行功能预测。
1.2.3 全外显子组测序 对于不携带ATP2A2突变的患者,利用Biorupter(Diagenode,比利时)剪切每个样本的基因组DNA(200 ng),得到150~200 bp的片段。使用AIExome富集试剂盒V1(iGeneTech,中国北京)进行全外显子组测序,使用Illumina HiSeq 6000平台对150 bp配对端进行大规模平行测序。使用BWA v0.7.17程序将得到的reads映射到hg19/GRCh37人类参考基因组。随后,按照最佳实践执行了GATK v4.0.12.0来调用变体。采用bcftools对不同过滤步骤进行筛选和过滤。
1.2.4 突变分析 在两个公共变异数据库(1000 Genomes Project和Exome Aggregation Consortium)中过滤突变,以去除1000 Genomes Project中存在的突变或Exome Aggregation Consortium数据库中最小等位基因频率(MAF)大于0.01%的突变。对于筛选出来的变异,当错义突变在四种预测算法(SIFT、polyphen2、LRT和MutationTaster)中的至少三种中被预测为有害时,则被定义为具有有害突变。其他突变类型,如剪接位点突变、移码删除/插入和非移码删除/插入都被认为是破坏性的。最后,过滤后的突变在364个内部对照中得到进一步验证。
2 结果
通过对9例患者ATP2A2基因的直接测序,我们在5例DD患者中发现了1例已报道的突变和3例新突变(图2),包括2例非移码删除/插入(c.24_26delGGT,c.823_824insTAA)、1例剪接位点突变(c.119-2A>G)和1例错义突变(c.2803T>C)(表1)。在100个健康对照和两个公共变异数据库(1000 genome Project和Exome Aggregation Consortium)中均未检测到这些突变。
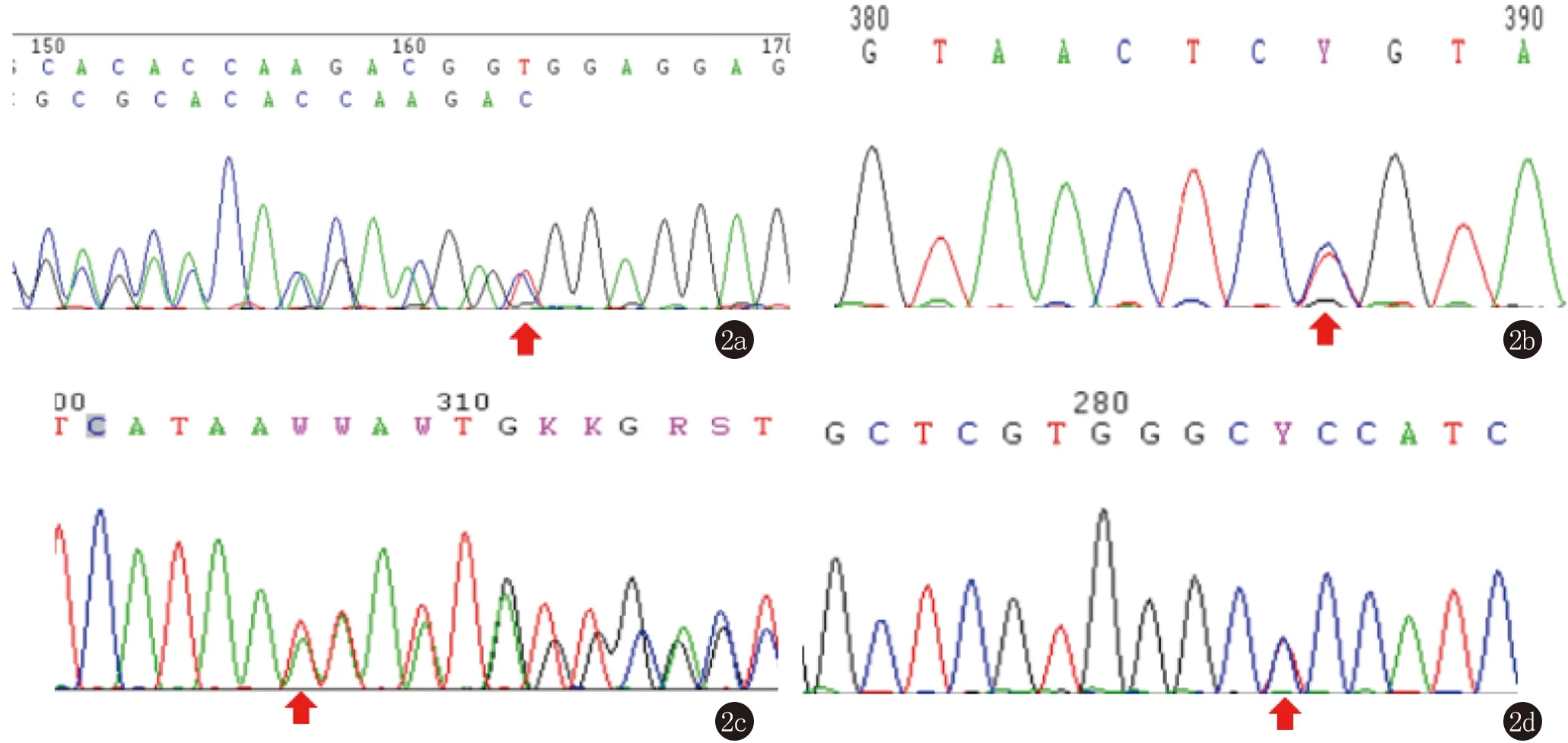
对ATP2A2无突变的患者进行WES检测,共发现了4个ATPase基因的4个突变,包括ITPR3基因的1个剪接位点突变(c.4789-3C>G),PLCB1(c.1666G>A)、RYR1(c.2179C>T)和ATP2B2(c.707T>C)基因上3个错义突变,通过公共数据库(1000 genome Project和Exome Aggregation Consortium)进行筛选后,ITPR3、PLCB1、RYR1上的3个突变均未见报道。此外,这些变体在364个内部对照中没有发现。ATP2B2基因上的突变(c.707T>C)在Exome Aggregation Consortium数据库中被检测到,而在其他两个数据库中则不存在(1/4326)(表2)。通过Sanger测序进一步证实了这些突变的存在(图3)。

表1 5例DD患者中发现的可能致病的ATP2A2变异
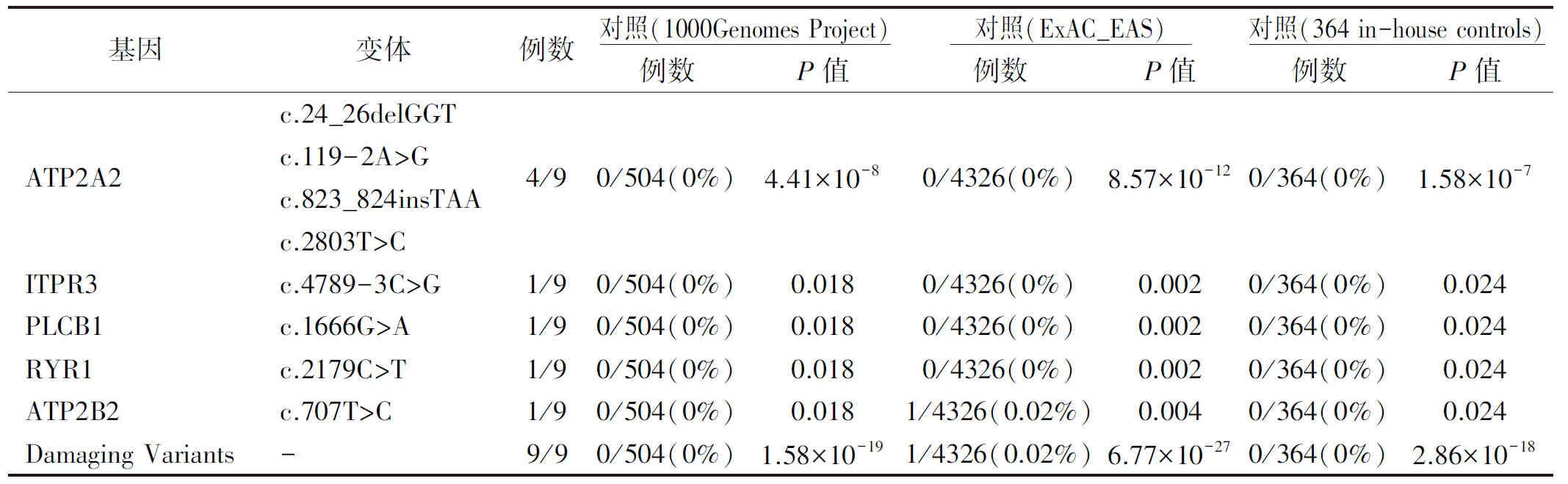
表2 突变频率分布

图1 1a、1b:颈部、腋窝部可见实质性小丘疹;1c:胸腹部散发褐色角化性丘疹,上覆褐色油腻性痂皮,部分融合成疣状斑块
2a:1号外显子突变 c.24_26delGGT; 2b:剪切位点突变 c.119-2A>G; 2c:8号外显子突变 c.823_824insTAA; 2d:19号外显子突变2803T>C
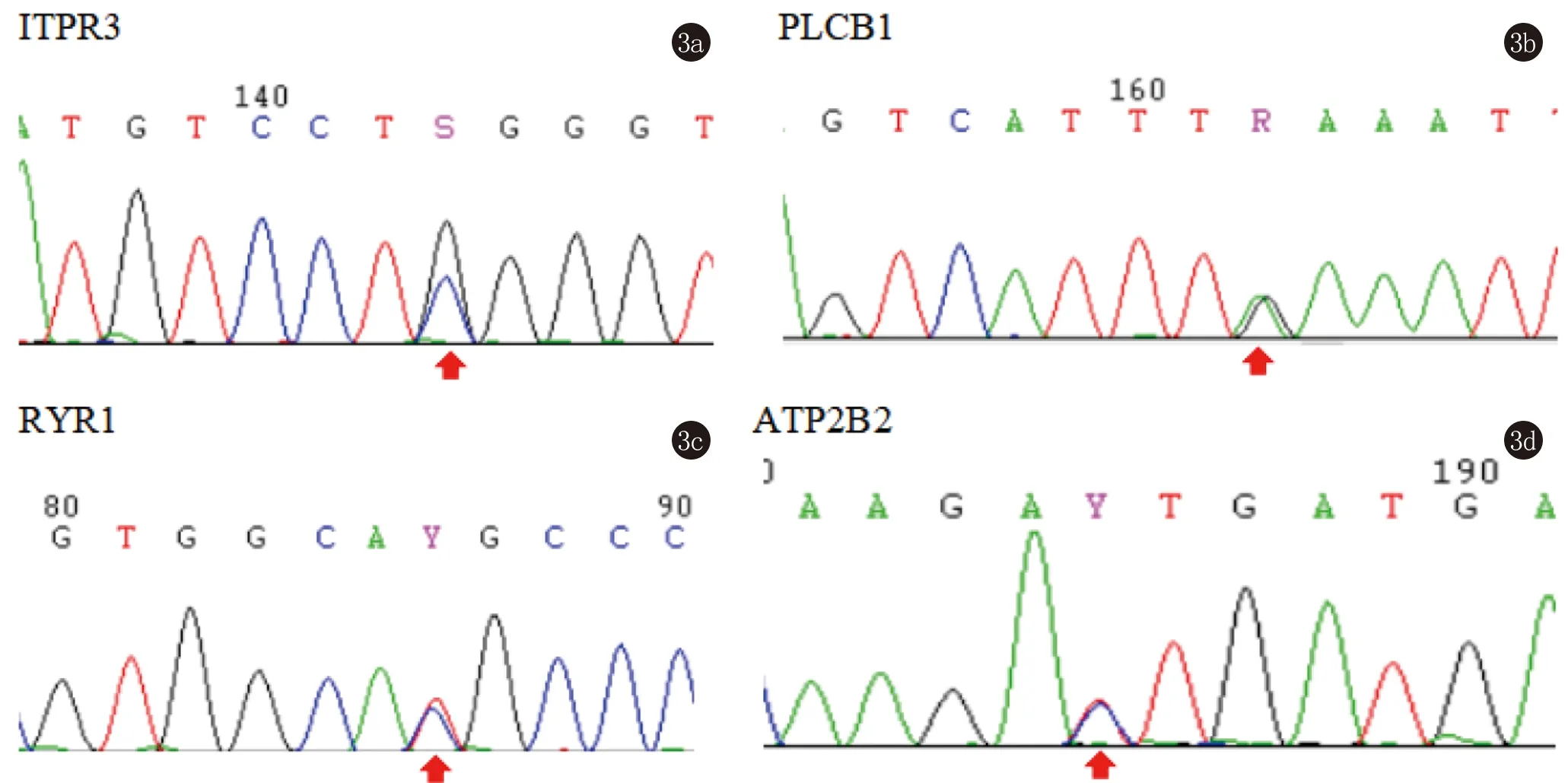
图3 4例DD患者其他基因中SNP的鉴定(c.4789-3C>G, c.1666G>A, c.2179C>T, c.707T>C)
3 讨论
DD是一种常染色体显性遗传病,由表皮钙稳态异常引起。1999年Sakuntabhai等[4]发现ATP2A2基因与DD之间存在很强的相关性。人类ATP2A2基因编码SERCA2蛋白,SERCA2将钙离子从胞浆转移至内质网内并对表皮的细胞连接和分化起重要作用[6]。ATP2A2基因长约76 Kb,包含 21 个外显子,由5个主要结构域组成,包括一个跨膜结构域(M),由11个跨膜蛋白(M1-M11)组成,5个连接区域(S1-S5)和3个细胞质结构域,其包括一个执行元件域(A)、一个核苷酸ATP结合结构域(N)和一个磷酸化结构域(P)[7]。自1999年以来,ATP2A2至少有298个突变被报道。然而,所有的变体在ATP2A2中分散分布,没有特定的突变热点[8],我们的发现与之前的研究一致。本文总结了报道的298个ATP2A2基因变异的分布。
在这些突变中,约5%(9/298)的突变破坏了M1和M2结构域,这是细胞质中高度保守的TGE基序,在ATP水解向Ca2+转运的能量传递过程中起至关重要的作用[4]。我们报道的ATP2A2 M3结构域的非移码插入c.823_824insTAA影响了管腔钙通道的运输功能[9]。约18.8%(56/298)的突变位于M4、M5、M6和M8,这些区域包含Ca2+结合位点,这些突变可导致Ca2+转运功能的完全丧失[10]。在M9和M10区域发现了大约3.3%(10/298)的突变,包括我们发现的突变(c.2803T>C),这可能影响ER膜的锚定[9]。报道的A、P和N域变异分别占21.5%(64/298)、15.1%(45/298)和20.8%(62/298)。在本研究中,两个新突变c.24_26delGGT和c.119-2A>G位于A结构域,在钙离子结合和改变位置方面发挥了重要作用[11]。此外,有28个突变(9.4%)位于细胞质连接区(S1-S5),这些区域辅助离子的转运[12]。
SERCA2可以调节Ca2+稳态。Ca2+信号通路在ER的钙隔离、钙黏蛋白的定位中起着至关重要的作用,因此Ca2+信号通路的失调可能导致DD的发生[13]。此外,SERCA2作为一种ATP酶,也通过Ca2+信号通路调节细胞间的粘附和钙稳态[14]。在本研究中,我们在4例无ATP2A2突变的DD患者中发现了4个ATP酶基因上的有害突变,且均参与了Ca2+信号通路的。Ca2+信号的产生包括1,4,5-三磷酸受体(Ins(1,4,5)P3R)和ryanodine受体(RyR)家族Ca2+通道的打开,随后Ca2+从内质网中迅速释放[15]。细胞外增加的Ca2+结合位于质膜的Ca2+受体(CaR),产生第二信使肌醇-1,4,5-三磷酸(IP3),通过与ITPR3结合导致内质网Ca2+释放[8]。同时,由ATP2B2编码的PMCA2蛋白和SERCA2蛋白均属于p型Ca2+蛋白ATP酶家族,被认为是高度保守的磷酸化DKTGT序列,该酶还参与Ca2+振荡的产生和细胞质Ca2+浓度的恢复[7]。因此,基于我们的研究结果,我们认为参与Ca2+信号通路的ATP酶基因的突变可能导致内质网和高尔基体Ca2+释放不足,从而导致钙紊乱并引起临床症状。然而,潜在的机制还没有被证明,我们需要增加样本数量,进一步进行功能测试来验证。
本文通过Sanger测序在5例DD患者中鉴定了3个新的ATP2A2基因变异和1个之前报道的突变。此外,在4例ATP2A2无突变的患者中,我们通过WES分析发现了分别位于4个ATP酶基因(ITPR3、PLCB1、RYR1、ATP2B2)的4个突变,这可能是导致本病的原因。我们的发现扩大了ATP2A2突变的范围,并为毛囊角化病提供了新的可能的发病机制。

