血清PS-PLA1水平与系统性红斑狼疮疾病活动相关性分析
曾 君 李时飞 周小芳 汪 婷 宋志强 翟志芳
陆军军医大学第一附属医院皮肤科,重庆,400038
SLE是一种病因尚未明确可累及多器官系统的自身免疫性疾病。目前已知机体细胞凋亡加速,凋亡细胞的清除缺陷是其重要的发病机制之一。近年来研究[1]显示PS-PLA1通过特异性水解磷脂酰丝氨酸(phosphatidylserine,PS)影响凋亡细胞的清除,在SLE发病中可能发挥重要作用。本研究通过检测并比较SLE患者与健康对照组PS-PLA1表达差异,及其与SLE疾病活动的相关性,旨在探讨PS-PLA1在SLE疾病活动评价中的价值,为临床诊疗提供参考依据。
1 资料与方法
1.1 研究对象 收集2019年1~12月就诊于我院的SLE患者101例,男7例,女94例,平均年龄(37.009±12.527)岁。患者纳入标准:①病例诊断明确,SLE诊断参照1997年美国风湿病协会(ACR)修订的分类标准[2],狼疮肾炎定义参照2019年中国狼疮肾炎诊断指南[3]。②临床病历资料完整。患者排除标准:肿瘤、妊娠、原发性肝肾疾病、感染性疾病及其它自身免疫性疾病。收集同期健康体检者85例,男4例,女81例,平均年龄(38.514±11.378)岁。两组年龄和性别均无明显差异。本研究获得本院伦理委员会批准。
1.2 临床资料与分组 收集SLE患者临床资料及实验室指标:基本信息包括性别、年龄、病程等;临床表现包括特异性皮疹(包括蝶形红斑、DLE、SCLE以及ACLE皮损)、黏膜溃疡、脱发、光过敏、关节痛等;实验性指标包括血常规如白细胞计数、红细胞计数、血红蛋白含量、血小板计数;尿常规如血尿、蛋白尿;血生化如血肌酐、血尿酸、白蛋白、谷丙转氨酶;补体(C3,C4)及CRP;自身抗体谱如抗dsDNA抗体、抗Sm抗体、抗SSA抗体、抗SSB抗体、抗心磷脂抗体、抗核小体抗体、抗组蛋白抗体和抗U1-RNP抗体等。根据SLEDAI评分对患者疾病活动进行分组[4]:稳定组31例(SLEDAI 0~4分),轻度活动组45例(SLEDAI 5~9分),中重度活动组25例(SLEDAI ≥10分);同时以SLEDAI 5~9分为低度活动组(45例),SLEDAI≥10分为高度活动组(25例)。
1.3 PS-PLA1检测 收集SLE患者及健康对照组空腹外周静脉血2 mL,室温下自然凝固15 min,离心机(德国eppendorf 5810R)离心20 min(2500 r/min),仔细收集上清。PS-PLA1检测ELISA试剂盒(江苏晶美公司)采用双抗体夹心法按照试剂盒具体操作步骤进行操作,测定各组血清中PS-PLA1水平,用酶标仪(美国BIO-RAD iMark)MPM6.0软件在450 nm波长下测定吸光度(OD值),每个标本设3个复孔,结果取平均值。根据标准品绘制标准曲线,计算各样本中PS-PLA1含量。
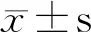
2 结果
2.1 SLE患者临床资料比较 101例SLE患者,稳定组31例,活动组(包括轻、中重活动组)70例。稳定期患者临床表现如特异性皮疹、关节痛、黏膜溃疡、脱发、光过敏、血尿、蛋白尿的发生率均显著低于活动组(均P<0.05)。稳定组患者实验室指标如补体C3、C4显著高于活动组(P<0.05);稳定组患者血尿酸值、抗dsDNA抗体和抗SM抗体阳性率显著低于活动组(P<0.05)。两组间白细胞计数、血红蛋白含量、血小板计数、血肌酐、白蛋白、谷丙转氨酶以及抗SSA抗体、抗SSB抗体、抗心磷脂抗体、抗核小体抗体、抗组蛋白抗体、抗U1-RNP抗体阳性率均无明显差异(P>0.05),见表1。
2.2 血清PS-PLA1的表达 SLE患者血清中PS-PLA1(35.555±10.098)ng/mL明显高于健康对照组(26.416±9.785)ng/mL,差异有统计学意义(t=6.236,P<0.001)。稳定组PS-PLA1(29.532±8.194)ng/mL明显低于活动组(38.222±9.752)ng/mL,差异有统计学意义(t=-4.328,P<0.001)。稳定组PS-PLA1与轻度活动组(34.790±8.854)ng/mL、中重度活动组(44.398±8.238)ng/mL三者间差异有统计学意义(F=21.459,P<0.001);组间比较均有显著差异(P值分别为0.009,<0.001,<0.001)。低度活动组PS-PLA1(34.790±8.854)ng/mL明显低于高度活动组(44.398±8.238)ng/mL,差异有统计学意义(t=-4.457,P<0.001),见图1。

注:*P、**P和***均P<0.001
图1 SLE患者不同疾病活动性组间PS-PLA1表达差异
本组研究中狼疮肾炎患者23例,非狼疮肾炎患者78例。狼疮肾炎组血清中PS-PLA1表达水平(37.365±11.815)ng/mL高于非狼疮肾炎组PS-PLA1(35.176±9.430)ng/mL,但差异无统计学意义(t=0.922,P=0.359)。
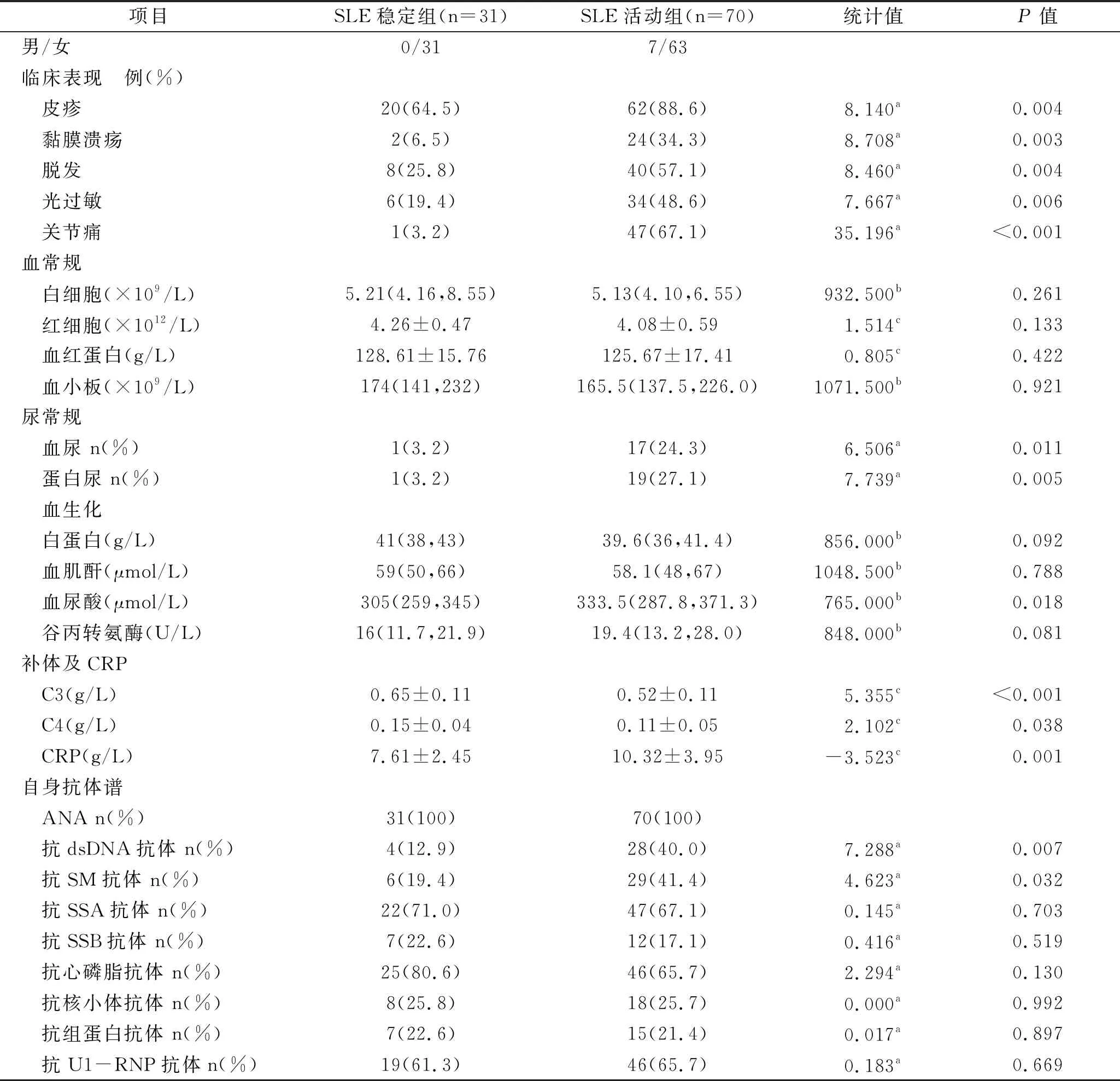
表1 SLE患者临床资料和实验室指标的组间差异比较
2.3 SLE患者PS-PLA1水平与实验室指标和SLEDAI评分的相关性 各单因素实验室指标在SLE稳定期与活动期的差异分析显示,P值<0.05的指标分别为PS-PLA1、血尿酸、C3、C4、CRP、抗dsDNA抗体和抗Sm抗体,将上述变量纳入多元线性回归模型,校正混杂因素后的得出PS-PLA1、C3、CRP是SLE病情活动的独立相关因素(表2)。
血清中PS-PLA1水平与C3、C4呈明显负相关(r=-0.318,P=0.001;r=-0.204,P=0.041);与CRP、抗dsDNA抗体和SLEDAI评分呈明显正相关(r=0.262,P=0.008;r=0.231,P=0.020;r=0.526,P<0.001)(图2);血清中PS-PLA1水平与白细胞计数、红细胞计数、血红蛋白含量、血小板计数等无明显相关性(P>0.05)。

表2 SLEDAI评分与实验室指标的多元线性回归分析
2.4 PS-PLA1与SLE疾病活动相关性的敏感性与特异性 PS-PLA1预测SLE疾病活动高低程度的ROC曲线结果显示:曲线下面积(AUC)为0.788,SE=0.054,95%CI=0.682~0.894,最佳临界值为0.467,PS-PLA1水平≥39.121 ng/mL时,敏感性为80.0%,特异性为66.7%,P<0.0001(图3a)。PS-PLA1诊断SLE的ROC曲线结果显示:AUC为0.739,SE=0.036,95%CI=0.669~0.810,最佳临界值为0.427,PS-PLA1水平≥31.670 ng/mL时,敏感性为71.300%,特异性为71.400%,P<0.0001(图3b)。
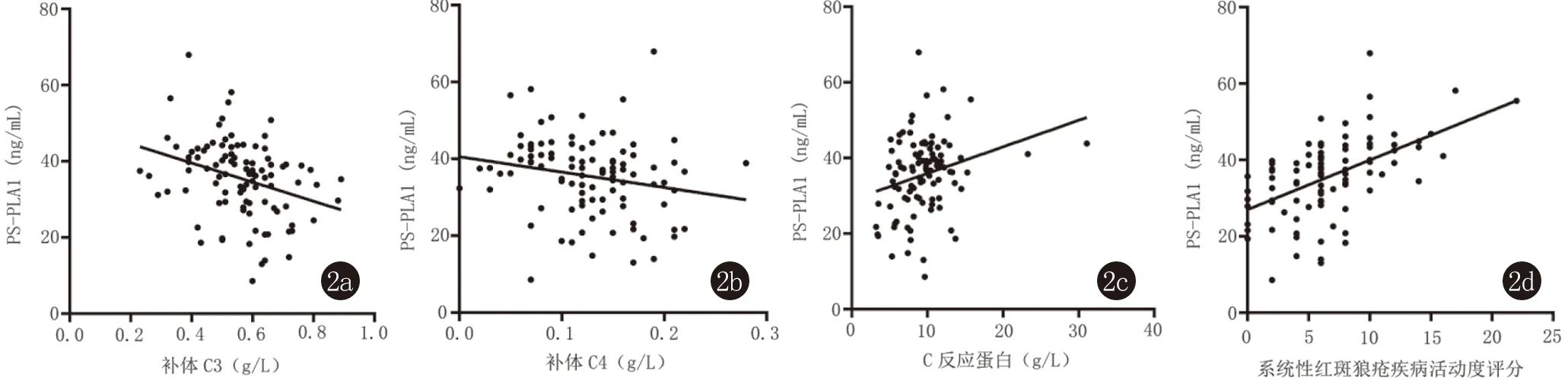
图2 SLE患者PS-PLA1表达水平与C3、C4、CRP和SLEDAI评分相关分析
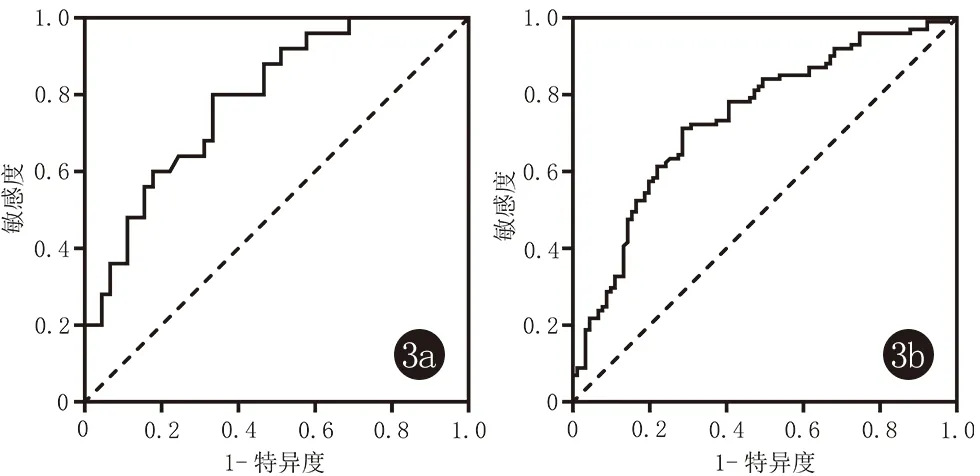
3a:PS-PLA1评价SLE疾病活动性的ROC曲线;3b:PS-PLA1诊断SLE的 ROC曲线
3 讨论
SLE是一种可以累及皮肤、肾脏、关节等多器官系统的慢性自身免疫性疾病,临床表现多种多样,预后差,死亡率高[5]。目前研究认为SLE是在遗传和环境因素相互作用下机体发生免疫反应异常[6],机体细胞凋亡加速,凋亡细胞清除机制受损,暴露的自身抗原诱导树突状细胞激活Th1和Th2细胞促进自身反应性B细胞产生大量自身抗体和多种细胞因子,形成免疫复合物,最终导致系统性炎症和多器官损伤[7-9]。临床上,SLE疾病活动评价主要采用SLEDAI评分、BILAG量表、ECLAM评分、SLAM评价体系等对疾病的活动进行评价,但因其相对繁琐,临床应用受到一定限制。临床上抗dsDNA抗体诊断SLE特异性高但敏感性低、CRP和C3诊断SLE敏感性高,但其干扰因素较多,对疾病活动判断的特异性较差。因此,探寻一个敏感性和特异性高、临床检测便捷的SLE病情活动性评价指标,对于临床SLE的治疗评价极其重要。
研究显示SLE患者体内凋亡细胞明显增多,胞膜内的磷脂酰丝氨酸(PS)暴露在胞膜脂质双分子层的外叶,成为细胞凋亡的标志,发出“Eat-Me”信号,诱导巨噬细胞迅速吞噬降解凋亡细胞[10]。PS-PLA1是胰脂肪酶基因家族中磷脂酶A1(PLA1)的成员之一,对PS有严格的底物特异性,能够在sn-1位点高效水解暴露于细胞膜外的PS并生成溶血磷脂酰丝氨酸(LysoPS)[11],使巨噬细胞和树突状细胞对凋亡细胞的识别减弱,引起凋亡清除过程的延迟和受损[12],提示PS-PLA1在凋亡缺陷机制中发挥关键作用。此外,随着对PS-PLA1的研究不断深入,发现其在结肠癌和黑素瘤中肿瘤细胞的浸润与转移[11,13]、丙型肝炎病毒复制[14]以及甲状腺功能亢进[15]等自身免疫性疾病的发病机制发挥重要作用。
PS-PLA1血清水平升高一定程度上反映细胞凋亡清除缺陷引起的针对自身抗原的免疫应答反应加重,因此,SLE患者PS-PLA1血清水平可以反映机体自身免疫性炎症轻重程度。Sawada等[16]研究证实,161例SLE患者血清PS-PLA1明显高于健康对照组,且与疾病活动度呈正相关,治疗后PS-PLA1水平明显下降。本研究也获得相似结果,而且SLE患者血清PS-PLA1血清水平与CRP、抗dsDNA抗体阳性率和SLEDAI评分呈显著正相关,与补体C3和C4呈负相关。PS-PLA1对SLE疾病活动高低评价的敏感性与特异性分别为80.0%、66.7%,对SLE诊断的敏感性与特异性分别为71.3%、71.4%。由此可见,PS-PLA1可望成为SLE诊断及病情评估的潜在生物标志物。
近年研究显示[17]动脉粥样硬化等心血管事件已逐渐成为SLE患者晚期死亡的主要原因之一。在动脉内膜脂蛋白异常沉积的基础上,特异性的免疫异常在粥样斑块的形成与发展发挥重要作用。文献报道[18],PS-PLA1水解PS的产物LysoPS是一类新型的生物活性脂类,可以诱导内皮细胞中粘附分子和趋化因子的表达、平滑肌细胞的迁移,亦能结合血小板表面高表达的LysoPS受体,活化血小板,可能参与SLE动脉粥样硬化疾病的发病过程。因此,PS-PLA1的异常升高可能通过上述途径间接参与SLE心血管疾病发生发展过程。因我们收集患者样本量偏差,合并心血管事件患者比例较少,故未能进行相关性评价,需要我们后续进一步深入探究。研究结果表明,PS-PLA1表达在狼疮肾炎组与非狼疮肾炎组无明显差异,提示PS-PLA1作为指标诊断SLE是否合并狼疮肾炎的价值有限。
综上,本研究表明SLE患者血清PS-PLA1水平显著高于健康人群,且其表达水平与SLE疾病活动度呈正相关,因此,血清PS-PLA1对评估SLE疾病活动性具有重要价值,可能成为SLE临床诊断及治疗评价的潜在生物学标志。由于本组研究样本量有限,同时未能对患者进行纵向随访评价,具有一定局限性,需要我们后期进一步深入研究验证。

