氧气和氯气氧化性强弱的探究
卫银银
摘要: 通过分析元素电负性和分子结构、反应电动势及吉布斯自由能的变化,对不同反应条件下的Cl2和O2氧化性强弱进行讨论和探究,发现二者氧化性强弱受外界条件影响较大。根据热力学计算结果分析Fe在氧气中燃烧的产物为Fe3O4的原因,认为不能简单地根据氧化产物中元素化合价高低比较氧化剂氧化性的强弱,还要结合热力学计算结果进行综合分析。
关键词: 氧化还原反应; 氧化性强弱比较; Cl2和O2; 热力学计算结果
文章编号: 1005-6629(2021)03-0095-03
中图分类号: G633.8
文献标识码: B
物质得电子的能力为氧化性,判断物质氧化能力强弱的方法有很多。其中,由不同氧化剂氧化同一种变价金属时,由氧化产物中变价金属元素化合价高低是判断物质氧化能力强弱的常用方法。如: 单质铁在氯气中点燃可被氧化生成FeCl3,而加热条件下单质硫只能将其氧化生成FeS,据此可判断氧化性Cl2>S。在日常学习中,有的学生及部分教师也会根据铁在氧气中燃烧生成Fe3O4(FeO·Fe2O3),氯气可以将铁氧化到更高化合价,判断出氧化性Cl2>O2。
但是,在地康法制氯气中,用氯化铜作催化剂,加热到450℃时,用空气中的氧气来氧化氯化氢气体制取了氯气[1]。其反应的化学方程式为:
4HCl+O2CuCl2450℃2H2O+2Cl2①
该反应中氧气为氧化剂,氯气为氧化产物。根据在同一氧化还原反应中氧化剂的氧化性大于氧化产物,可推断出该条件下氧化性O2>Cl2。那么,二者氧化性到底谁更强呢?
1 根据元素电负性进行比较
电负性体现元素的原子在形成化学键时吸引成键电子对的能力,能较全面地反映元素金属性和非金属性的强弱。根据鲍林(Linus Carl Pauling)的计算[2],O的电负性χP(O)=3.44, χP(Cl)=3.16,说明O原子得电子能力强于Cl原子,如Cl2O7中,氧为-2价,氯为+7价。那么能否据此说明氧化性O2>Cl2呢?
元素的电负性数值越大,元素的非金属性越强。但非金属单质的氧化性强弱不仅取决于元素的电负性大小,还和单质分子的空间构型以及原子间结合能大小有关。如O3和O2均为氧的单质,O3氧化性远大于O2;氮的电负性(3.04)仅次于氟(4.0)和氧(3.44),但由于N2分子内的三重键的键能大,N2分子稳定性强,氧化性弱,因而在通常条件下N2是化学惰性的,常用作保护气。
O2的分子轨道表示式为(σ1s)2(σ*1s)2(σ2s)2(σ*2s)2(σ2p)2(π2p)4(π*2p)2。其分子的结构式为。
对于O2分子而言,除了σ键外,还有两个三电子的π键,键级为2,其离解能D(O2)=494kJ/mol[3]。而Cl2分子中只存在σ键,键级为1,离解能D(Cl2)=243kJ/mol[4],D(O2)>D(Cl2),O2稳定性更好,需要吸收更多能量才能解离成O原子。综上,O元素的电负性大于Cl,O原子得电子能力更强,但O2分子内键能大于Cl2,稳定性更好。因此,难以通过比较O和Cl元素电负性大小以及O2、 Cl2分子内键能大小来比较二者的氧化性强弱。
2 根据反应电动势进行比较
氧化还原反应是由2个或多个氧化还原电对的半反应组成。若把由两电对组成的氧化还原反应设计成原电池,则两电对分别在两电极上发生氧化反应和还原反应。电池的电动势ε就是电对的电极电势差,即ε=φ正-φ负。若ε>0,反应能自发进行;若ε<0,反应不能自发进行。
将反应4HCl+O22H2O+2Cl2设计成原电池,其正极的电极反应式为O2+4H++4e-2H2O(酸性介质中),φθ(O2/H2O)=1.229V,负极的电极反应式为2Cl--2e-Cl2(酸性介质中),φθ(Cl2/Cl-)=1.358V。εθ=φθ(O2/H2O)-φθ(Cl2/Cl-)=1.229V-1.358V=-0.129V<0,说明该反应不能自发进行。而这与地康法制Cl2的事实不符。经分析,标准电极电势是用标准氢电极(参比电极,规定其电极电势为0V)与标准状态下各种标准电极在水溶液中组成原电池,测得该电池的电动势即为该电极的标准电极电势。标准电极电势是在特定条件下的水溶液中测得的,该反应εθ<0说明在该条件下(标准状态下,酸性水溶液介质中)不能自发进行,逆反应2H2O+2Cl24HCl+O2 εθ>0自发进行,尽管反应速率很慢。所以,说明在标准状态下,[H+]=1.0mol/L的酸性水溶液中氧化性Cl2>O2。比如,在Cl2(g)+H2O2(aq)2HCl(aq)+O2(g)反应中Cl2可将H2O2氧化置换出O2,也可以说明在溶液中Cl2的氧化性确实强于O2,与上述电极电势计算得出的结论一致。事实上,碱性条件下,φθ(Cl2/Cl-)=1.358V,大于φθ(O2/OH-)=0.401V,说明在标准状态下,[OH-]=1.0mol/L的水溶液中,氧化性Cl2>O2。但上述反应①并非在水溶液中发生的反应,因此,根据计算反应电动势来判断反应是否自发显然是不合理的,而且反应的介质、温度等条件都会对其产生影响。
3 根据热力学计算结果比较
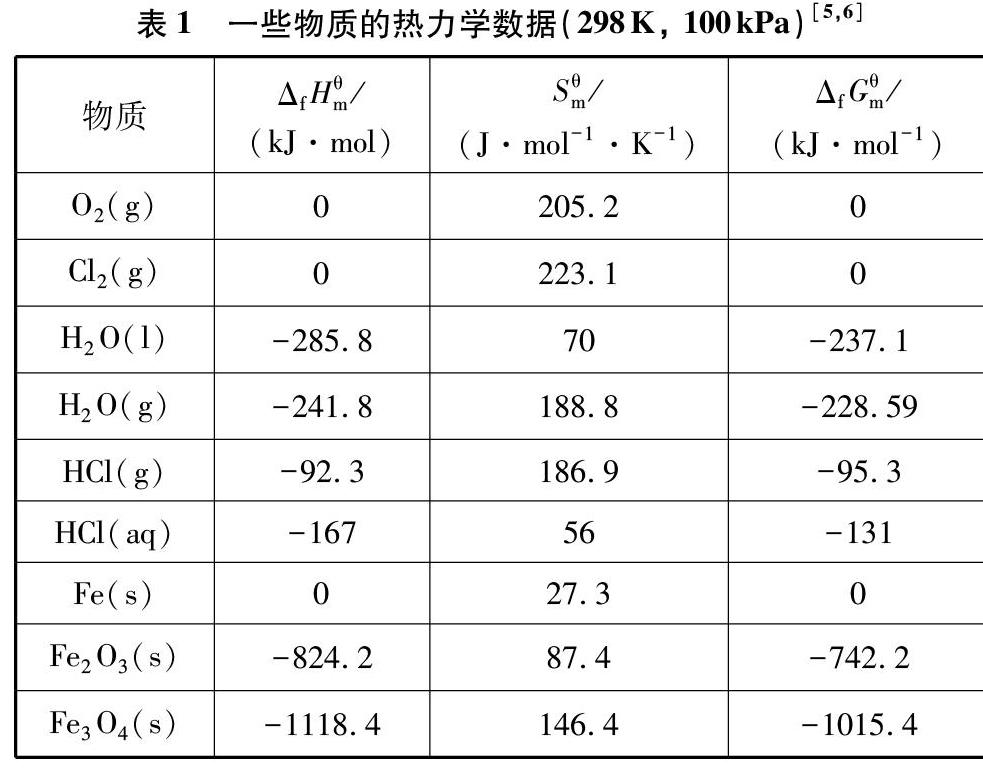
化学反应能否自发进行,可以通过计算该反应的吉布斯自由能變(ΔrG)进行判断(见表1)。若ΔrG<0,反应正向自发进行;若ΔrG=0,反应以可逆方式进行;若ΔrG>0,逆反应自发进行。
标准状态下反应4HCl(aq)+O2(g)2H2O(l)+2Cl2(g)的标准摩尔吉布斯自由能变为:
ΔrGθm=2ΔfGθm(H2O, l)+2ΔfGθm(Cl2, g)-4ΔfGθm(HCl, aq)-ΔfGθm(O2, g)
=[2×(-237.1)+2×0-4×(-131)-0]kJ·mol-1
=49.8kJ·mol-1>0
說明标准状态下,在溶液中该反应①不能进行。但在气相条件中反应4HCl(g)+O2(g)2H2O(g)+2Cl2(g)的标准摩尔吉布斯自由能变为:
ΔrGθm=2ΔfGθm(H2O, g)+2ΔfGθm(Cl2, g)-4ΔfGθm(HCl, g)-ΔfGθm(O2, g)
=[2×(-228.59)+2×0-4×(-95.3)-0]kJ·mol-1
=-75.98kJ·mol-1<0
说明标准状态下,在气相条件下反应①正向自发进行。以上计算结果与电动势计算结果及实验事实相一致。
事实上,根据GibbsHelmholtz方程: ΔG=ΔH-TΔS,且反应的熵变和焓变随温度的变化很小,在实际应用中,可以忽略温度对熵变和焓变的影响,即可以认为ΔrHθm(T)≈ΔrHθm(298K), ΔrSθm(T)≈ΔrSθm(298K)。
对于反应4HCl(aq)+O2(g)2H2O(l)+2Cl2(g),
ΔrHθm(T)=2×(-285.8)+2×0-4×(-167)-0=96.4kJ·mol-1
ΔrSθm(T)=2×70+2×223.1-4×56-205.2=157J·mol-1·K-1
若反应正向自发进行,需满足ΔrGθm(T)=ΔrHθm(T)-TΔrSθm(T)<0,则T>614K,很明显,在标准大气压下水溶液不可能达到该温度。因此,可证明在标准状态下水溶液中氧化性Cl2>O2。
对于反应4HCl(g)+O2(g)2H2O(g)+2Cl2(g),
ΔrHθm(T)=2×(-241.8)+2×0-4×(-92.3)-0=-114.4kJ·mol-1
ΔrSθm(T)=2×188.8+2×223.1-4×186.9-205.2=-129J·mol-1·K-1
若反应正向自发进行,需满足ΔrGθm(T)=ΔrHθm(T)-TΔrSθm(T)<0,则T<887K。也可以通过该反应正向进行说明在该温度下氧化性O2>Cl2。在常温下,O2置换Cl2的反应: SiCl4+O2SiO2+2Cl2是自发的,在这种情况下氧气氧化性比氯气强。
4 通过热力学计算结果分析Fe和氧气的反应产物
铁在氧气中燃烧生成Fe3O4而不是Fe2O3已有相关研究[7,8],大多利用热力学数据计算1800K(Fe燃烧温度)下分别生成Fe3O4和Fe2O3的吉布斯自由能变ΔrGθm(1800K),以及在该温度Fe3O4和Fe2O3相互转化的ΔrGθm(1800K)。通过计算说明在1800K和一个标准大气压下,Fe被氧化为Fe3O4和Fe2O3均自发,而Fe3O4氧化为Fe2O3是不自发的,即其逆反应是自发的。
事实上,也可以根据GibbsHelmholtz方程计算得Fe在空气中被氧化为Fe3O4和Fe2O3以及Fe2O3转化为Fe3O4的温度范围,进而推断Fe在空气中被氧气氧化的稳定的氧化产物。
对于反应4Fe+3O22Fe2O3
ΔrHθm=2ΔfHθm(Fe2O3)-3ΔfHθm(O2)-4ΔfHθm(Fe)
=[2×(-824.2)-3×0-4×0]kJ·mol-1
=-1648.4kJ·mol-1
ΔrSθm=2Sθm(Fe2O3)-3Sθm(O2)-4Sθm(Fe)
=(2×87.4-3×205.2-4×27.3)J·mol-1·K-1
=-550J·mol-1·K-1
温度为T K时反应的ΔrGm计算如下:
ΔrGθm(T)=ΔrHθm-TΔrSθm=[-1648.4-T·(-550×10-3)]kJ·mol-1<0
计算得T<2997K时Fe能自发地被氧化为Fe2O3。
对于反应3Fe+2O2Fe3O4
ΔrHθm=ΔfHθm(Fe3O4)-2ΔfHθm(O2)-3ΔfHθm(Fe)
=(-1118.4-2×0-3×0)kJ·mol-1
=-1118.4kJ·mol-1
ΔrSθm=Sθm(Fe3O4)-2Sθm(O2)-3Sθm(Fe)
=(146.4-2×205.2-3×27.3)J·mol-1·K-1
=-345.9J·mol-1·K-1
ΔrGθm(T)=ΔrHθm-TΔrSθm=[-1118.4-T·(-345.9×10-3)]kJ·mol-1<0
计算得T<3233K时Fe也能自发地被氧化为Fe3O4。通过以上计算可知,当Fe在氧气中燃烧温度为1800K左右,Fe被氧化成Fe3O4和Fe2O3的反应均能自发进行。
对于反应6Fe2O34Fe3O4+O2
ΔrHθm=4ΔfHθm(Fe3O4)+ΔfHθm(O2)-6ΔfHθm(Fe2O3)
=[-1118.4×4+0-6×(-824.2)]kJ·mol-1
=471.6kJ·mol-1
ΔrSθm=4Sθm(Fe3O4)+Sθm(O2)-6Sθm(Fe2O3)
=(4×146.4+205.2-6×87.4)J·mol-1·K-1
=266.4J·mol-1·K-1
ΔrGm=ΔrHθm-TΔrSθm=(471.6-T·266.4×10-3)kJ·mol-1<0
计算得T>1770K時该反应能正向自发进行。说明在温度高于1770K时,Fe2O3自发分解生成Fe3O4。那么Fe在氧气中燃烧的反应温度1800K时生成Fe3O4热力学上更稳定。
通过以上热力学计算结果可说明,Fe在O2中燃烧,可以被O2氧化生成Fe2O3,被氧化生成Fe3O4是因为其热稳定性比Fe2O3好。该燃烧反应大量放热,使Fe2O3部分分解生成更稳定的Fe3O4。因此,不能根据铁在氧气中燃烧生成Fe3O4,铁在氯气中燃烧生成FeCl3,而得出氧化性Cl2>O2。事实上,氧气可在常温下将Fe缓慢氧化为Fe2O3。
综上所述,Cl2和O2氧化性强弱比较非常复杂,涉及多方面因素。从分子结构角度,不仅和原子电负性有关,还和分子内两原子间键能大小有关。原子电负性越大、分子内键能越小稳定性越差氧化性越强。因此,从结构角度难以比较二者氧化性强弱。外部环境对二者氧化性强弱影响很大,如温度、压强、浓度、溶解度和介质,同时还受产物稳定性的影响。
一般在溶液中,标准状态下同浓度时氧化性Cl2>O2,可能和氯气的溶剂化程度大于氧气有关;在气相反应中,氧化性O2>Cl2,这可能是因为氧离子所带电荷数高,半径小,与相同的阳离子结合的晶格能更高;并且氧在形成的分子中可以成双键或离域大π键结构,在中心原子相同配位数的情况下能形成更多的化学键,增强产物分子的稳定性降低能量。因此,在化学教学和学习中,比较Cl2和O2氧化性强弱要说明反应条件及产物,不能简单地根据氧化产物中元素化合价高低来比较氧化剂氧化性强弱,还要结合热力学计算结果进行综合分析。
参考文献:
[1]宋天佑, 徐家宁, 程功臻, 王莉. 无机化学(下册)(第三版)[M]. 北京: 高等教育出版社, 2015: 643.
[2]张祖德. 无机化学(第二版)[M]. 合肥: 中国科学技术出版社, 2017: 375, 392.
[3][5]W.M. Haynes. CRC Handbook of Chemistry and Physics, 93rd ed. Boca Raton: CRC Press Inc [M], 2012-2013: 5~42, 9~97.
[4][6]G. Aylward and T. Findlay. SI Chemical Data (3rd). [M]. New York: Wiley, 1994.
[7]北京师范大学, 华中师范大学, 南京师范大学无机化学教研室. 无机化学(上册)(第四版)[M]. 北京: 高等教育出版社, 2010: 236~238.
[8]鞠东胜, 王金龙. 铁与氧气反应产物的讨论[J]. 化学教育, 2013, (4): 85~86.

