术后长周期替莫唑胺治疗高级别胶质瘤的研究
杜霄,纪环,赵天翼,袁晨阳,周菊英
胶质瘤是中枢神经系统的恶性肿瘤,起源于神经胶质细胞,是最常见的原发性颅内肿瘤,患病率逐年上升,严重影响人类生命健康[1]。根据WHO 2016年中枢神经系统肿瘤分类标准,胶质瘤可分为WHO Ⅰ-Ⅳ级,Ⅰ、Ⅱ级为低级别胶质瘤,Ⅲ、Ⅳ级为高级别胶质瘤;高级别胶质瘤的恶性程度较高,侵袭性强,治疗效果差,患者的生存期短,中位生存期约14.6个月[2]。目前对于胶质瘤的治疗方法主要为手术切除及术后放化疗。然而,由于高级别胶质瘤具有侵袭性强、恶性程度高、手术不能完全切除等高危因素,现国际上多建议在保全器官功能的前提下尽可能完整地将肿瘤切除,术后行放疗同步联合替莫唑胺(temozolomide,TMZ)化疗和放疗1个月后行6周期TMZ辅助化疗的治疗方案[3](即STUPP方案),以期达到更好的治疗效果[4]。TMZ已被证实对胶质瘤的治疗具有良好的安全性和临床效果[5]。但目前对于TMZ辅助化疗使用的周期数的长短尚无统一定论。为此,本研究对苏州大学附属第一医院2014年10月—2019年10月术后使用长周期(≥9周期)及标准周期(6周期)TMZ辅助化疗的高级别胶质瘤患者的临床资料进行回顾性分析,以评价使用长周期TMZ治疗的效果、安全性及对预后的影响。现报告如下。
1 资料与方法
1.1 一般资料 本组100例患者按照中枢神经系统肿瘤的WHO分类标准,经术后病理确诊为高级别(WHO Ⅲ-Ⅳ级)脑胶质瘤,其中术后使用不少于9周期TMZ辅助化疗的36例患者被纳入长周期治疗组(长周期组),术后使用6周期TMZ辅助化疗的64例患者被纳入标准周期治疗组(标准周期组)[6]。入组患者均符合以下标准:(1)经病理组织学确诊为高级别胶质瘤;(2)术后病理分级为 WHO Ⅲ-Ⅳ级,既往无颅内肿瘤治疗史;(3)治疗前血常规、肝、肾功能均正常,无严重心肺并发症,无严重传染病史,无远处器官转移;(4)在标准治疗周期内及治疗完成时未发生失访、进展或死亡。两组患者的临床资料见表1。
1.2 方法
1.2.1 手术 100例患者均行肿瘤切除手术。术前8 h禁食,完善术前相关检查及影像学检查。根据影像检查结果确定病灶位置,选择正确的体位;开颅显微镜下暴露肿瘤组织,分离肿瘤边界后切除肿瘤。术后根据头颅MRI检查评估手术肿瘤切除程度,肿瘤切除程度分为全切除(>95%),次全切除(80%~95%)和部分切除(<80%)。
1.2.2 放疗 患者术后均行放疗,放疗与手术的中位间隔时间为44 d。将患者的CT定位图像导入治疗计划系统,并将颅脑MRI图像与定位CT图像融合后完成图像重建。以患者术前和术后影像学资料为参考,在治疗计划系统的CT图像上进行靶区勾画,包括肿瘤靶区(gross tumor volume,GTV)、临床靶区(clinical target volume,CTV)和危及器官(脊髓、脑干、眼球、晶状体、视神经、视交叉、眼球等)。(1)靶区设计:①肿瘤靶区 (GTV),为术后可见病灶和T2WI/FLAIR异常信号区;②临床靶区(CTV),为 GTV外扩 1.5~2 cm后修正区域;③计划靶区(PTV),为 CTV外放 3~5 mm。(2)剂量及分割:靶区总剂量54~60 Gy,分 27~30次照射,每次分割剂量为1.8~2.0 Gy,每周 5次照射,共 5~6周。
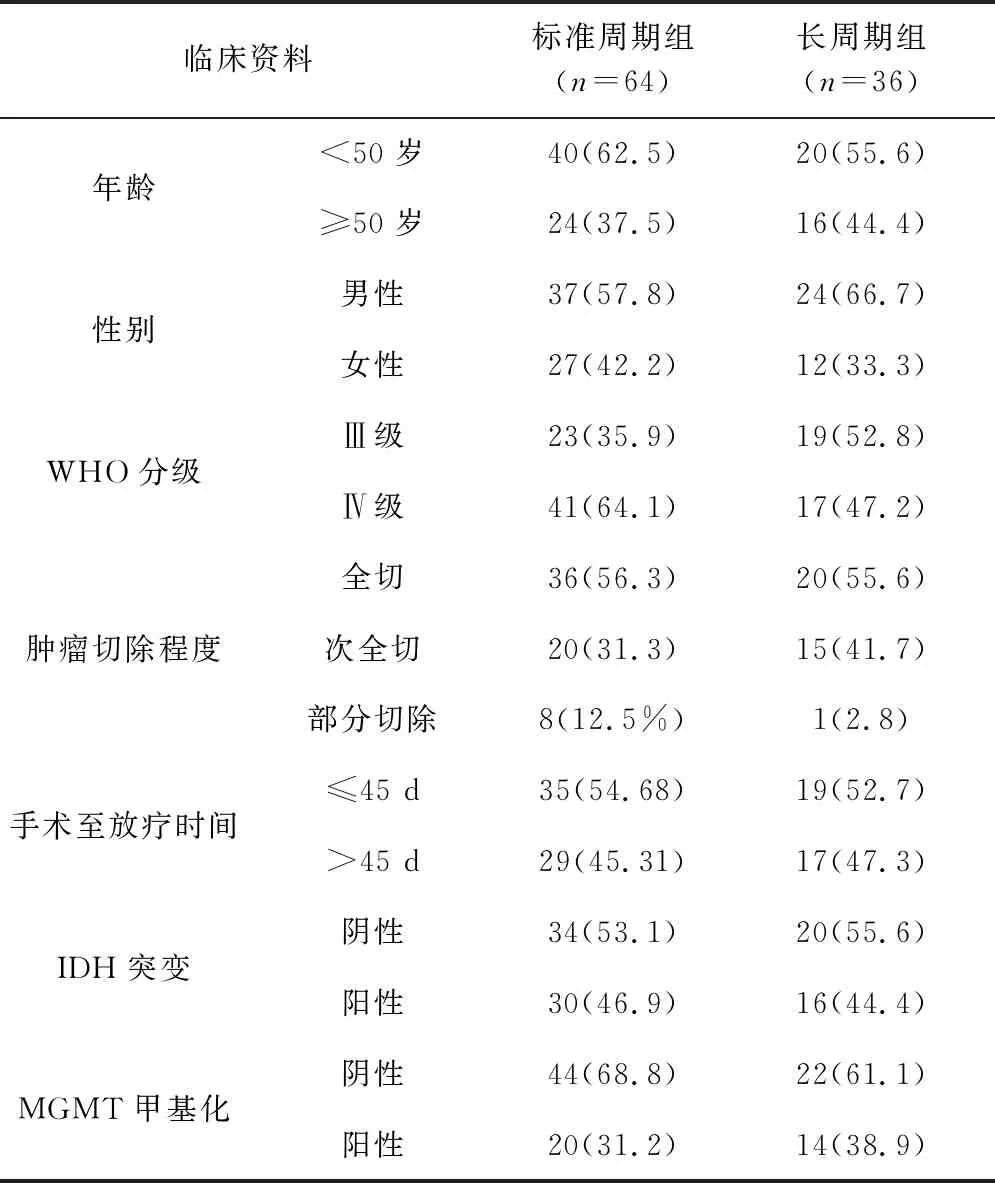
表1 标准周期组与长周期组患者的临床资料(例,%)
1.2.3 化疗 患者均采用放疗同步TMZ化疗后加用TMZ辅助化疗的治疗方案。患者放疗同时口服TMZ(75 mg/m2·d),放疗后4周予TMZ辅助化疗,方案为TMZ(150~200 mg/m2·d)连续服用5 d,28 d为一个周期。第1疗程为150 mg/m2·d,第2疗程及以后为200 mg/m2·d。标准周期治疗组患者服用6个周期TMZ。长周期治疗组患者服用9~31个周期TMZ,中位服用周期为12个周期;其中22例患者服用9~12个周期,4例患者服用13~15个周期,10例患者服用15个周期以上。
1.2.4 随访与预后评价 采用电话和门诊复诊的方式对患者进行随访。随访内容包括患者术后的治疗方案、存活状态及不良反应的发生情况等。随访终点事件是患者因肿瘤死亡或肿瘤复发。总生存期(overall survival,OS)是指手术至最后一次随访的时间间隔或至死亡的间隔时间;无进展生存期(progression free survival,PFS)为患者手术之日至患者首次影像学证实出现颅内病灶进展或肿瘤复发的间隔时间。
1.3 统计学方法 应用SPSS22.0软件对数据进行统计学分析。通过单因素和多因素COX回归方法分析患者生存预后的影响因素。采用Kaplan Meier生存曲线分析比较两组患者之间的生存期差异。P<0.05为差异具有统计学意义。
2 结 果
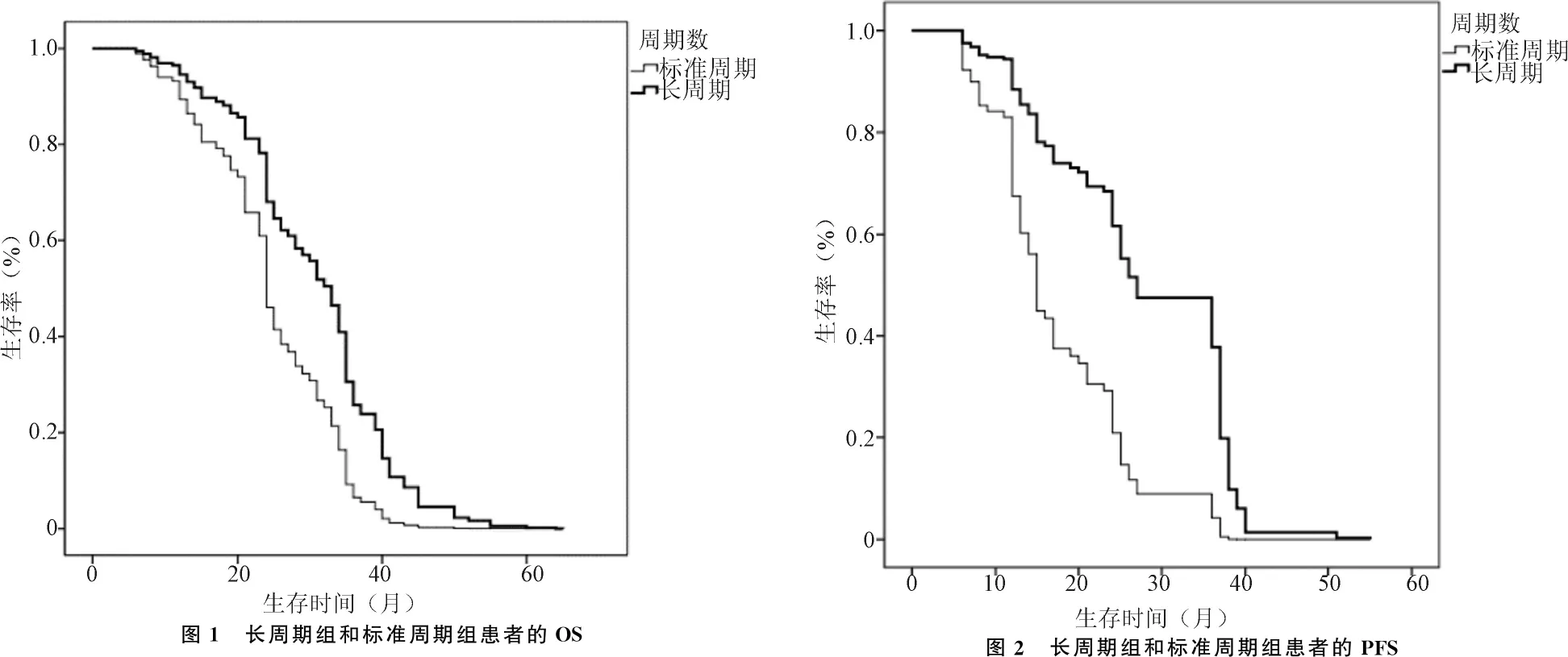
2.1 标准周期组与长周期组患者的生存时间比较 本组100例患者无1例患者术后失访,随访率100%;患者的总生存率为69%。标准周期组患者的PFS为6~51个月,中位PFS为17个月;OS为6~55个月,中位OS为25个月。长周期组患者的PFS为10~55个月,中位PFS为29个月;OS为9~65个月,中位OS为38个月。长周期组患者的PFS和 OS明显比标准周期组患者延长(均P<0.05);见图1、2。标准周期组患者的1年PFS和2年PFS分别为79.7%和33.8%,1年OS、2年OS和5年OS分别为89.1%、60.9%和4.7%。长周期组患者的1年PFS和 2年PFS分别为100%和58.3%,1年OS、2年OS和5年OS分别为95%、69.4%和11.1%。
2.2 脑胶质瘤患者生存预后的影响因素 单因素Cox回归分析结果显示,年龄、IDH突变状态对患者OS及PFS的影响有统计学意义(均P<0.05)。多因素分析结果显示,年龄、IDH突变状态、TMZ辅助化疗周期数及肿瘤切除程度对患者的OS及PFS的影响有统计学意义(均P<0.05)。见表2、表3。
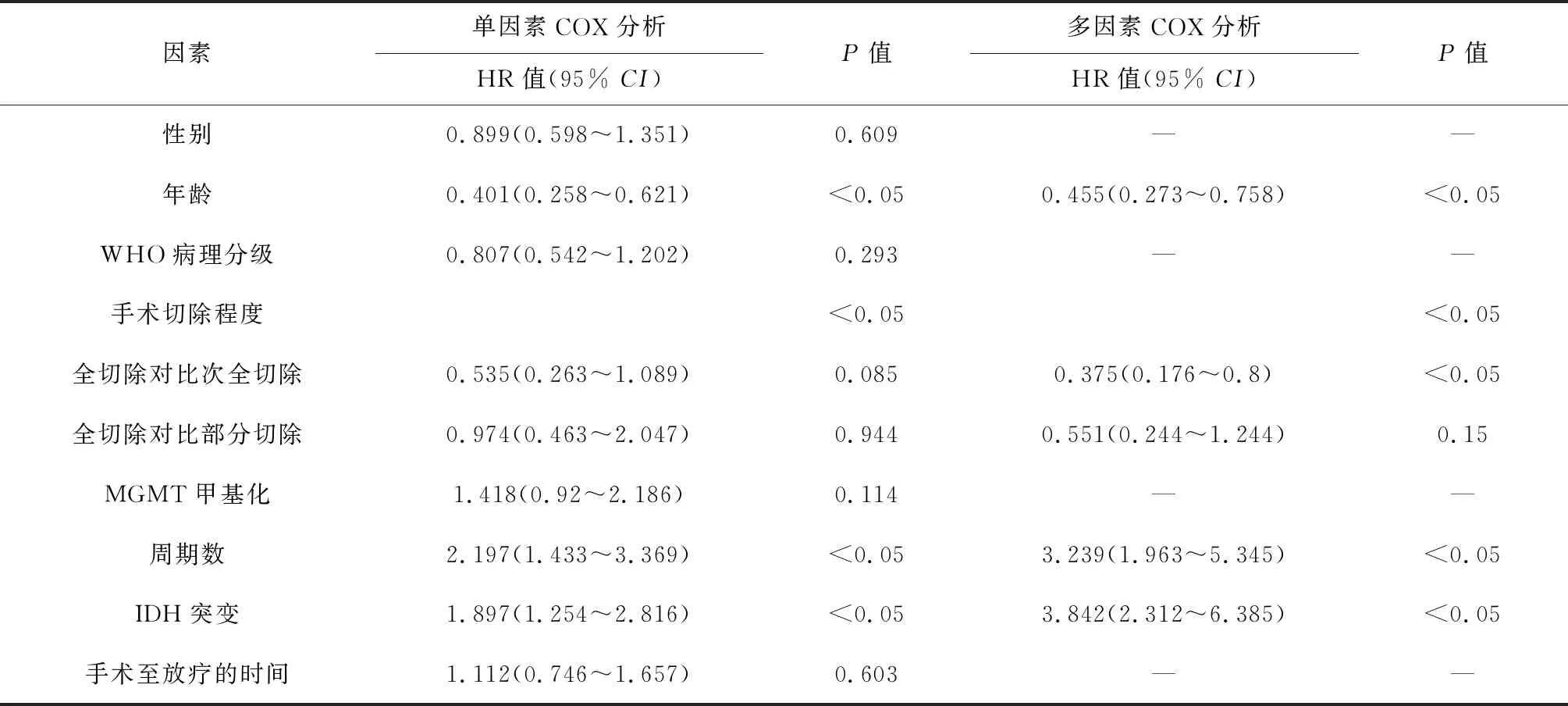
表2 PFS的影响因素分析(n=100)
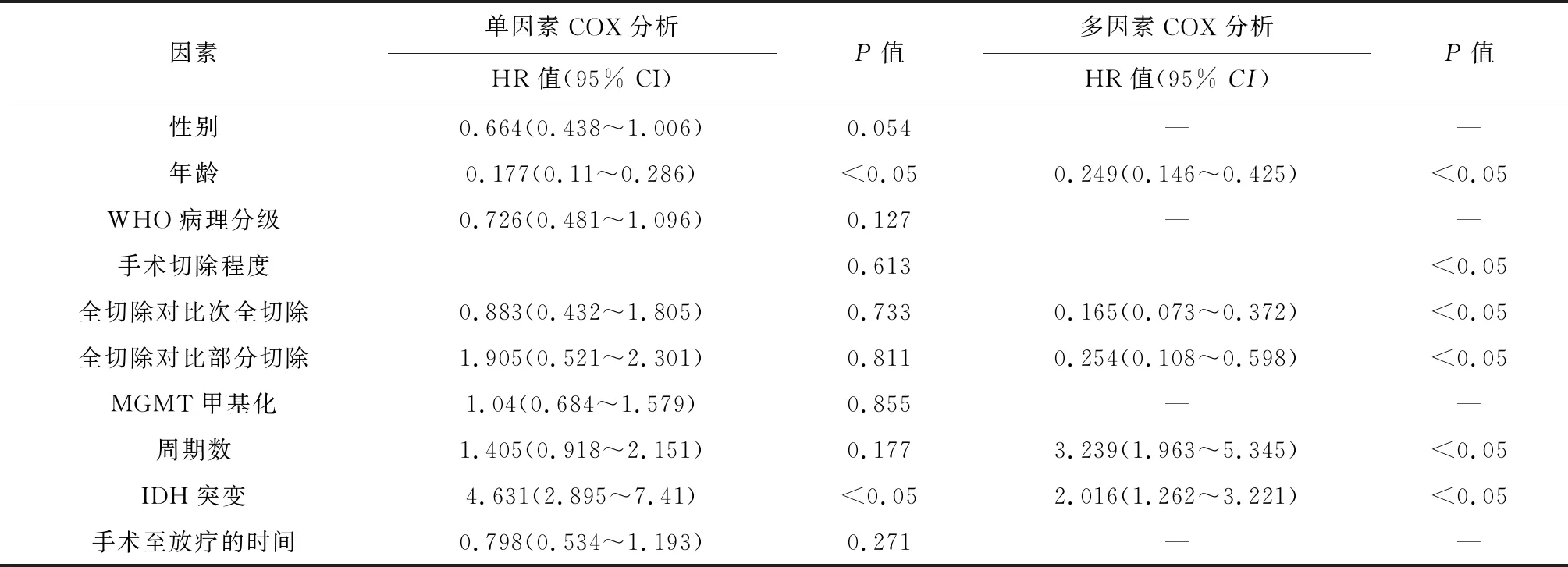
表3 OS的影响因素分析(n=100)
2.3 化疗的不良反应 本组100例患者在服用TMZ过程中,没有出现与TMZ服用相关的死亡病例;无Ⅳ度不良反应发生。同步化疗期与辅助化疗期不良反应的发生率无明显差异(P>0.05)。标准周期组患者最常见的轻至中度不良反应是疲乏、血小板减少、中性粒细胞减少,发生于服用TMZ期间,予对症治疗后好转;同步化疗期间与辅助化疗期间,不良反应发生率无明显差异(P>0.05)。长周期治疗组最常见的不良反应是疲乏、中性粒细胞减少症及血小板减少症 ,同步化疗期间及辅助化疗期间,不良反应发生率无明显差异(均P>0.05)。疲乏的发生率最高,但没有明显影响患者的日常活动。无患者因为不良反应推迟化疗或改变化疗药物剂量。见表4-6。
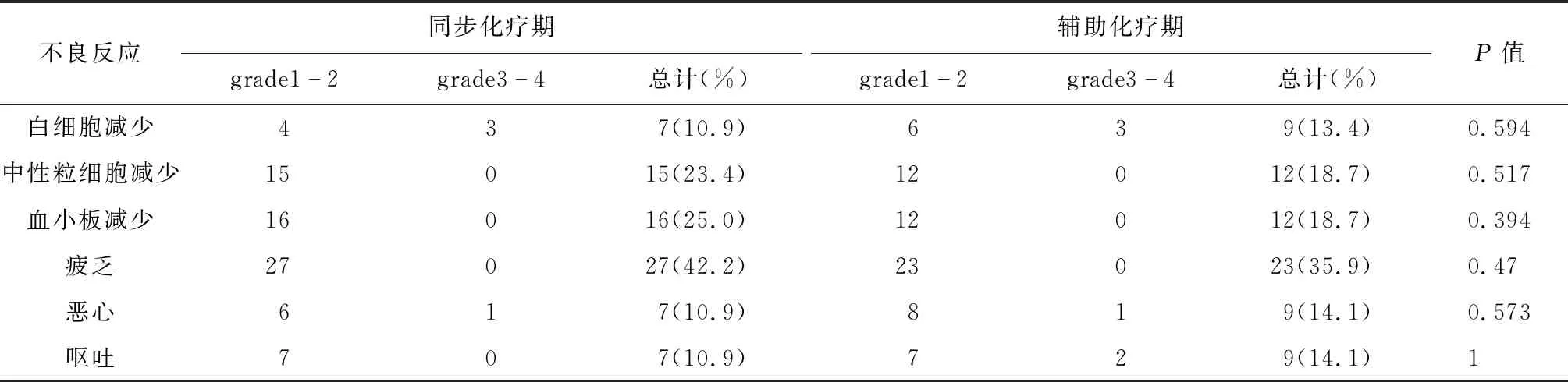
表4 标准周期组患者的化疗不良反应(例)

表5 长周期组患者的化疗不良反应(例)

表6 标准周期组与长周期组不良反应发生率比较(例)
3 讨 论
胶质瘤是最常见的起源于胶质细胞的原发中枢神经系统肿瘤,占原发颅内肿瘤的80%。高级别胶质瘤的高度恶性、极易复发转移的临床特点使得对其的探索一直在进行。继stupp方案治疗之后,对高级别胶质瘤的治疗的探索并未停止。2019年美国国立综合癌症网络(national comprehensive cancer network,NCCN)指南对非小细胞肺癌维持治疗的修订提示维持治疗具有安全性、有效性及可行性,这引发了关于胶质瘤维持治疗的探索。TMZ是目前一线脑胶质瘤的化疗用药,药物作用于细胞DNA,使细胞DNA发生烷基化损伤,形成交联干扰错配修复系统致使细胞死亡,达到抑制肿瘤进展的作用[7-8]。该药物较易透过血-脑屏障,相关数据表明脑脊液中的药物浓度约是血浆中药物浓度的30%;近10年的研究数据提示TMZ对于治疗胶质瘤具有很好的有效性[9-10]。TMZ口服后半衰期为2 h,重复用药无蓄积效应;这表明使用TMZ作为高级别胶质瘤的维持治疗用药具有足够的安全性。
本研究对采用stupp方案同步放化疗并服用TMZ辅助化疗的高级别脑胶质瘤患者,影像学评估未见明显肿瘤进展征象,且没有明显的不良反应,临床评估治疗可耐受[11],可继续周期性服用TMZ治疗。标准周期组及长周期组患者的OS及PFS比较显示,长周期组患者的OS及PFS均较标准周期组患者明显延长,差异有统计学意义(均P<0.05);且增加TMZ的口服周期数,并没有明显增加不良反应的发生率。谢富川等[12]的研究显示,多周期治疗组及标准周期治疗组的中位 PFS分别为12.4(8~47)个月和 8.3(6~41)个月,差异有统计学意义(P=0.03);多周期治疗组及标准周期治疗组的中位 OS分别为 18.6(10~60)个月和 16.2(9~50)个月,差异无统计学意义(P=0.07)。Gloria等[13]研究显示,长周期治疗组及标准周期治疗组的中位OS分别为24.6个月和16.5个月,差异有统计学意义(P<0.05)。因本研究患者的纳入标准较为严格,入组患者需满足治疗前血常规、肝、肾功能均正常,无严重心肺并发症,无严重传染病史,无远处器官转移且在标准治疗周期内及治疗完成时未发生失访、进展或死亡;故本研究患者的中位PFS及OS均较长。
本研究分析结果显示,年龄为患者不良预后的影响因素,长周期口服TMZ、肿瘤全切除及IDH突变状态为独立的良好预后影响因素。年龄对预后的影响可能为高龄患者身体状况差及肿瘤恶性程度高等导致患者的治疗效果不佳。脑胶质瘤的手术原则为最大程度的切除肿瘤,胶质瘤的预后与手术的切除程度有关;这与手术后改善临床症状,减少瘤体,降低肿瘤负荷具有明确相关性[14]。但由于高级别胶质瘤的病理特点,实际难以完全切除肿瘤,故术后放化疗具有明确的治疗价值[15]。近年来,分子病理学的发展对肿瘤的精准治疗带来了极大的获益,2016年WHO发布的中枢神经系统肿瘤的分类标准,在肿瘤组织学分型上加入了分子分型的概念,将组织学表型与以基因特征为代表的分子分型进行了整合,为肿瘤的精准治疗带来更多客观判断的标准[16,17]。本研究结果显示IDH突变型胶质瘤患者具有良好的预后,这证实了分子病理学对胶质瘤的诊断及预后评估价值[18-20]。相关研究显示IDH突变型的患者往往具有更高的肿瘤切除率,这可能与IDH突变型胶质瘤的肿瘤生长部位与侵袭力较弱有关。由此可见,胶质瘤的分子病理学分型一定程度影响手术切除的效果;但两者之间的关系仍需进一步研究,以期达到以分子病理学分型为参考指导手术切除的目的。
综上所述,年龄是胶质瘤患者的不良预后影响因素,长周期口服TMZ、肿瘤全切除及IDH突变状态为独立的良好预后影响因素;长周期口服TMZ可以在不明显增加不良反应的前提下对患者生存改善有一定的效果,故推荐胶质瘤患者术后长周期使用TMZ。

