酒花中异α酸对短乳杆菌49胞外pH、胞内ATP及细胞膜脂肪酸组成的影响
刘储睿,任文静,孙 珍
(大连工业大学生物工程学院 辽宁大连116034)
酒花是啤酒酿造过程中的不可或缺的原料,一方面赋予啤酒特殊的苦味和独特的口感,另一方面还是天然的抑菌剂,可以抑制啤酒发生腐败[1]。酒花物质通过质子载体功能使跨膜质子梯度和质子驱动力减小,由此而引起的营养运输动力不足使酒花敏感菌死亡[2]。酒花抗性菌株中短乳杆菌是代表菌株,同时也是啤酒发酵工业中对啤酒质量的影响较为严重的啤酒腐败菌之一[3]。酒花抗性菌可以通过细胞膜上质子转运H+-ATPase 酶来维持跨膜pH 梯度,保证营养运输动力[4],以及通过Sami等[5]发现的与酒花抗性相关的膜上转运蛋白HorA 和HorC 排出进入胞内的苦味酸,降低苦味酸的渗入速度以维持菌体的正常生长[6]。此外,啤酒中的柠檬酸、丙酮酸、苹果酸和精氨酸等可以被酒花抗性菌所利用,为转运蛋白以及H+-ATPase酶产生大量能量[7]。还有研究表明,在酒花抗性菌株中,基因hitA 编码蛋白将二价阳离子排出,从而限制酒花苦味酸与质子的交换,减少酒花对细胞的危害[8]。
细胞膜在维持细胞结构功能的完整性以及细胞的能量传导等方面有着重要的作用,而调节细胞膜脂肪酸的分布是细胞抵御胁迫的一种重要的应激反应,这种应激反应在各种环境胁迫中被发现。植物乳杆菌在高温和低pH 值条件下会改变处理细胞的脂肪酸分布,特别是不饱和与饱和脂肪酸的比例[9]。乙醇环境会使细胞不饱和/饱和比降低,脂肪酸C12:0的比例增加,C18:1的比例减少[10]。在冷胁迫下,植物通过增加不饱和脂肪酸的比例来保护机体[11]。在100%甲苯中,菌株E13T 通过饱和直链脂肪酸的增加,促使细胞膜变硬,以抵御甲苯毒性[12]。而对于酒花胁迫对细胞膜脂肪酸的影响鲜有报道。
本文以实验室从腐败啤酒中分离得到的酒花抗性菌株短乳杆菌49(Lactobacillus brevis 49)为出发菌株,通过改变酒花质量浓度,确定短乳杆菌49 在应对酒花胁迫环境时胞外pH、胞内ATP 以及细胞膜组成的变化,最终阐明短乳杆菌对酒花胁迫环境胁迫的适应性及其调控机理,进而为啤酒污染菌的抗酒花胁迫机制以及对啤酒腐败菌的控制提供理论依据。
1 材料与方法
1.1 微生物与试剂
菌种:短乳杆菌49(Lactobacillus brevis 49,缩写为L.brevis)从腐败啤酒中分离得到,与短乳杆菌ATCC 14869 和ATCC 367 具有99%的同源性,目前保存在大连工业大学微生物资源与生物催化实验室。
皂化试剂:氢氧化钠(优级)22.5 g,甲醇(色谱纯)75 mL,去离子水75 mL;甲基化试剂:盐酸(6 mol/L)32.5 mL,甲醇(色谱纯)27.5 mL;萃取试剂:正己烷(色谱纯)100 mL,甲基叔丁基醚(色谱纯)100 mL;洗涤试剂:氢氧化钠(优级)3.6 g,去离子水75 mL;饱和氯化钠溶液:氯化钠(优级)20 g,去离子水50 mL。
1.2 试验用培养基
1.2.1 种子培养基 MRS 培养基:酵母浸膏0.4%、D-麦芽糖0.5%、蛋白胨1%、牛肉膏0.8%、无水葡萄糖2%、无水乙酸钠0.5%、吐温-80 0.1%、磷酸氢二钾0.2%、柠檬酸三铵0.2%、硫酸镁0.02%、硫酸锰0.005%、水、pH 6.8,于121 ℃条件下灭菌20 min。
1.2.2 不同酒花胁迫条件培养基 在MRS 培养基中分别加入0,10,20,30,60 mg/L 的酒花浸膏(大连华润雪花啤酒有限公司赠送啤酒花产品,该产品由啤酒花的二氧化碳提取物制成,含有9%的异α 酸),于121 ℃条件下灭菌20 min。
1.3 仪器与设备
722s 可见分光光度计,上海精密科学仪器有限公司;pH 计PHS-3C,上海仪电科学仪器股份有限公司;高速离心机5408-R,德国Eppendorf 公司;高效液相色谱仪1260、气相色谱仪6850A,美国安捷伦公司。
1.4 试验方法
1.4.1 短乳杆菌49 生长曲线以及发酵液pH 值的测定 将短乳杆菌49 接种于0,10,20,30,60 mg/L MRS 培养基中,30 ℃恒温静止培养,从第1天至第7 天每天取一定量混匀发酵液,用紫外分光光度计测定OD600值,以获取短乳杆菌49 的生长曲线图。测定发酵液pH 值。
1.4.2 短乳杆菌49 胞内ATP 的测定 短乳杆菌49 于不同酒花质量浓度下,在稳定期(第7 天)取一定量混匀的发酵液,按照Beyotime(中国)公司购买的ATP 检测试剂盒使用方法进行细胞获取、裂解,并将裂解液吸取20 μL 于96 孔板进行ATP检测。
1.4.3 短乳杆菌49 细胞膜脂肪酸的提取 将短乳杆菌49 接种于0,10,20,30,60 mg/L MRS 培养基中,30 ℃恒温静止培养,在稳定期(第7 天)取一定量混匀的发酵液,4 ℃条件下8 000 r/min 离心10 min,去离子水洗涤2 遍,收集菌体,然后测定其膜脂肪酸组成。
1.4.4 细胞膜脂肪酸组成检测 参照美国MIDI公司的微生物脂肪酸甲酯气相色谱鉴定方法[13]进行细胞脂肪酸甲酯衍生化和气相色谱检测。碳链长度按公式(1)计算。

式中,FAP——脂肪酸组成百分数;C——脂肪酸碳原子数。
膜脂肪酸的流动指数(U/S)是以不饱和脂肪酸与饱和脂肪酸的比值来计算。
1.5 数据处理
采用SPSS 17.0(美国IBM 公司)软件进行单因素方差分析和均值间显著性差异检验(P<0.05),做Pearson 相关分析,分析均值间的相关性。
2 结果与分析
2.1 酒花对短乳杆菌49 细胞生长的影响

图1 酒花对短乳杆菌49 细胞生长的影响Fig.1 Effect of hops on the growth of Lactobacillus brevis 49
在酒花的化学成分中,酒花苦味酸是啤酒花抑制微生物生长的重要物质[14]。未解离的酒花苦味物质(Hop-H)进入细胞解离成H+和阴离子(Hop-),驱散跨膜pH 梯度,影响营养物质通过质子泵进入细胞[7]。短乳杆菌49 接种于5 个酒花梯度培养基(0,10,20,30,60 mg/L)中,使用紫外分光光度计测得第1 天至第7 天的OD600值,得到其生长曲线。从图1可看出含酒花的培养基对短乳杆菌49 有抑制作用,且酒花质量浓度越高抑制作用越显著,细胞生长的对数期也随酒花质量浓度的升高而变长。这是因为酒花苦味酸物质渗入短乳杆菌49 细胞中,短乳杆菌49 需要消耗更多的能量提供给转运蛋白HorA 与HorC 多药抗性转运蛋白,或是质子转运H+-ATPase 酶维持跨膜pH梯度以抵抗酒花苦味酸[15],从而造成其细胞生长缓慢。啤酒中的啤酒花苦味酸浓度一般在17~55 mg/L 左右。选取60 mg/L 的酒花质量浓度,培养5 d,其培养液OD600可达0.78,当酒花质量浓度超过60 mg/L 时,未检出活菌落,OD600为0。
2.2 酒花对短乳杆菌49 胞外pH 及胞内ATP 的影响
为了探究酒花对短乳杆菌49 胞内外的影响,对短乳杆菌49 稳定期胞内ATP 和胞外pH 值进行检测。从图2可看出发酵初期(第0 天)酒花质量浓度越高,pH 值越低,60 mg/L 培养基的pH 6.5,0 mg/L 的培养基pH 6.8,这是由于酒花物质为弱酸性。随着发酵时间的延长,pH 值呈下降趋势,这并不是单个因素造成的。由于短乳杆菌49在生长过程中不断产酸,若是苹果酸、乳酸、琥珀酸等会造成pH 值下降[15]。此外,酒花进入细胞内解离成H+和Hop-,HorA、HorC 和膜上质子转运H+-ATPase 酶,能将胞内积累的酒花苦味酸及质子由胞内排出细胞外,造成pH 值的下降。图3中受酒花胁迫的短乳杆菌49 胞内ATP 含量比不受酒花胁迫的低1 个数量级,尤其是0 mg/L 与10 mg/L 的OD600相差不多,而前者ATP 含量为743 nmol/L,后者为172.7 nmol/L。这是由于HorA、HorC 和膜上质子转运H+-ATPase 酶的酒花抗性作用需大量的ATP 供能,造成胞内ATP 之间的显著差异。而随着酒花质量浓度的增大,影响菌的生长,ATP 测试取样量较少,可能存在ATP 测量的误差。图2中,酒花质量浓度越高发酵期间(除零点外)pH 值越高,这是由于酒花质量浓度的增大导致酒花胁迫强度也增大,对短乳杆菌49 的抑制作用越强,存活率下降,造成菌数目的差异。较少的菌产生的有机酸少,同时膜上酒花相关转运蛋白及膜上质子转运H+-ATPase 酶泵出H+的能力被减弱,最终导致高浓度的酒花pH 值也高。

图2 酒花对短乳杆菌49 胞外pH 的影响Fig.2 Effect of hops on extracellular pH of Lactobacillus brevis 49
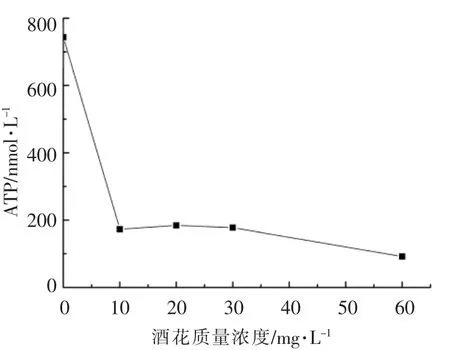
图3 酒花对短乳杆菌49 胞内ATP 的影响Fig.3 Effect of hops on the amount of intracellular ATP of Lactobacillus brevis 49
2.3 酒花对短乳杆菌49 细胞膜脂肪酸链长的影响
为探讨不同酒花质量浓度对短乳杆菌49 细胞膜组成的影响,测定第7 天不同酒花质量浓度下所获菌体的膜脂肪酸组分的相对含量(表1)以及酒花对平均链长、中长链、脂肪酸奇偶性所占比例的影响(表2)。从表1可看出短乳杆菌49 的主要的脂肪酸组成为C16和C18,占到总脂肪酸组成的50%左右,且棕榈酸C16:0与硬脂酸C18:0占绝对优势。随着酒花质量浓度的升高,C18与C20所占比例增加,尤其是C20有显著的增长趋势,在没有酒花抗性的培养基中接近于0%的C20在60 mg/L 酒花质量浓度中达到23.59%。C19相较于对照组脂肪酸比例有显著的提升,且短乳杆菌49 的C19脂肪酸中环状脂肪酸比例占总C19脂肪酸的90%以上,因此主要是环状脂肪酸C19在酒花胁迫环境中有明显的提升。Munoz-Rojas 等[16]从分子生物学水平上证实菌体细胞膜中环丙烷型脂肪酸,在增强菌体冷冻干燥耐受性方面所发挥的重要作用。推测短乳杆菌49 环状脂肪酸的增加在一定程度上对于酒花质量浓度的耐受性有着不可或缺的意义。此外,由表2可看出随着酒花质量浓度的升高,平均链长呈上升趋势,长链脂肪酸相较于0 mg/L的培养条件有较为显著的变化。推测短乳杆菌49通过增加碳链长度使其更容易横跨膜双分子层,脂肪酸链排布更加紧密,有利于它的脂类和蛋白通过疏水作用结合,膜环境形成“凝胶状”,膜的稳定性也随之增强,达到抵抗酒花渗入其内部环境的作用。Mykytczuk 等[17]、Fozo 等[18]也发现相似的结论,脂肪酸碳链长度的改变可以抵抗外界环境的胁迫。同时从表2中发现一个有趣的现象,短乳杆菌49 中脂肪酸更偏向于偶数脂肪酸,所占比例在80%左右,并随着酒花质量浓度的升高,偶数脂肪酸所占比例也有所改变。
2.4 酒花对短乳杆菌49 细胞膜脂肪酸饱和度、链分支的影响
细胞膜脂肪酸的组成对于维持细胞正常生长、代谢及内环境的稳定有着不可或缺的作用。为了进一步探索酒花对短乳杆菌49 细胞膜组成的影响,对其细胞膜脂肪酸的饱和度、链分支进行研究(表3)。从表3可看出饱和脂肪酸是短乳杆菌49 的主要成分,占84%。随着酒花质量浓度的升高,饱和脂肪酸所占比例下降,不饱和脂肪酸所占比例升高,结合表1发现主要是C20与C18这2 种饱和脂肪酸增长幅度较大。已有研究[19]表明,膜脂不饱和度的增加有利于维持细胞结构的稳定性,且不饱和度决定了细胞膜的厚度和黏度,进而提高对环境胁迫的适应性。Jin 等[20]、田丰伟等[21]在干酪乳杆菌与植物乳杆菌中均发现酸胁迫会引起细胞膜脂肪酸不饱和度增加;方彦等[22]发现膜脂中不饱和脂肪酸含量的增加,能降低膜脂的相变温度,使膜脂在低温下保持稳定。短乳杆菌49 通过调节不饱和脂肪酸的比例来保持细胞膜的正常生理功能,对提高酒花胁迫具有重要意义。细胞膜中的直链脂肪酸与支链脂肪酸与细胞膜的硬度有关[23]。从表3中发现随着酒花质量浓度的升高,直链脂肪酸增加,由于直链脂肪酸的溶解度较支链脂肪酸高,因此短乳杆菌49 没有通过增加直链脂肪酸增强细胞膜的坚硬度来对应酒花胁迫。而支链脂肪酸比例的增加可以抵抗冷胁迫环境[24],推测短乳杆菌49 可以通过形成支链来适应酒花环境胁迫。饱和直链随着酒花含量的增加逐渐降低,膜不饱和脂肪酸直链含量逐渐增加。Fozo 等[25]发现不饱和脂肪酸的形成对于保持胞内外的pH 梯度具有重要作用,而酒花苦味酸正是通过破坏影响质子移动势(Proton motive force,PMF)的pH 梯度,造成细胞无法正常进行营养转运及代谢,使微生物的生长被抑制。短乳杆菌49 通过膜不饱和脂肪酸的增加来维持其胞内外质子移动势,使其在高浓度酒花中生长。

表1 不同酒花质量浓度下短乳杆菌49 细胞膜脂肪酸组分Table 1 The composition of fatty acids of Lactobacillus brevis 49 cell membrane with different mass concentration of hops

表2 不同酒花质量浓度下短乳杆菌49 细胞膜脂肪酸平均链长、中长链、脂肪酸奇偶性所占比例Table 2 The proportion of average chain length,medium and long chain,and fatty acid parity of Lactobacillus brevis 49 cell membrane with different mass concentration of hops

表3 不同酒花质量浓度下短乳杆菌49 细胞膜脂肪酸饱和度及链分支所占比例Table 3 The distribution of desaturation and branched fatty acids of Lactobacillus brevis 49 cell membrane with different concentration of hops
2.5 酒花对短乳杆菌49 细胞膜脂肪酸流动指数(U/S)的影响
前人的研究结果表明,脂肪酸的流动指数(U/S)可以作为环境胁迫的指标[26]。由图4可看出0 mg/L 时,U/S 的数值为0.19,质量浓度为60 mg/L时,U/S 达到0.27,其细胞膜的不饱和脂肪酸与饱和脂肪酸的比值(U/S)较出发菌株提高42.11%。U/S 值越大细胞膜流动性越强,说明短乳杆菌49在酒花胁迫下,细胞膜流动性随其浓度升高而变强。Béal 等[27]提出增加菌体细胞膜U/S 比例,有利于乳酸菌适应冷胁迫。细胞膜的物化特性随着外界环境的变化而发生改变,短乳杆菌49 细胞膜流动性的增强诱导膜上胁迫蛋白,如现在广泛被认可具有抗酒花特性的HorA、HorB 和HorC 蛋白大量表达,增加了细胞膜中蛋白与磷脂的比例,从而降低酒花苦味酸进入细胞质膜的流速,稳定菌体自身的正常生理代谢。
3 结论

图4 酒花对短乳杆菌49 流动指数(U/S)Fig.4 Effect of hops on the U/S of Lactobacillus brevis 49 cells
短乳杆菌49 在含有酒花的MRS 培养基中可以生长,当酒花质量浓度高于60 mg/L 时被抑制生长。短乳杆菌49 胞外pH 值呈下降趋势,这与其产酸以及酒花转运蛋白和H-ATPase 酶将苦味酸及质子泵出胞外有关。高浓度的酒花会导致pH值升高。酒花对胞内ATP 的影响较大,酒花胁迫下的短乳杆菌49 胞内ATP 相较于无酒花胁迫低1 个数量级。胞内ATP 的大量消耗使细胞膜上相关蛋白及酶更好地维持胞内外pH 梯度。对细胞膜脂肪酸的检测表明:随着酒花质量浓度的升高,短乳杆菌49 中链脂肪酸减少,长链脂肪酸比例升高且平均链长也有提升。其中C19尤其是C19环状脂肪酸与C20脂肪酸的增长最为明显。对细胞膜脂肪酸饱和度、链分支和流动性的研究结果表明,酒花胁迫导致细胞膜不饱和脂肪酸与支链脂肪酸的增加,细胞膜流动性(U/S)有所上升。

