实时三维超声心动图评估高剂量蒽环类药物化疗后左心室形态及收缩同步性的临床研究:5年回顾性随访
陈佳慧,张楚婕,沈毅辉,张群岭,程蕾蕾*
1.复旦大学附属中山医院心内科,上海 200032 2.复旦大学附属中山医院心脏超声诊断科,上海 200032 3.上海市心血管病研究所,上海 200032 4.上海市影像医学研究所,上海 200032 5.复旦大学附属肿瘤医院肿瘤内科,上海 200032
蒽环类药物心脏毒性导致的症状多样,出现时间也各不相同,因此监测化疗结束后的迟发药物不良反应很有挑战性[1]。经胸超声心动图检查被广泛用于评估蒽环类药物的潜在不良反应[2-3],但二维(2D)超声心动图和斑点追踪(speckle-tracking imaging, STI)对心脏功能的细微变化反映不够全面。
实时三维超声心动图(real-time three-dimensional echocardiography, RT-3DE)重建图像提供的信息优于2D法,无需事先将左室假设为某种规则几何体,便可直接精确测量左室容积、心输出量及射血分数,提高了超声诊断的准确性与可靠性。当2D超声心动图指标及STI指标不够灵敏时,可使用三维(3D)应变指标监测心脏形态及收缩同步性的变化。本研究旨在采用RT-3DE测定高、低剂量蒽环类药物治疗对长期生存的淋巴瘤患者心脏收缩功能和收缩不同步的影响。
1 资料与方法
1.1 一般资料 选择2009年3月31日至2013年10月23日在复旦大学附属肿瘤医院肿瘤内科接受以蒽环类药物为主的化疗方案治疗的弥漫大B细胞淋巴瘤(diffuse large B-cell non-Hodgkin lymphoma,DLBCL)患者20例。自完整化疗周期结束起至2019年11月25日,20例DLBCL患者纳入研究,设为病例组,其中55%为男性,平均年龄(57±14)岁,平均化疗年限为(4.8±1.0)年(4~7年),随访期间未出现严重的、与心脏相关的临床症状。随机选择2018年2月在复旦大学附属中山医院进行年度体检的36名健康者为对照组,其均无心脏疾病、颈动脉超声检查异常、24 h 动态心电图异常、超声心动图异常;55%为男性,平均年龄(52±15)岁,年龄和性别与病例组匹配。
纳入标准:(1)年龄>18岁;(2)诊断为DLBCL;(3)完成R-CHOP方案化疗;(4)进行超声心动图检查时,淋巴瘤处于缓解期。排除标准:(1)化疗前存在严重心血管疾病病史;(2)治疗DLBCL前接受过蒽环类药物治疗;(3)接受过心脏区域放疗;(4)合并其他部位的恶性肿瘤。本研究经复旦大学附属肿瘤医院伦理委员会(1212117-6)和复旦大学附属中山医院伦理委员会批准(2011-117);所有患者均知情并签署知情同意书。
1.2 蒽环类药物为基础的化疗方案 以蒽环类药物为基础、多种化疗药物联合的R-CHOP方案是治疗DLBCL的一线治疗方案。病例组患者均接受过6或8周期的R-CHOP化疗:环磷酰胺 750 mg/m2,长春新碱 1.4 mg/m2(最大剂量为2 mg/m2),表柔比星 50~70 mg/m2,泼尼松 100 mg/m2(第1~5天),利妥昔单抗375 mg/m2。根据欧洲心脏病学会(European Society of Cardiology, ESC)指南[3],以蒽环类药物>360 mg/m2为高剂量、蒽环类药物≤360 mg/m2为低剂量,将病例组分为高剂量组(n=15)和低剂量组(n=5)。
1.3 超声心动图检查 对所有研究对象进行2D和3D超声心动图检查。采用配备S5-1(1~5 MHz)探头的IE33超声诊断仪(Philips Medical Systems, Andover WA, 美国)采集2D心超图像;使用X3-1(1~3 MHz)矩阵阵列传感器采集3D超声心动图图像。标准2D和3D超声心动图图像采集过程严格按照美国超声心动图学会(American Society of Echocardiography, ASE)指南[4]进行。图像采集及分析者对所有研究对象的用药方案及临床资料保持双盲。每个受试者至少获取3个数据集并离线存储,选择质量最高的数据集进行分析。
1.4 STI的离线分析
1.4.1 2D-STI 2D-STI数据分析采用QLab工作站(10.3.1,Philips Healthcare,美国)。左室整体纵向应变(global longitudinal strain, GLS)通过计算心尖四腔心、三腔心及两腔心切面各纵向应变平均值而获得。左心室(左室)整体圆周应变(global circumferential strain, GCS)通过计算胸骨旁左室短轴二尖瓣水平、腱索水平及心尖水平各环向应变平均值而获得。
1.4.2 3D-STI 3D-STI数据分析采用TomTec工作站(4.6.0.411, Tomtec Imaging Systems GMBH, 德国)4D LV分析插件。选取3个长轴参考切面(心尖四腔、两腔和三腔心切面),确定二尖瓣环位置、半自动描记心内膜后,软件自动分析得出左室LVEF、舒张末期容积(end-diastolic volume, EDV)、收缩末期容积(end-systolic volume, ESV)、GLS、GCS、扭转及扭转力矩等参数。
1.4.3 3D左室收缩不同步指数(3D-systolic dyssynchrony index, 3D-SDI) 采用QLab (Philips Healthcare, 美国)计算3D-SDI,用从QRS波开始到左室收缩期最小容积时间(Tmsv)的标准差(standard deviation, SD)表示,反映左室整体非同步化运动,可从16节段(基底段及中间段各6节段、心尖段4节段)、12节段(基底段及中间段各6节段)或6节段(基底段6节段)中获得这一参数。除Tmsv-SD指数外,软件可自动计算出左室16、12、6节段Tmsv的最大差值(maximal difference, Tmsv-Dif),分别为Tmsv16-Dif、Tmsv12-Dif、Tmsv6-Dif。计算Tmsv-SD及Tmsv-Dif所占心动周期的百分率,分别为Tmsv16-SD%、Tmsv12-SD%、Tmsv6-SD%、Tmsv16-Dif%、Tmsv12-Dif%、Tmsv6-Dif%。
1.5 观察者之间和观察者内的差异 通过计算2个观察者测量值之间的差异来评估观察者之间的可重复性。通过计算同一观察者的原始读数和重复读数的差异来分析观察者自身的可重复性。

2 结 果
2.1 病例组与对照组相关参数比较 结果(表1)显示:病例组患者的心率明显低于对照组(P=0.02),但仍在正常范围内。病例组2D超声心动图及2D-STI测得的左室功能参数与对照组差异无统计学意义。病例组和对照组3D-STI参数LVEF、EDV、GLS、GCS差异有统计学意义(P<0.05)。病例组16、12、6节段的Tmsv-SD%、Tmsv-Dif%均明显大于对照组(P<0.01)。
2.2 高剂量组与低剂量组3D-STI和3D-SDI参数比较 高剂量组15例患者累计接触(529.6±48.5) mg/m2蒽环类药物,低剂量组5例患者累计接触(338.2±11.3) mg/m2蒽环类药物。结果(表2)显示:应用3D-STI时,高剂量组GCS低于低剂量组(P=0.04);两组LVEF、EDV、GLS差异无统计学意义。高剂量组Tmsv16-Dif%大于低剂量组(P=0.02);其他3D-SDI参数在高剂量组与低剂量组之间差异无统计学意义。

表1 病例组和对照组患者的基本信息和超声心动图参数比较

表2 高、低剂量组3D-STI和3D-SDI参数比较
2.3 典型对象RT-3DE分析 图1A显示对照组1名健康者16个左室节段的同步收缩情况。左室各节段几乎在同一时间点达到最小收缩体积,体积曲线形态像扎着一根皮筋的马尾辫,起伏整齐、到最小收缩体积的时间较短,表明室壁收缩同步性好。
图1B显示病例组1例患者16个左室心肌节段的非同步收缩情况,各节段达最小收缩体积时间差异大,且达最小收缩体积的时间较长,表现为Tmsv明显离散的不同步模式,表明室壁收缩同步性差。

图1 对照组(A)和病例组(B)典型对象左室16节段体积-时间变化曲线图
2.4 观察者内和观察者间3D-SDI测量可重复性检测 结果(图2)显示:Tmsv16-SD%、Tmsv12-SD%、Tmsv6-SD%在观察者内的ICC分别为0.97、0.98、0.98,在观察者间的ICC值为0.95、0.98、0.96。
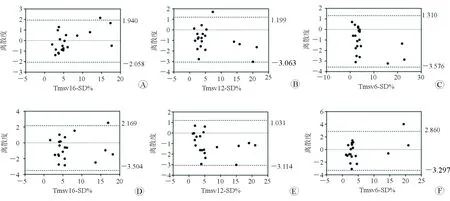
图2 观察者内和观察者间16、12和6个节段Tmsv-SD%测量可重复性的Bland-Altman分析结果
3 讨 论
3.1 3D-STI 随着人类寿命的延长及抗肿瘤治疗技术的革新,化疗药物引发的心脏毒性是年长的肿瘤长期存活患者不容忽视的问题。尤其当化疗药物导致的心脏不良反应与老年患者心血管功能不可逆的退行性变化叠加时,常使问题更加棘手。在所有导致心脏毒性的化疗药物中,蒽环类药物与多种心血管疾病的关系最为密切[5]。目前,较多证据[6-7]显示,3D-STI可用于监测接受化疗患者的亚临床心肌功能障碍,该方法具有非切面相关性、可重复性、同一组计算多种分量的优点。然而,因目前尚缺乏大型临床研究支持,3D-STI尚未在临床中常规使用。本研究中,虽然病例组患者左室GLS与GCS较对照组显著下降,可在一定程度上评估心脏收缩功能障碍,但在区别高剂量与低剂量蒽环类药物对心脏长期影响的差异性方面敏感性欠佳。而RT-3DE衍生的3D-SDI发现,高剂量组患者表现出明显的心功能损伤。
缺血和非缺血性心脏损伤会引起心室的大小、形态和功能的异常。发生充血性心力衰竭后,心室不良重塑可表现为心腔内径、容积及每搏输出量减小[8]。本研究发现,肿瘤长期生存者3D-EDV较健康对照显著减小;常规2D左室舒张功能参数无明显变化。3D超声心动图克服了2D超声心动图依赖于几何假设、角度依赖、不能检测心肌所有节段的缺点,能更灵敏和精准地检测早期心脏毒性。这一发现也为研究蒽环类药物致心脏损伤的机制提供了新的视角,在左室收缩功能发生亚临床损伤的同时,舒张功能障碍提示发生限制性心肌病的潜在倾向。这一发现进一步解释了蒽环类药物引起心脏毒性的机制。当蒽环类药物在心肌细胞内异常累积时,可通过释放大量氧自由基造成心肌细胞损伤及死亡,最终导致心肌纤维化[9],而纤维化也是限制性心肌病的一个重要病理改变。Goldstein等[10]指出,蒽环类药物所致的心脏损伤属于限制性心肌病范畴。
3.2 3D-SDI 蒽环类药物致心脏损伤的九大表现中以心律失常最为常见,但鲜有研究探讨蒽环类药物对心肌收缩同步性的影响。本研究中,各项SDI指标均表明肿瘤长期生存患者左室收缩同步性显著劣于同龄的健康人,提示蒽环类药物对心脏的长期影响主要体现在室壁运动失同步方面。同时,对比高剂量及低剂量组患者各SDI指标差异发现,经心率校正的Tmsv16-SD%及Tmsv16-Dif%是监测高剂量蒽环类药物长期心脏毒性的敏感指标。该结果提示,左室16节段收缩同步性指标与不同的蒽环类药物累计剂量之间高度相关,说明SDI尤其是基于16节段的SDI可作为一种非侵入性工具,用以检测癌症长期生存者可能由蒽环类药物诱发的心脏损伤。
尽管短期心脏毒性相关研究未发现患者心率有显著的改变[11],然而本研究发现长期生存患者的心率显著减慢。同样,Chen等[12]的小鼠体内研究发现,蒽环类药物具有减慢心率的作用,且该现象在加用心脏保护剂后可消失。以上结果提示,对于肿瘤长期存活患者,应慎用减慢心率的药物。
心动过缓合并收缩不同步标志着心肌传导系统出现障碍,严重临床心力衰竭出现时可通过心脏再同步治疗(CRT)获益。Ahlehoff等[13]报道了1例完成以蒽环类药物为主的化疗后,出现严重难治性充血性心力衰竭的乳腺癌病例。该患者接受CRT后左室功能恢复正常。本研究发现,LVEF正常的患者也存在左室收缩不同步,该证据为亚临床非同步化运动先于左室收缩功能障碍出现提供了理论依据。本研究提示,SDI尤其是Tmsv16-Dif%可用于早期风险分层,以便及时干预。
3.3 3D-STI和3D-SDI联合 心脏保护剂与抗肿瘤药物联合使用可预防及延缓化疗药物所致的心脏损伤。传统的抗心衰药物,包括血管紧张素转换酶抑制剂和受体阻滞剂,可预防无症状左室功能障碍[14]。然而,加用其他心脏保护制剂是否会加速心肌收缩功能恶化及心率降低仍有待研究。本研究提示,在2D超声心动图及2D-STI指标不够灵敏、失去鉴别效力时,3D应变指标GLS及GCS联合3D-SDI参数可敏感监测不同累计剂量的蒽环类药物对患者心脏形态及收缩同步性的长期影响。因此,3D-STI及3D-SDI为对肿瘤长期生存患者心功能行动态监测的有效工具。
3.4 本研究局限性 本研究存在一定局限性:(1)样本量较小,需要更大样本量的研究来进一步证明本结果;(2)研究结果来自单中心数据,未来需要进行多中心研究,以在不同患者群体和医疗环境下验证;(3)在随访期间未记录肿瘤生存者的心电图结果,而QT间期延长及左束支传导阻滞等因素会影响左室收缩时间。
综上所述,部分抗肿瘤治疗存在潜在的心脏毒性,当2D超声心动图及2D-STI指标不够灵敏时,3D-STI及3D-SDI可用于监测肿瘤长期生存患者的心功能。

