海南柠檬皮多糖的提取工艺及体外抗氧化活性研究
(黄河科技学院 医学院,河南 郑州 450063)
柠檬(Citruslimon)为芸香科柑橘属植物,又称柠果、益母果等,含大量柠檬酸、维生素C、糖类等物质,营养和药用价值极高[1]。柠檬皮富含多糖类化合物,具有降血脂、抗衰老、抗炎等功效,对脾胃气滞、脘腹胀痛、食欲不振等也有较好的治疗效果,在食品、医药领域具有广阔的应用空间[2]。目前,从植物中提取多糖的方法有溶剂浸提法、酶提取法、热水提取法等[3-4],但大都存在提取工艺复杂、效率低等缺点。近年,超声波辅助提取技术已十分成熟,提取率高、提取时间短、操作简便。本文以柠檬皮为原料,利用超声波辅助方法提取柠檬皮多糖,设计单因素试验和正交试验,对影响多糖提取率较显著的因素料液比、超声时间、温度、超声功率进行优化,并探讨其体外抗氧化活性,为深度开发利用柠檬皮资源提供一定的理论支撑。
1 仪器与材料
1.1 仪器
MF2104型电子天平(上海亚津电子科技有限公司);YSF-25型粉碎机(山东精诚医药装备制造有限公司);JP-301ST型超声波清洗器(常州欧达超声波设备有限公司);TU-1810紫外-可见分光光度计(北京普析通用仪器有限公司);3号和5号药典筛(新乡市先恒机械设备有限公司);DZF-6050真空干燥箱(冠森生物有限公司);SHBIIIG台式循环水式多用真空泵(郑州长城科工贸有限公司);VRT-10旋转蒸发仪(上海德贤实验仪器有限公司)。
1.2 材料
柠檬(产地:海南万宁),购于郑州家辉生鲜超市;葡萄糖(GR),三吡啶三吖嗪(TPTZ,AR,上海阿拉丁);苯酚,无水乙醇,浓H2SO4(AR,天津市大茂化学试剂厂);FeSO4,冰醋酸(AR,天津市永晟精细化工);5 %苯酚溶液(自制)。
2 方法
2.1 柠檬皮的预处理
将新鲜柠檬去皮,洗净、除去杂质,自然晾干,于烘箱中55 ℃干燥至恒重,粉碎得柠檬皮粉末,先后过3号和5号药典筛,于室温下密封保存,备用。
2.2 柠檬皮多糖提取条件的单因素试验
自然pH值下,精密称取1.000 g预处理后柠檬皮粉末,分别设置料液比1:20,1:30,1:40,1:50,1:60(g/ml),超声温度30,40,50,60,70 ℃,超声时间10,20,30,40,50 min,超声功率200,250,300,350,400 W,进行单因素试验,考察各因素对柠檬皮多糖提取率的影响。
2.3 正交试验优化提取条件
根据单因素试验各因素分析的结果,分别选取料液比(A)、超声时间(B)、超声温度(C)、超声功率(D)为考察因素,通过四因素三水平[L9(34)]正交试验进一步优化柠檬皮多糖的超声波提取工艺。因素水平设置见表1。
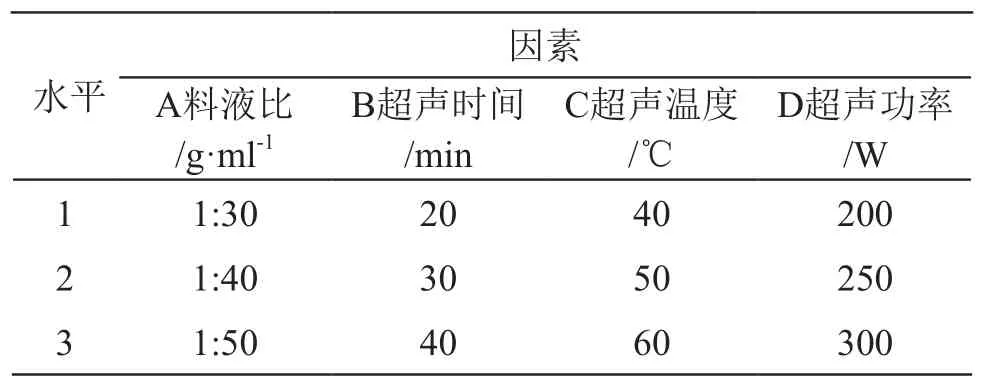
表1 正交试验因素水平表
2.4 多糖提取率的计算
精密称取葡萄糖对照品1.000 g于100 ml量瓶中,加水定容。精密移取溶液1.0 ml,定容至100 ml,得0.1 mg/ml对照品溶液。分别精密移取0.2,0.4,0.6,0.8,1.0,1.2 ml葡萄糖对照品溶液,加蒸馏水至2.0 ml,加l5 %苯酚溶液1.0 ml、浓硫酸5.0 ml,定容至50 ml。静置15 min,测定490 nm波长处吸光度值,并以葡萄糖对照品溶液质量浓度(mg/ml)为横坐标、吸光度为纵坐标绘制标准曲线[5]。取柠檬皮多糖提取液,冷却,抽滤,浓缩滤液,滤液定容至100 ml。精密移取1.0 ml,加浓硫酸10.0 ml,5 %苯酚溶液2.0 ml,定容至50 ml,静置15 min,测定490 nm波长处吸光度,代入标准曲线,计算多糖粗提取率[6]。
2.5 抗氧化活性试验
采用铁离子还原法(FRAP法)测定体外抗氧化活性。取1.8 ml FRAP工作液(pH 3.6的醋酸盐缓冲液、TPTZ溶液与FeCl3溶液按一定比例混合[7]),依次加入100,200,300,400,500,600,700,800 μmol/L的FeSO4标准溶液0.2 ml,37 ℃放置15 min,于593 nm处测定吸光度,绘制标准曲线[8-9]。精密量取柠檬皮多糖粗提液,用水稀释至不同浓度,加FRAP工作液6 ml和超纯水600 μl,置于37 ℃水浴锅中,15 min后测定593 nm波长处的吸光度。将吸光度值代入标准曲线,多糖提取液抗氧化能力以FeSO4摩尔浓度表示。
2.6 数据处理和分析
单因素试验和标准曲线均采用OriginPro8.5软件作图,测定结果为5次平行测定的平均值。
3 结果与分析
3.1 单因素试验
3.1.1 料液比对多糖提取率的影响 按2.4项下方法,固定超声时间20 min,温度50 ℃,超声功率300 W,按料液比1:20,1:30,1:40,1:50,1:60(g/ml)提取柠檬皮多糖,探索料液比对柠檬皮多糖提取率的影响,结果见图1。

图1 料液比对柠檬皮多糖提取率的影响
由图1可见,柠檬皮多糖提取率随料液比的增加呈逐渐升高而后下降的趋势,在料液比为1:40时多糖提取率达到最大值。这可能是由于在一定程度上增加溶剂体积可增大与浸提物的接触面积,对多糖提取有利,溶剂量继续增加时柠檬皮多糖的提取率达到饱和,但溶剂量过多时,其他杂质同时溶出[10-11],导致提取率降低。因此,1:40为提取多糖的最佳料液比。
3.1.2 最佳超声时间的确定 按2.4项下方法,固定料液比为1:40,超声温度50 ℃,超声功率300 W,探索超声时间对柠檬皮中多糖提取率的影响。结果见图2。

图2 超声时间对柠檬皮多糖提取率的影响
由图2可见,随超声时间的增加柠檬皮多糖的提取率逐渐升高,在时间为30 min时提取率达最大,提取率明显下降。这是由于超声时间短时,多糖溶出不完全,但超声时间过长,杂质的溶出量相应增加,且多糖的结构也可能遭到破坏[12]。因此,将最佳超声时间确定为30 min。
3.1.3 最佳超声温度的确定 按2.4项下方法,固定料液比为1:40,超声时间30 min,超声功率300 W,探索超声温度对柠檬皮中多糖提取率的影响。结果见图3。
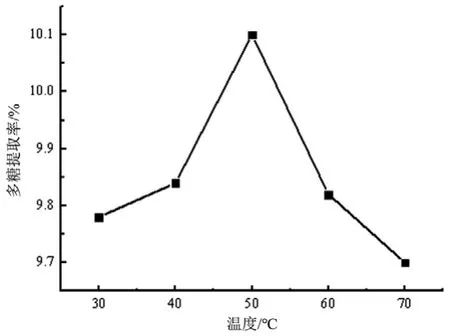
图3 超声温度对柠檬皮多糖提取率的影响
由图3可见,多糖提取率随超声温度的升高先增加后降低,说明温度较低时,多糖溶出量较少,在超声温度为50 ℃时提取率达最大值,之后多糖分子结构可能由于温度过高而发生改变,而且会消耗能量,导致对多糖的提取不利。因此,选择提取温度为50 ℃较为合理。
3.1.4 最佳超声功率的确定 按2.4项下方法固定料液比为1:40,超声时间30 min,超声温度50 ℃,探索超声功率对柠檬皮中多糖提取率的影响。结果见图4。
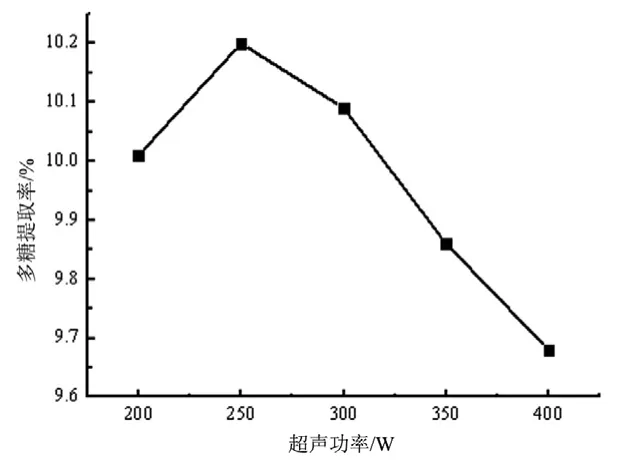
图4 超声功率对柠檬皮多糖提取率的影响
由图4可见,多糖提取率随着超声功率的增加呈先上升后下降的趋势,超声功率低于250 W时提取率明显增加,250 W时提取率最高,达10.20 %,继续增加超声功率多糖提取率陡然降低,且增加原料的消耗。因此,选择超声功率为250 W。
3.2 正交试验
正交试验结果见表2。
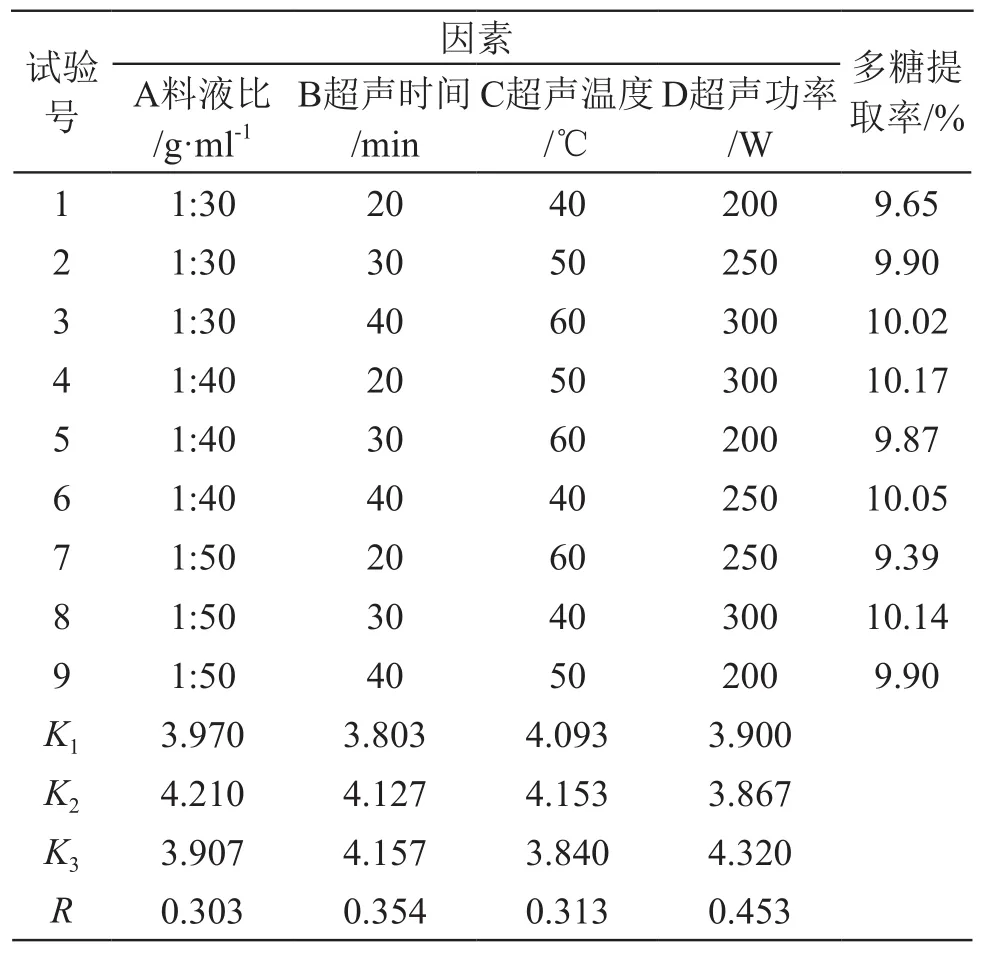
表2 柠檬皮多糖正交试验结果表
由表2可见,超声功率对提取率的影响最大,各因素对柠檬皮多糖提取率影响的主次顺序为:D>B>C>A,即超声功率>超声时间>温度>料液比。由K值分析得出柠檬皮多糖的理论最优提取条件为A2B3C2D3,即料液比1:40,超声时间40 min,超声温度50 ℃,超声功率300 W。
3.3 验证性试验
将实际操作条件设置为料液比1:40,超声时间40 min,超声温度50 ℃,超声功率300 W,精密称取3份柠檬皮粉末,在此工艺条件下进行3次平行试验。结果显示,柠檬皮多糖的平均提取率为10.29 %,RSD=2.84 %,说明超声波提取柠檬皮多糖的方法可行,工艺稳定、符合要求。
3.4 体外抗氧化活性试验
分别以粗提液多糖质量浓度、FeSO4摩尔浓度为横坐标和纵坐标绘制曲线,即可得到柠檬皮多糖的体外总抗氧化能力[13-15],见图5。由图5可见,柠檬皮多糖的抗氧化活性随多糖浓度的增加呈线性增强,线性相关方程为y=0.1855x-0.0441,R2=0.9990。

图5 抗氧化活性测试曲线
4 结论
采用单因素试验和正交试验对超声波辅助提取柠檬皮多糖的条件进行优化,试验结果显示,柠檬皮多糖的最佳提取工艺为:料液比1:40,超声时间40 min,超声温度50 ℃,超声功率300 W。结果表明:在此工艺条件下柠檬皮多糖的提取率最高,多糖平均提取率为10.29 %,且超声功率是超声波提取过程中较为关键的因素。FRAP方法显示柠檬皮多糖的抗氧化能力与浓度呈线性关系,并逐渐增强。
柠檬皮芳香怡人,含有丰富的氨基酸和维生素,在保健品和药品市场前景广阔。柠檬皮多糖的提取为柠檬皮多糖新的生产工艺及产业化应用提供理论依据和实际参考,对推动柠檬皮多糖产业发展具有重要意义。

