结合影像特征对结直肠癌同时性肝转移同期及二期切除术患者的预后分析
李涵笑, 刘再毅, 黄燕琪, 黎娇, 朱超, 梁长虹
结直肠癌是全球第三常见的恶性肿瘤,死亡率位居恶性肿瘤第四位[1,2],14%~20%患者会发生同时期肝转移[3],20%~30%患者导致死亡的原因是因为发生了肝转移[4],结直肠癌同时性肝转移(synchronous liver metastasis,sCRLM)患者未经治疗1年生存率不足30%,5年生存率不足6%[5],肝转移是结直肠癌患者致死的重要原因[6]。目前临床认为,结直肠癌同期合并独立肝转移是一个较为困难的临床管理问题[7]。目前公认手术切除原发灶及转移灶是最有效的治疗方法[8]。根治性的手术切除是指能够切除所有已知的病灶,包括原发灶及肝转移灶,并且达到R0切除。同时性肝转移患者手术策略主要包括原发灶及转移灶的一期同步切除和二期分阶段切除。一期同步切除是指同时切除结直肠的原发病灶及所有肝转移灶,二期分阶段切除的传统模式是指先切除结直肠癌(colorectal cancer,CRC)原发病灶,达到合适时机时(通常是原发灶术后4~6周)再二期切除肝转移灶[9]。转移性结直肠癌患者的治疗决策必须以证据为基础[10]。影像学检查可以辅助诊断、分期、判断原发灶及转移灶与周围组织结构的关系、明确患者是否合并其他部位转移等,可为治疗策略的制定提供依据[11]。本文旨在分析与sCRLM患者术后生存时间(overall survival,OS)相关的影像及临床独立预测因子,为临床上筛选此类患者提供证据支持。
材料与方法
1.病例收集
回顾性搜集2012年1月-2015年12月广东省人民医院明确诊断为结直肠癌肝转移的患者,并按照以下纳入及排除标准进行病例筛选。纳入标准:①患者经病理证实为结直肠癌,且确诊时有临床或病理检查诊断合并肝转移;②患者采用一期切除或分期切除结直肠癌原发灶及肝转移灶的治疗方案。排除标准:①患者未完成完整的治疗方案时死亡或终止治疗;②初诊时患者合并有除肝脏外其他部位的转移;③患者合并有全身性疾病,包括但不限于缺血性心脏病、感染、自身免疫性疾病、术前合并肠穿孔或梗阻等;④患者合并有家族性腺瘤性息肉病等遗传性疾病;⑤未行术前CT/MRI检查;⑥失访患者,且失访时未达到结局事件。本研究通过我院医学伦理委员会审批。
从患者临床电子病历中搜集其临床、病理等基数资料,包括:年龄、性别、临床复发风险评分(clinical risk score,CRS)标准的相关特征[包括转移瘤的数目及大小、原发肿瘤淋巴结是否累及、术前癌胚抗原水平(carcinoembryonic antigen,CEA)]、原发肿瘤所在位置、影像图像特征(如肝转移灶内是否存在坏死、肿瘤是否突破浆膜层向外侵犯)。
根据患者采取的治疗方式分为两组:①同期切除结直肠癌原发病灶及肝转移灶,术后结合辅助治疗;②先一期切除结直肠癌的原发灶,再二期切除肝转移灶,同时合并辅助治疗。
2.病例随访
患者本人及家属的联系方式从我院病历系统获得,通过电话随访的方式获取预后信息。失访或无法获得终点事件发生时间的病例被排除。总的生存时间(OS)定义为患者从完成手术治疗至到达终点事件时经历的时间。最末次随访时间为2019年12月,随访时间为4年及以上,不包括中途到达终点事件与失访的病例。
3.结直肠癌CRS评分
CRS评分是由Fong教授提出的转移性结直肠癌的临床风险评分系统[12],也是目前使用最多的一种评分系统,研究人员根据该评分标准提出的5个判断因素对纳入病例进行评分,≤2分为低风险组,>2分为高风险组。由于本研究纳入的病例是同时性肝转移患者,均满足从原发到转移的无病生存期(Disease-free survival,DFS)时间间隔<12个月,因此评分至少为1分。
4.图像获取及影像特征评估
采用患者术前最近一次的影像学CT和/或MRI检查图像进行评估,由两位具有6年以上影像学诊断经验的影像医生进行图像评估,判断肝转移灶内是否合并坏死(图1)及原发肿瘤是否突破浆膜向外生长(图2),当两者意见出现分歧时,通过讨论达成统一意见。
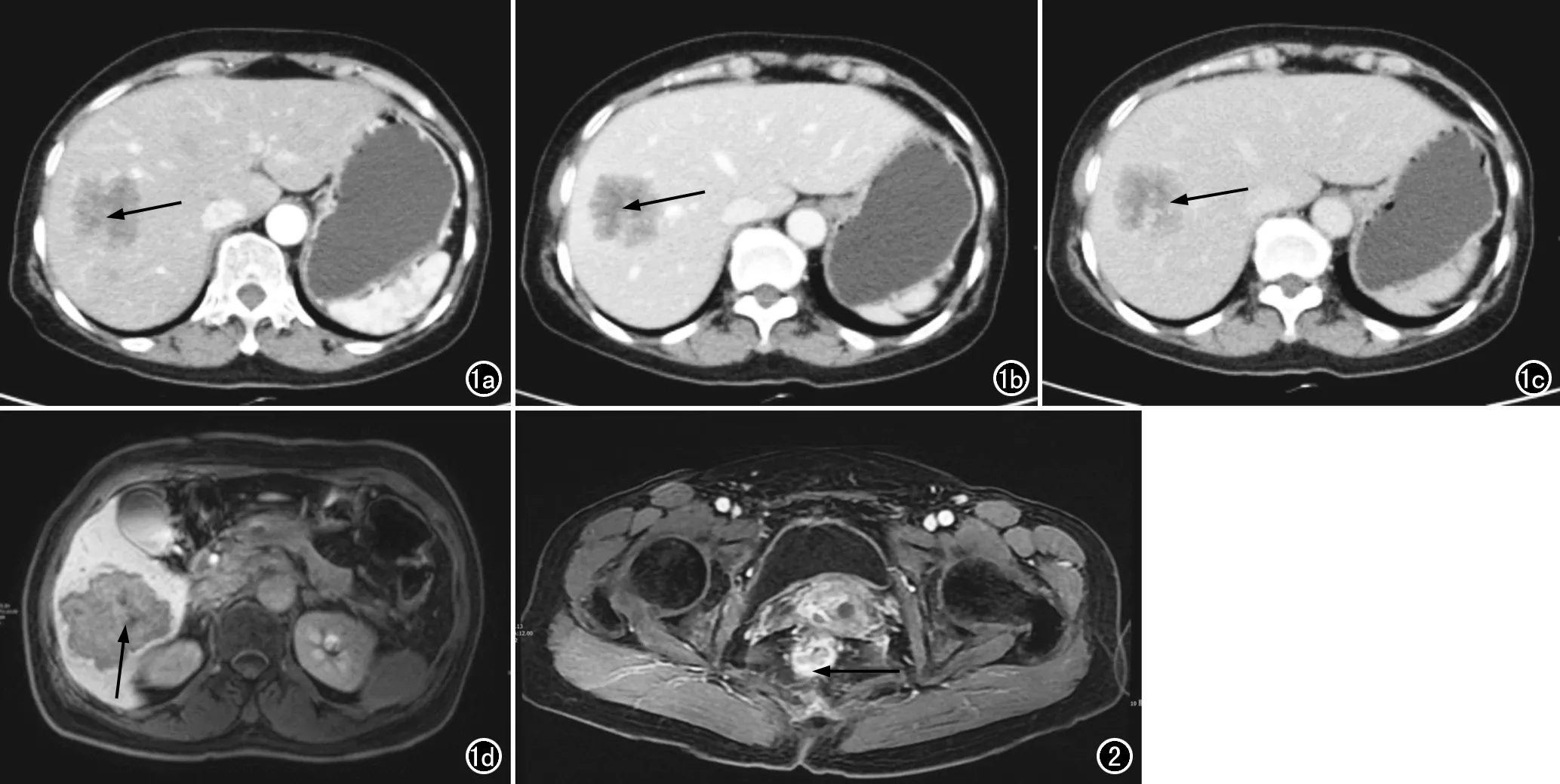
图1 肝转移灶坏死的CT及MRI表现。a) 肝转移灶CT增强扫描动脉期图像,可见病灶边界不清,存在未明显强化区(箭); b) 肝转移灶CT增强扫描门脉期图像,未强化区(箭)与强化灶的密度对比更加明显; c) 肝转移灶CT增强扫描静脉期图像,未强化区(箭)仍然存在; d) 普美显MRI增强扫描图像,同样可见病灶中央低信号坏死区(箭)。 图2 直肠癌突破浆膜层向外浸润的MRI表现,6点方向可见肿瘤向浆膜外生长,浸润深度约4mm(箭),病理结果证实肿瘤突破浆膜向外浸润生长。
5.统计学分析
采用RStudio软件(版本1.3.1073)进行统计学分析,通过加载相应的程序包及函数进行统计学检验。数据集间的等级资料比较采用Wilcoxon秩和检验,分类变量的组间比较采用卡方检验或Fisher精确检验,使用K-M法绘制生存曲线,单因素及多因素COX回归分析用于生存分析。以P<0.05为差异有统计学意义。
结 果
1.病例基线资料
本研究通过预先设定的纳入及排除标准进行病例筛选,共有69例符合标准的病例。随后进行病例基线临床资料的收集与预后随访获取OS,其中12例病例由于无法获得预后信息或失访而排除。最终有57例患者纳入本研究,基线资料数据统计结果见表1。

表1 纳入病例的基本情况统计
2.生存曲线分析
按照患者采取的治疗方式不同分为一期切除组(Group 0)和二期切除组(Group1),两组患者的中位生存时间分别为32.5个月和29.0个月。两组患者的生存曲线见图3,两组患者的基线资料见表2,两组患者的生存时间差异无统计学意义(P>0.05)。
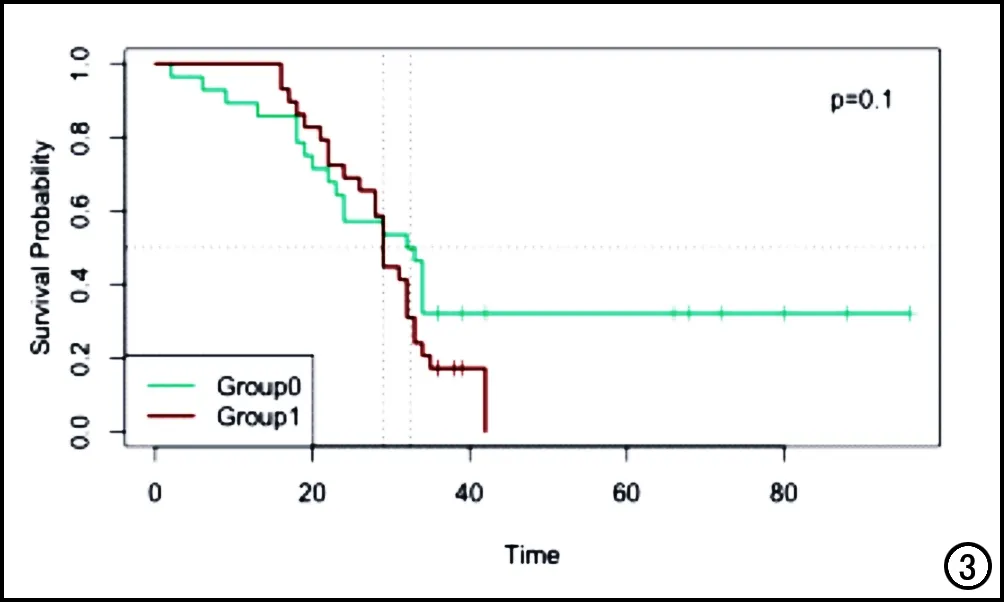
图3 两组患者的生存曲线。
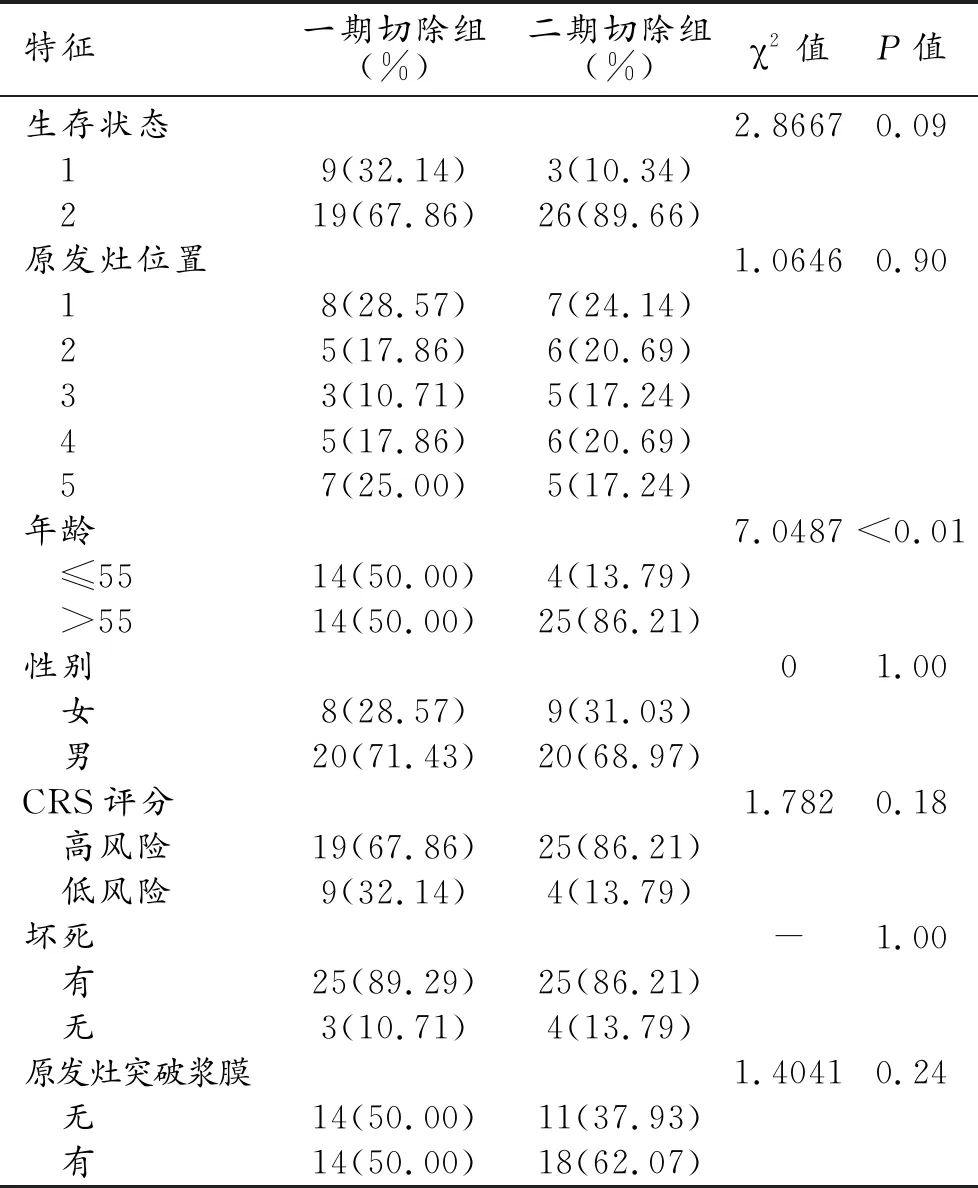
表2 两组患者的基本情况统计
3.COX回归分析
COX单因素回归分析中发现有4个与生存时间相关的危险因素(P<0.05),将这4个因素进行多因素COX回归分析,结果发现CRS评分、转移灶内存在坏死以及原发肿瘤突破浆膜向外生长具有统计学意义(P<0.05),是影响预后时间的独立危险因素(表3)。
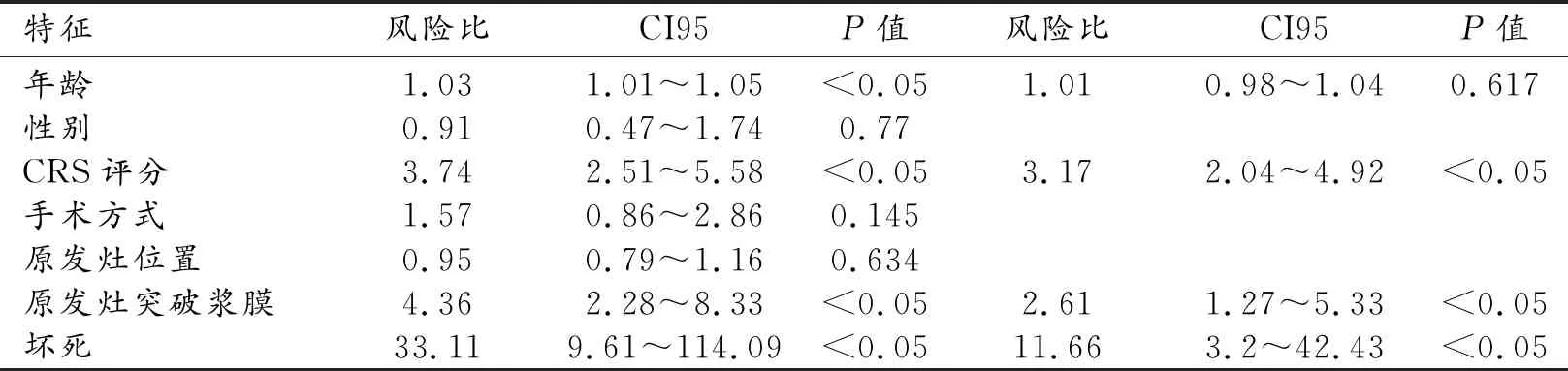
表3 COX回归分析结果
讨 论
结直肠癌同时性肝转移患者手术切除是唯一具有治愈潜能的治疗方式,对于可切除性的肝转移灶,建议尽量进行R0切除,包括一期切除及二期切除等方式[13]。而对于病灶可切除性的评估标准仍在不断研究及补充。影像学检查是术前评估的重要证据支持,包括CT、PET/CT、MRI以及超声等,目的是为了明确肝转移灶的分布、大小、数量以及与大血管的关系等[11,14]。除了这些解剖学特征,影像学检查还能提供其他与肿瘤相关的特征,包括转移灶内部是否有坏死(图1)、原发灶是否已突入浆膜层向外生长(图2)等。不仅如此,对于临床上常用的CRS评分,影像学检查也能提供相关的证据,包括最大转移灶的直径、肝转移灶的数量以及是否有周围淋巴结的转移等,因此影像学检查对于临床上为患者制定合理的个体化诊疗方案有重要作用。
本研究通过获取57例患者的生存时间以及相关的临床及影像特征,发现采用一期与二期手术的患者间生存时间差异无统计学意义,表明两种治疗方式在患者生存时间的影响上不存在明显差异。但CRS评分、肝转移灶中存在坏死、原发灶突破浆膜向外生长是影响患者生存时间的危险因素,即当患者合并危险因素时,无论做一期或二期切除手术,其生存时间都有可能会短于未合并危险因素的同类患者;此结果可能为临床上筛选适合手术切除的患者提供一些决策依据,但仍然不能忽略患者自身身体状况等客观条件。
既往有研究对CRLM患者的预后影响因素进行分析。有多项研究证实CEA等临床病理因素对结直肠癌肝转移患者的预后有相关性[15,16],这一点也在本研究中得到了印证。本研究还通过影像学检查获得的特征性表现与患者的预后进行回归分析,结果显示影像学检查中发现的转移灶内存在坏死以及原发灶突破浆膜向外生长是独立的预测因子。这可能是由于当肿瘤突破浆膜向外生长时,肿瘤细胞的播撒已经开始;而肝转移灶中的坏死与预后相关的原因可能是与转移灶内的血管侵犯以及肿瘤浸润性炎症有关,有研究证实这些因素是肝切除术后复发的独立危险因素[17,18]。本研究比较了一期切除与二期切除患者的生存时间,发现两者差异无统计学意义,相关研究也同样发现两种治疗方式间差异无统计学意义[19];然而目前仍然有学者认为一期切除的安全性更高,但是一期切除对患者的筛选条件会更严格[20]。
本研究存在以下局限性:首先,纳入病例较少、患者个人的治疗选择意愿可能会影响本研究结果;其次,本研究的随访时间仍不够长,可能无法判断患者是否完全到达R0切除水平;另外,本研究为回顾性研究,未来还需要前瞻性研究证实。
综上所述,临床CRS评分、影像学检查可观察到的肝转移灶内存在坏死、原发灶突破浆膜层向外生长是与结直肠癌同时性肝转移患者同期及二期切除术预后相关的危险因素。影像学特征与预后有一定相关性,这提示影像学表现也可以为临床上筛选此类患者提供一定证据支持,在实际临床工作中应该通过多学科诊疗模式来制定适合患者的个性化临床决策,对于同时性肝转移结直肠癌患者手术治疗的筛选条件还需要不断补充及证实。

