超高b值扩散峰度成像对前列腺癌的诊断及肿瘤分级评估价值
李敏,王明帅,张继洋,张小东,蒋涛
扩散峰度成像(diffusion kurtosis imaging,DKI)基于非高斯分布模型上,包括扩散系数(D7b)及峰度系数(K)的计算,可反映器官的微观结构改变对水分子扩散的影响,更能准确评估组织微环境的复杂性。相关研究结果显示,DKI对前列腺癌具有较高的诊断价值[1,2]。然而,大部分研究b值最大为3000 s/mm2,可能会限制非高斯分布模型对于组织器官微观结构变化的评估[3,4]。本研究采用最高为4000 s/mm2的b值,旨在探讨DKI模型对于前列腺癌的鉴别诊断及肿瘤分级评估价值,并与单指数模型计算的ADC值(b=0、3000 s/mm2)进行比较。
材料与方法
1.研究对象
回顾性搜集2017年6月-2019年1月在北京朝阳医院行前列腺MRI检查并经病理证实的患者349例。病例纳入标准:①MRI检查前无前列腺穿刺活检或其他前列腺手术史;②无内分泌治疗史或放化疗病史;③MRI检查完成后1周内进行前列腺穿刺活检或根治手术治疗。病例排除标准:①前列腺肿瘤体积<0.5 cm3;②术后病理Gleason评分<6分;③图像质量差。
对上述患者进行筛选,最终纳入39例前列腺增生(benign prostatic hyperplasia,BPH)和63例前列腺癌(prostate cancer,PCa)患者。39例前列腺增生患者的年龄为50~82岁,平均(65.8±8.1)岁,前列腺特异性抗原(prostate specific antigen,PSA)值为1.35~48.97 ng/mL,平均(11.65±9.44) ng/mL,其中24例经前列腺穿刺术后病理证实,15例经前列腺根治手术切除后病理证实。63例PCa患者的年龄为54~89岁,平均(68.5±9.2)岁,PSA值为3.61~>100 ng/mL,平均(34.29±32.64) ng/mL,其中37例经穿刺术后病理证实,26例经根治手术切除后病理证实。
最后,根据病理结果将63例PCa患者分为低危组(Gleason=3+3、3+4)、中危组(Gleason=4+3,4+4)及高危组(Gleason≥9)。
2.检查方法
MRI检查采用德国西门子3.0T Prisma MR扫描仪,16通道相控阵体部线圈。检查前嘱患者适当饮水以充盈膀胱,尽量排便、排气以减少直肠肠气伪影,患者取仰卧位,扫描范围包括整个前列腺和精囊腺。扫描序列及参数:高分辨解剖图像包括轴面T1WI (TR/TE 700/12 ms,层厚3.5 mm,层间距0 mm,视野200 mm×200 mm~250 mm×250 mm,最大矩阵256×256)和轴面、矢状面及冠状面T2WI (TR/TE 3770/101 ms,层厚3.5 mm,层间距0 mm,视野200 mm×200 mm~250 mm×250 mm,矩阵320×320)。
DWI采用单次激发自旋回波平面回波成像(single-shot echo planar imaging,EPI),采用7b值 (04、4006、8008、120010、200010、300012和400012s/mm2),沿三个互相垂直的扩散敏感梯度方向,其他扫描参数:TR/TE 3100/68 ms,层厚3.5 mm,层间距0 mm,最大矩阵120×120,视野350 mm×350 mm,扫描时间为10 min。
3.图像分析及处理
由两位前列腺影像诊断经验丰富的放射科医师共同阅片,意见不一致时通过协商达成一致,然后由其中一名医师完成感兴趣区(region of interest,ROI)的绘制。结合术后病理描述及穿刺点的位置,参考常规T2WI及DWI的信号特点,避开精囊、囊变、血管、出血或钙化等区域。根据前列腺影像报告和数据系统(Prostate Imaging-Reporting and Data System Version 2.1,PI-RADS2.1),癌灶ROI选取每例患者外周带或移行带侵袭性最强病灶(体积最大或发生前列腺包膜外侵犯的癌灶),在ADC图像上手动连续勾画出整个肿瘤体积。前列腺增生组在每例患者的移行带和外周带各放置一处ROI作为对照,移行带ROI放置在基质增生为主的区域(T2WI移行带中均匀的圆形/椭圆形低信号结节,边界尚清晰),外周带ROI应尽量选择显示较佳的层面。
4.DKI模型计算
计算ADC值的单指数模型,采用公式(1),其中S(b)为不同b值下的信号强度,ADC为扩散系数,S_0表示b为0时的信号强度。本研究中用ADC3000代表b值为0和3000 s/mm2DWI的ADC值。
S(b)=S_0e-ADCb........(1)
计算DKI信号衰减方程使用非线性最小二乘法,公式如下:
S=S_0·exp(-b·D+b2·D2·K/6)[5]
其中S0表示b值为0时的信号强度,Sb表示不同b值下的信号强度,K为表观峰度系数,D为经非高斯分布校正过的表观扩散系数。利用西门子MR-Diffusion-Model软件提取7个b值的DKI参数图,测量每个ROI的K值及D值。
5.统计学分析
采用SPSS 20.0软件进行统计学分析。ADC3000、K及D值以均值±标准差表示,正态分布检验采用Kolmogorov-Smirnov检验。采用独立样本t检验比较39例外周带癌灶与39例良性病灶的ADC值及DKI参数值的组间差异;比较24例移行带癌灶与39例BPH的ADC值及DKI参数值的组间差异。按Gl-eason评分将前列腺癌患者分为3组,组间多重比较采用Bonferroni法。采用受试者工作特征(receiver operating characteristic,ROC)曲线分析各参数的诊断效能,计算曲线下面积(area under curve,AUC)。以P<0.05为差异有统计学意义。
结 果
1.外周带PCa与良性外周带各参数比较
39例癌灶的平均K值(K=0.815±0.160)较39例良性病灶高(K=0.518±0.130),差异有统计学差异(t=-9.095,P=0.000);癌灶的平均ADC3000值较良性病灶明显降低[分别为(0.522±0.140)×10-3s/mm2和(0.894±0.140)×10-3s/mm2],差异有统计学意义(t=11.459,P=0.000);癌灶的平均D7b值较良性病灶明显减低[分别为(0.968±0.290)×10-3s/mm2和(1.824±0.380)×10-3s/mm2],差异有统计学意义(t=11.132,P=0.000)。DKI(D+K)及ADC3000鉴别外周带PCa的AUC分别为0.968及0.971,差异无统计学意义(P>0.05,表1、图1)。
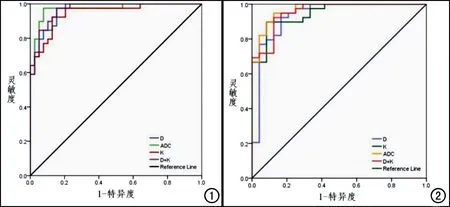
图1 ROC曲线分析DKI各参数及ADC3000对外周带前列腺癌的鉴别诊断效能。ADC3000对外周带PCa的诊断效能最高,AUC值为 0.971,灵敏度为97.4%,特异度为89.7%。 图2 ROC曲线分析DKI各参数及ADC3000对移行带前列腺癌的鉴别诊断效能。ADC3000对移行带PCa的诊断效能最高,AUC值为 0.955,灵敏度为94.9%,特异度为82.4%。
2.移行带PCa 与BPH各参数比较
24例癌灶的平均K值(K=0.808±0.140)较39例BPH高(K=0.573±0.075),差异有统计学意义(t=-8.723,P=0.000);癌灶的平均ADC3000值较BPH明显降低[分别为(0.549±0.100)×10-3s/mm2和(0.826±0.12)×10-3s/mm2],差异有统计学意义(t=9.190,P=0.000);癌灶的平均D7b值较BPH明显减低[分别为(0.977±0.310)×10-3s/mm2和(1.620±0.270)×10-3s/mm2],差异有统计学意义(t=8.748,P=0.000)。DKI(D+K)及ADC3000鉴别外周带PCa的AUC为0.955及0.968,差异无统计学意义(P>0.05,表1、图2)。
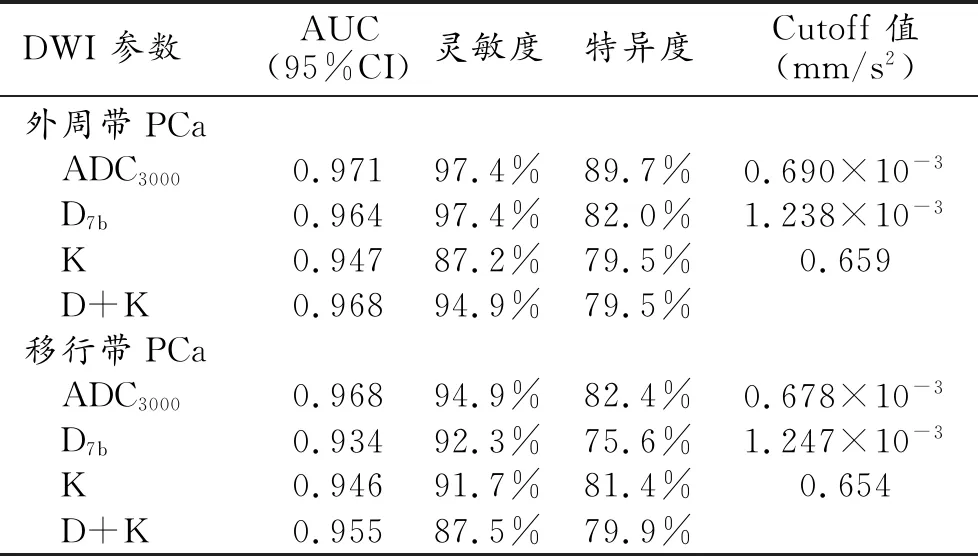
表1 DWI各参数对前列腺癌的鉴别诊断效能比较
3.PCa肿瘤分级
63例PCa患者中低危组PCa(Gleason=3+3,3+4分)22例,中危组PCa(Gleason=4+3,4+4分)17例,高危组PCa(Gleason≥9分)24例(图3~5)。低危组平均D值[(1.140±0.33)×10-3mm/s2]高于中危组[(0.892±0.19)×10-3mm/s2]及高危组[(0.874±0.25)×10-3mm/s2],差异均有统计学意义(P值分别为0.006、0.002)。低危组癌灶的平均K值(0.739±0.14)显著低于高危组(0.876±0.15,P=0.001),而与中危组(0.818±0.12,P=0.08) 差异无统计学意义。低危组癌灶的平均ADC3000值[(0.604±0.13)×10-3mm/s2]高于中危组[(0.526±0.10)×10-3mm/s2]及高危组(0.543±0.11)×10-3mm/s2],差异均有统计学意义(P值分别为0.020、0.001)。中、高危组PCa组间D、K及ADC3000值差异均无统计学意义(P>0.05)。
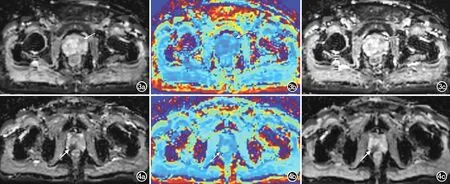
图3 患者,男,68岁,PSA为15.44ng/mL,前列腺中部左侧外周带癌灶(箭),根治术后病理结果示Gleason=3+4分。a) D值为1.417×10-3mm/s2;b) K值为0.675;c) ADC值为0.695×10-3mm/s2。 图4 患者,男,65岁,PSA为 4.56ng/mL,前列腺基底部右侧外周带右后部癌灶(箭),根治术后病理结果示Gleason=9分。a) D值为0.888×10-3mm/s2;b) K值为0.839;c) ADC值为0.534×10-3mm/s2。
讨 论
前列腺癌是欧美国家男性常见的肿瘤,随着我国老年化趋势的加重,前列腺癌的发病率在我国也呈增高趋势[6]。单独使用T2WI诊断PCa的灵敏度为54%~96%,特异度为21%~91%[7],各文献报道差异较大。通过测量DWI参数值能够对组织结构和细胞特性进行定量分析,增加PCa诊断的一致性及可重复性。PI-RADS V2.1指南中对单指数模型的DWI提出最佳b值≥1400 s/mm2,但并没有明确最高b值范围。
2005年Jensen等[5]基于扩散张量成像(diffusion tensor imaging,DTI)技术,提出了DKI技术。DKI以非高斯分布模型为基础,对组织微结构变化更加敏感,常用指标K用来定量扩散偏离高斯分布的程度,K值越高,代表了水扩散偏离高斯分布越明显,组织微结构越复杂;D为经非高斯分布校正过的表观扩散系数。与单指数模型相比,DKI更好地拟合了水分子的非高斯扩散行为,特别是在高b值的情况下,能更精准地将偏离高斯分布的扩散转化为足够的DWI信号,对于肿瘤的良恶性鉴别、恶性肿瘤分级和预后判断或预测都起着重要作用[8,9]。通常体部应用DKI至少需要3个b值,最高b值需>2000 s/mm2。然而在前列腺癌研究中,少有文献使用b值高于3000 s/mm2的DKI模型进行临床疾病研究。本研究采用7个b值(0、400、800、1200、2000、3000、4000 s/mm2)获取DKI参数图像,最高b值为4000 s/mm2,希望能更好地实现非高斯分布模型下的DWI信号拟合,提高DWI临床诊断价值。
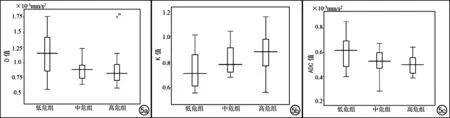
图5 不同Gleason评分组(低危组、中危组及高危组)的D、K及ADC3000值箱式统计图。a) D值随着Gleason评分的增高而递减;b) K值随着Gleason评分的增高而递增;c) ADC3000值随着Gleason评分的增高而递减。
既往研究显示DKI模型对于PCa有较高的诊断效能。无论外周带或移行带PCa,D及K值均能较好反映PCa肿瘤细胞的不均质性及环境结构的复杂性。外周带或移行带区PCa的K值明显高于非癌区(良性外周带或BPH),但相比ADC及D值,其诊断效能最低。Tamada等[10]研究显示,在对前列腺癌与良性肿瘤的鉴别诊断中,K值的诊断效能(AUC=0.902)低于ADC值(AUC=0.921)。Wang等[1]研究显示,K值对前列腺癌的鉴别诊断效能低于ADC(AUC分别为0.947和0.978,P<0.001)。Li等[11]研究显示,对于前列腺癌的鉴别诊断,K值优于ADC值,但该研究采用10个b值,且最高b=1000 s/mm2,其中6个b值小于200 s/mm2。Hoeks等[12]研究显示,相对T2WI,T2WI联合DWI (b=800 s/mm2) 序列并不能显著提高移行带PCa的诊断效能。当b≥1000 s/mm2时,DWI联合T2WI对于前列腺癌的诊断符合率明显提高[8,13,14],且PI-RADS v2中推荐使用“高b值”,b值需≥1400 s/mm2[15,16]。张琨等[16]研究发现,超高b值(2000、3000 s/mm2)DWI诊断前列腺癌的灵敏度、特异度及ROC曲线下面积均高于常规b值。考虑到诊断效能及图像信噪比,本研究中单指数模型选取b=3000 s/mm2获得ADC值作为对照,DKI模型b值最高取4000 s/mm2,结果显示DKI (D+K)对于外周带或移行带PCa的鉴别诊断效能与ADC3000值相比差异无统计学意义,与既往文献相符[1,2,10,17]。
Gleason评分系统是前列腺癌病理检查中最常用的分级系统,其Gleason评分的高低与患者治疗和预后有明显相关性。Gleason评分为6分的PCa为低风险肿瘤,Gleason评分为7分的前列腺癌患者的生物学表现不完全相同,3+4分和4+3分患者有明显不同的预后。Gleason评分3+4的患者术后生化复发率与6分患者近似,而含Gleason 5级成分的患者根治术后肿瘤生化复发风险均显著增加。所以本文将前列腺癌Gleason评分分为低危组、中危组及高危组,利用DWI参数进行鉴别。相关文献显示ADC值对于鉴别不同级别前列腺癌具有重要临床价值,表明DWI参数可用于评估前列腺癌肿瘤组织侵袭性及预后[4,18-22]。本研究结果显示,低危组的平均D及ADC3000值最高,与中危组及高危组相比差异均有统计学意义。低危组的K值最低,显著低于高危组,差异有统计学意义,而与中危组相比差异无统计学意义。DWI模型各参数均不能有效区分中、高危组PCa。Wang等[1]研究显示,对前列腺癌肿瘤分级,K的AUC低于ADC值,差异有统计学意义(分别为0.689 和0.894,P=0.008)。Rosenkrantz等[23]采用最高b值2000 s/mm2,显示K值鉴别高、低危组PCa的敏感度高于ADC值与 D值(分别为68.6%、51.0%和49.0%),特异度低于ADC值和D值(分别为70.0%、81.4%和82.9%)。不同DWI参数的应用,影响DKI模型诊断效能的一致性。
本研究存在以下局限性:本研究中病理结果部分为穿刺活检证实,与最终Gleason评分存在差异,但PCa癌灶的选取密切结合穿刺部位,由两位有10年以上工作经验的医师共同完成,且每例前列腺癌患者仅选取1个侵袭性最强或体积最大的病灶作为感兴趣区。
综上所述,当b值最高为4000 s/mm2时,非高斯分布DKI模型可用于PCa的鉴别诊断及肿瘤分级;相比ADC3000,DKI模型尚不能提供更多的临床诊断信息。

