维生素B12早期干预影响海马神经元DNA甲基化和抗β淀粉样蛋白神经毒性作用
刘乃榕,李景辉,任刚,李晶,詹杰
阿尔茨海默病(Alzheimer disease,AD)是一种中枢神经神经系统退行性疾病。临床以进行性记忆及认知障碍,伴精神及行为异常为主要特征,目前病因迄今未明,尚无有效治疗手段[1],是影响全球公共健康的重大问题[2]。目前已知AD具有两大病理特征,β淀粉样蛋白(amyloid-β,Aβ)沉积形成的细胞炎斑和tau蛋白过度磷酸化形成神经细胞内神经原纤维缠结,典型的细胞炎斑核心是Aβ,Aβ沉积被认为是AD始发因素。研究发现AD具有高度遗传性,目前全基因组关联研究已发现20多个AD风险基因。营养作为细胞分裂、增殖和代谢的物质条件,伴随着生命从孕育到终结的全过程。相对于遗传学缺陷,表观遗传性疾病有可能通过生命早期的营养干预而发生逆转,影响AD风险基因的表达。
研究显示,成人体内缺乏B12可引起血浆Hcy浓度升高,导致AD发生。本试验以维生素B12不同剂量对新生大鼠海马神经元进行早期干预,对比观察维生素B12早期干预对DNA甲基化以及海马神经元成熟后对Aβ毒性作用的反应,从细胞水平分析生命早期补充维生素B12对AD发病的保护机制。
1 材料与方法
1.1 实验动物 健康SPF级SD大鼠20只(雌鼠15只,雄鼠5只),体质量300~350 g,由辽宁长生生物技术有限公司提供[许可证编号:SCXK(沪)2012-0002]。
1.2 实验药品及试剂 维生素B12(Sigma公司);脱氧胞苷(deoxycytidine,dC)标准品、5-甲基脱氧胞苷(5-methyl-deoxycytidine,5-mdC)标准品;Aβ1-42、rat TFA(MCE);AnnexinⅤ/PI凋亡试剂盒(达科为);DNA提取试剂盒、蛋白质定量试剂盒(BCA法,天根);四甲基偶氮唑盐(3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT)(Amresco公司);丙二醛试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-PX)试剂盒(南京建成生物公司)。
1.3 主要仪器及设备 高效液相色谱仪(安捷伦8650)、酶标仪(上海三科318C);分光光度计(analytikjena公司SPECORD 210);CO2培养箱(Thermo HERAcell vios 160i);荧光倒置显微镜(卡尔蔡司Axio Vert.Al);全自动流式细胞仪(BECKMAN COULTER CytoFLEX);超声细胞破碎仪(宁波新芝)。
1.4 实验方法
1.4.1 新生大鼠海马神经元细胞(hippocampal neuron cells,HNCs)培养[3-4]和分组 新生大鼠出生12 h内取海马组织,去除血管、筋膜等海马无关组织,0.125%胰酶消化,吸管反复轻柔吹打至吹散细胞,37 ℃培养箱内消化25 min,加入含血清的全培养液终止消化,200目尼龙筛过滤,1 000 r/min离心10 min去上清,含10%血清的高糖DMEM培养液吹散细胞制成细胞悬液,计数细胞密度,调整细胞密度为2×106个/mL,接种于涂布10%赖氨酸的培养瓶中。每窝HNCs细胞随机分为5组,即空白组、模型组、维生素B12低剂量组(200 μg/L)、中剂量组(400 μg/L)、高剂量组(600 μg/L),添加干预因素后,置37 ℃ 5%CO2培养箱内培养24 h,换添加不同浓度维生素B12的无血清B27培养液继续培养48 h。此后每隔2~3天换液1次,每次无干预因素的空白B27培养液半量换液。培养期间,每天在倒置显微镜下观察神经元生长状况。培养7 d左右,可见HNCs细胞形成突触。
1.4.2 高效液相法测定 各组HNCs细胞DNA甲基化水平按DNA提取试剂盒说明书进行DNA提取,分光光度计法测定DNA浓度,DNA浓度满足HPLC测定需求后,HPLC法测定基因组DNA甲基化水平[5-6]。色谱柱:Ultimate Polar-RP(4.6 mm×250.0 mm,5 μm);流动相:0.2%(体积分数)磷酸;流速:1.3 mL/min;检测波长273 nm;进样量20 μL。分别配制5种浓度(1.0、2.0、5.0、10.0、20.0 mg/L)的dC和5-mdC标准品溶液,用于绘制标准曲线。根据标准曲线计算样品色谱图中2种脱氧核苷峰面积对应的浓度(分别记为CdC和C5-mdC),则样品基因组DNA的整体甲基化水平(%)=100×C5-mdC/(C5-mdC+CdC)。
1.4.3 Aβ1-42熟化及细胞损伤模型的建立[7]Aβ1-42用无菌磷酸盐缓冲液配制成2×103μmol/L的Aβ原液,37 ℃孵育5 d成纤维状,-20 ℃保存备用。各组HNCs细胞培养至细胞元细胞形成突触。模型组及各剂量干预组换成含5 μmol/L熟化Aβ的B27培养液造模,继续培养24 h,倒置显微镜下观察神经元生长状况。
1.4.4 MTT比色分析法 计算细胞增殖率新生大鼠HNCs 96孔板培养,分组、维生素B12添加及Aβ染毒造模方法同前,MTT比色分析,酶联免疫检测仪OD 490 nm处测量各孔的吸光值,计算细胞增殖率。细胞增殖率(%)=A实验组/A对照组×100%。
1.4.5 流式细胞术检测细胞凋亡率 各组HNCs细胞胰酶消化,FITC-AnnexinV/PI双荧光标记,上流式细胞仪检测细胞凋亡率。FlowJo软件分析结果,结果以凋亡细胞的百分率表示。细胞凋亡率=晚期细胞凋亡率+早期细胞凋亡率。
1.4.6 氧化应激指标测定 收集各组HNCs培养液,按试剂盒使用说明操作,用硫代巴比妥酸法测定丙二醛含量,比色法测定GSH-PX活力。
各组HNCs细胞胰酶消化,冰水浴条件下超声细胞破碎,功率300 W,每次超声3~5 s,间隔30 s,重复4~5次,黄嘌呤氧化酶法按试剂盒使用说明测定SOD活性。
1.5 统计学方法 采用SPSS 16.0软件包对各组变量值做方差分析和组间差异显著性分析,P<0.05为差异有统计学意义。
2 结果
2.1 维生素B12早期干预对新生大鼠HNCs细胞DNA甲基化的影响及不同处理比较 见表1。

表1 维生素B12早期干预对HNCs细胞DNA甲基化的影响
由表1结果可知,新生大鼠HNCs细胞出生12 h内进行维生素B12低、中、高剂量干预后DNA甲基化水平较空白组均有降低,其中低、中剂量组低于空白组,差异有统计学意义(P<0.01)。
2.2 维生素B12早期干预对Aβ染毒HNCs细胞增殖率的影响 见表2。

表2 维生素B12早期干预对HNCs细胞增殖率的影响
图2结果显示,Aβ染毒24 h后,模型组与空白组比较细胞增殖率显著下降(P<0.01),与模型组对比观察可知,维生素B12早期干预组HNCs细胞Aβ染毒24 h后,各组细胞增殖率水平与模型组比较均有提高,差异有统计学意义(P<0.01)。
2.3 维生素B12早期干预对Aβ染毒HNCs细胞凋亡的影响 见图1。
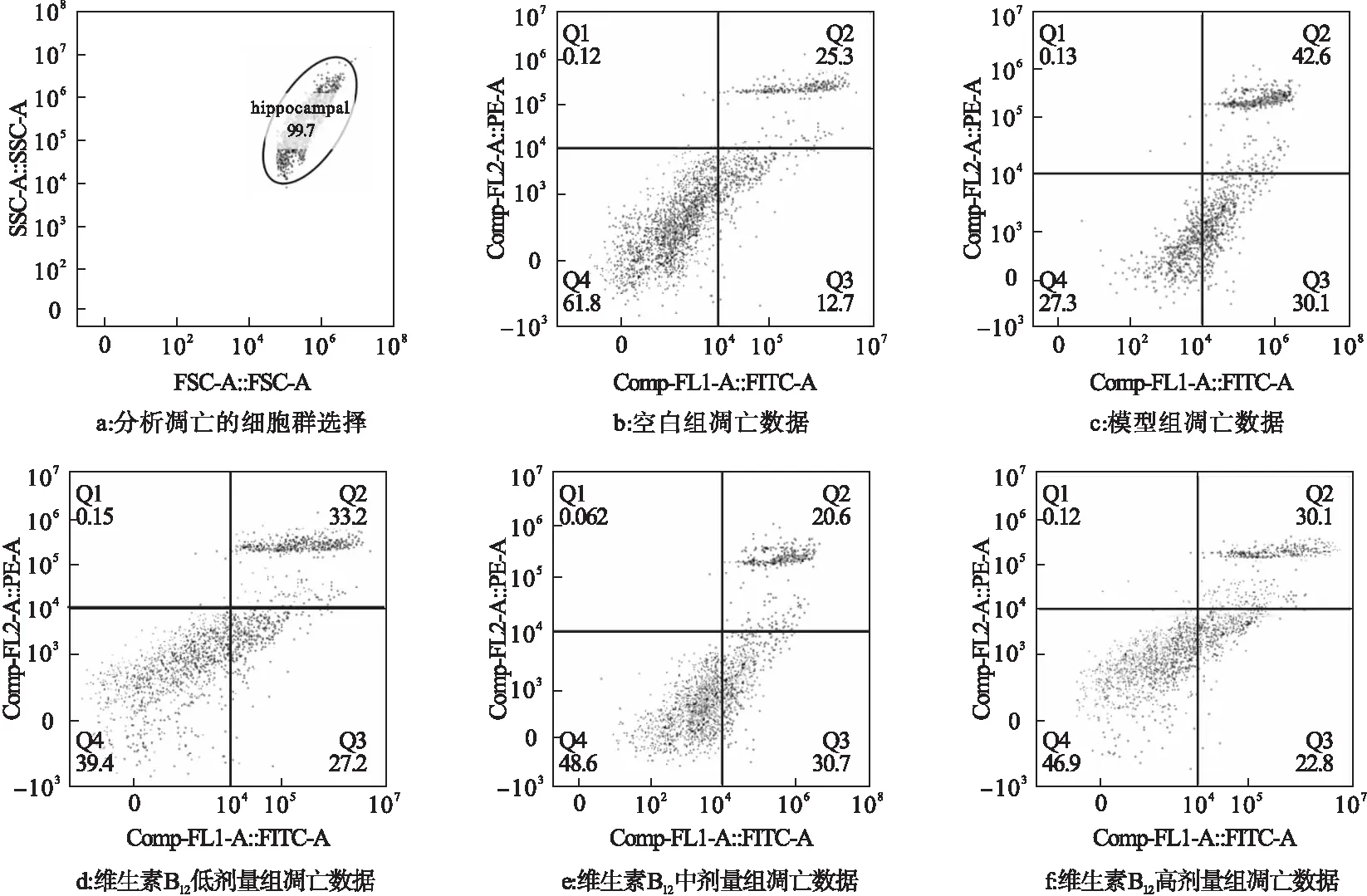
注:Q1:坏死细胞;Q2:晚期凋亡细胞;Q3:早期凋亡细胞;Q4:活细胞
图1结果显示,Aβ染毒24 h后,模型组细胞早期凋亡细胞和晚期凋亡细胞数均明显增多,细胞凋亡率明显高于空白组(72.7%vs38.0%),差异有统计学意义(P<0.05)。
维生素B12干预各组与模型组比较细胞凋亡率均有降低,分别为60.4%、51.3%、52.9%,差异有统计学意义(P<0.05)。
2.4 维生素B12早期干预对Aβ染毒HNCs细胞抗氧化能力的影响 见表3。
表3 维生素B12早期干预对Aβ染毒HNCs细胞抗氧化能力的影响
表3结果显示,Aβ染毒24 h后,模型组HNCs的丙二醛较空白组明显增高,差异有统计学意义(P<0.05),维生素B12干预各组均可显著减少Aβ染毒后HNCs的丙二醛含量,差异有统计学意义(P<0.05)。
Aβ染毒24 h后,模型组SOD活性明显低于空白组,差异有统计学意义(P<0.05);维生素B12干预各组Aβ染毒后HNCs的SOD活力较模型组均有提高,其中低剂量组与模型组差异有统计学意义(P<0.05)。
Aβ染毒24 h后,模型组GSH-Px活性明显低于空白组,差异有统计学意义(P<0.05);维生素B12干预各组Aβ染毒后HNCs的GSH-Px活性较模型组均有提高,差异有统计学意义(P<0.05)。
3 讨论
AD是老年人认知障碍症最主要的类型之一,是一个全球性的健康问题,给社会和家庭带来了沉重负担。该病至今病因和发病机制未明,尚无公认有效的治疗方法,目前已知AD具有两大病理特征,Aβ沉积形成的细胞炎斑和tau蛋白过度磷酸化形成神经细胞内神经原纤维缠结[7]。Aβ学说认为AD的发病机制是多种基因变异,导致Aβ淀粉样沉淀,形成神经炎斑,逐渐损伤突触及神经细胞,导致神经细胞内钙离子增高,脑内蛋白酪氨酸激酶活化,tau蛋白过度磷酸化,与神经细胞微管蛋白缠结;Aβ同时损伤线粒体膜,影响神经细胞能量代谢和乙酰胆碱的合成与释放,导致神经兴奋传递减慢,神经细胞功能丧失,临床出现记忆障碍,甚至痴呆症状。Aβ1-42是人体内最常见的Aβ亚型之一,具有更强的毒性,且更容易聚集,形成Aβ沉淀的核心,引发神经毒性作用。研究结果显示,成熟的HNCs体外培养加入5 μmol/L的Aβ1-42染毒24 h可造成HNCs细胞增殖率降低,细胞凋亡率升高,丙二醛含量增高,SOD活性和GSH-PX活性下降,证明Aβ1-42导致HNCs的自由基损伤增加,同时诱导HNCs发生细胞凋亡,加速HNCs退行性损伤。
充足的营养对正常的大脑结构和功能至关重要,尤其是妊娠期及婴幼儿时期的营养为大脑的形成奠定了物质基础,甚至影响整个生命周期的认知、运动、语言和情绪等大脑功能[8-9]。维生素B12(钴胺素)主要参与一碳单位循环,在机体同型半胱氨酸合成蛋氨酸的转甲基反应过程中扮演着重要角色。现代研究显示,该药物能够有效促进机体神经系统中神经元髓鞘及卵磷脂的形成,从而对轴突再生、促进神经生长产生较强的刺激。此外,该药物分子还能够转移到神经细胞的细胞器中,增加神经递质的代谢活性,从而改善神经组织代谢障碍及传递作用。成人体内缺乏B12可引起血浆Hcy浓度升高,导致AD发生,通过科学补充可抑制脑缺血神经细胞凋亡,抑制自由基产生和脂质过氧化反应,降低脑神经损害[10-11]。
本研究结果显示,维生素B12作用于出生12 h内的大鼠海马神经元,可降低神经元细胞的甲基化水平,发挥表观遗传学调节作用,其影响可一直持续,并在成熟期HNCs对抗Aβ神经毒性作用中继续发挥调节作用,参与神经元细胞氧化应激,减少脂质过氧化物的产生,保护细胞膜的结构及功能不受过氧化物的干扰和损害,促进细胞增殖,减缓神经细胞凋亡,从而可能在预防AD方面发挥有益效应。维生素B12安全性研究中人群资料显示人体摄入维生素B12后的毒性很低,目前尚无维生素B12毒性反应及生殖与发育毒性的报道,也为其在生命早期干预达到AD预防作用提供了可能。

