奶牛Klf4基因CDS区和3′UTR的克隆及生物信息学分析
徐 萍, 赵 俭, 姚竞杰, Fotina Tetiana, 王三虎, 张晓建
(1.河南科技学院动物科技学院,河南 新乡 453003;2.新乡学院生命科学与基础医学学院,河南 新乡 453003;3.乌克兰苏梅国立农业大学兽医学院,乌克兰 苏梅 40021;4.河南卢师傅食品有限公司,河南 商丘 476600)
奶牛乳腺炎是由病原微生物感染、理化因素刺激或者奶牛自身遗传等因素引起的一种常见的乳腺综合征疾病,它不仅可导致奶牛产奶量下降,也可由于治疗时化学药物或抗生素残留等原因造成乳制品质量降低,甚至危及人类健康[1].Krüppel样因子(Krüppel-like factor, KLF)是锌指蛋白类转录因子,在人类组织中广泛表达.KLF于1996年由Shields et al[2]在小鼠中发现,因与黑腹果蝇的分节蛋白Krüppel的DNA结合序列具有同源性而得名.Krüppel样因子4(Krüppel-like factors 4, KLF4)属于KLF蛋白家族一员,是一种具有结合位点特异性真核生物锌指蛋白转录因子,参与调控细胞增殖和分化、胚胎发育,抑制和促进肿瘤发展,参与骨骼分化等重要生命过程,是体细胞重编程为诱导多能干细胞(iPS细胞)的重要诱导因子之一[3-6].在癌症病情继续发展期间,KLF4可以作为肿瘤启动子或者抑制剂起作用,这取决于癌症类型和细胞标记[7].研究表明,KLF4可单独或者与其他信号途径协同调节多种细胞因子的表达,在炎性反应中发挥重要作用[8-9].KLF4在巨噬细胞中具有促进和抑制炎症的作用.冯衍生等[10]研究表明,KLF4在小鼠RAW264.7细胞的脓毒症中显著抑制IL-6启动子的转录活性,从而通过显著降低IL-6的表达抑制细胞的炎症反应.Wt鼠在移植KLF4缺乏细胞血液中单核细胞较前减少,血液和脾脏中炎性单核细胞完全缺乏,证明KLF4是炎性单核细胞分化不可缺少的分子[11];同时,KLF4在神经系统[12-13]、心血管系统[14-15]、泌尿系统[16-17]、呼吸系统[18-19]、消化系统[20-21]和皮肤系统[22-24]疾病中均可抑制炎症反应.KLF4作为KLF家族中的一员,在体内多种细胞和组织中均有表达;从炎症反应的角度看,KLF4可作用于不同信号通路,既可抗感染,又可促炎症.而Klf4基因在奶牛乳腺炎中的作用目前尚未见报道.
本研究通过对奶牛Klf4基因CDS区和3′UTR序列的克隆、表达载体的构建,并通过不同物种同源性比对和系统进化树构建分析Klf4基因遗传进化特性,最后对Klf4基因编码蛋白的特性进行生物信息学分析,以期为进一步研究Klf4基因在奶牛乳腺炎中的作用提供参考.
1 材料与方法
1.1 材料
1.1.1 样本 选取3岁左右、健康的中国荷斯坦奶牛3头,采集其乳腺组织并迅速保存于液氮中备用.
1.1.2 试剂 PrimeScriptTMRT Master Mix、PrimeScriptTMRT reagent Kit with gDNA Eraser、TB Green®Premix Ex TaqTMⅡ、pMD18-T载体、限制性内切酶、T4连接酶购于宝生物工程(大连)有限公司;大肠杆菌DH5α感受态细胞购于北京全式金生物有限公司;胶回收试剂盒、质粒提取试剂盒购于OMEGA公司;RNA提取试剂盒购于北京百泰克生物技术有限公司;PMIR-REPORTTM载体由河南科技学院动物科技学院实验室保存.
1.2 方法
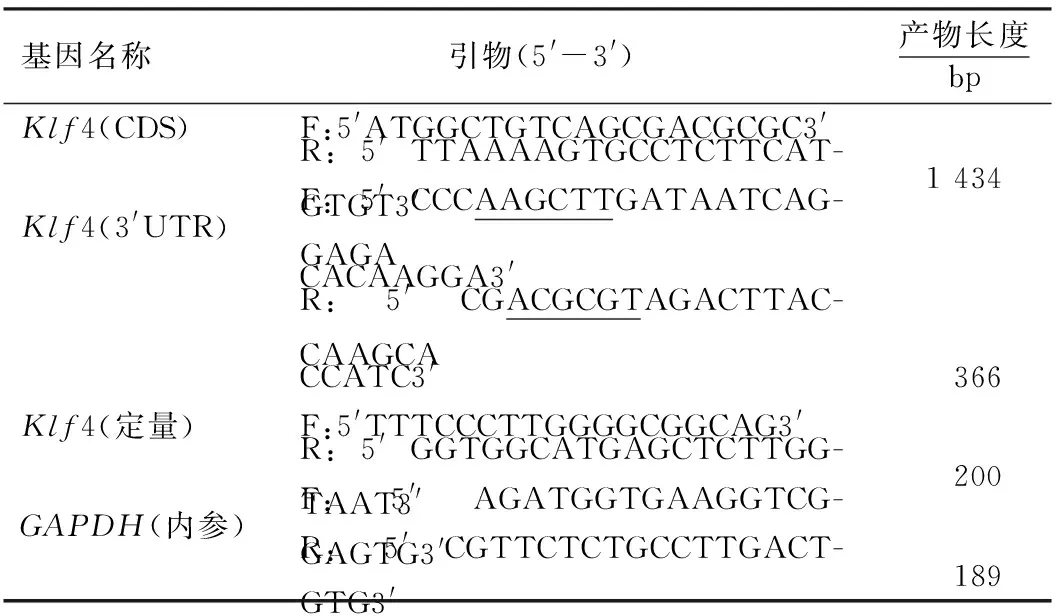
表1 Klf4基因的扩增及定量引物序列1)Table 1 Amplification and quantitative primer sequences of the Klf4 gene
1.2.1 引物的设计与合成 根据NCBI数据库中牛的Klf4基因序列,结合NCBI的Primer-blast功能和Primer 6.0软件进行引物设计,引物序列如表1所示.引物交由上海生工生物工程股份有限公司合成.
1.2.2 总RNA的提取与cDNA的合成 参照百泰克RNA提取试剂盒说明书从乳腺组织中提取总RNA,采用琼脂糖凝胶电泳和NanoDrop检测RNA的纯度和浓度.参考RT-PCR试剂盒说明书进行反转录合成cDNA.
1.2.3Klf4基因CDS区的克隆Klf4基因的PCR反应条件为:95 ℃,2 min;95 ℃,30 s;62 ℃,30 s;72 ℃,60 s;72 ℃,10 min;4 ℃保存.PCR产物经1%琼脂糖凝胶电泳,用凝胶回收试剂盒回收浓度较高的特异性条带,与pMD18-T载体连接、转化.挑取阳性单克隆菌落测序.
1.2.4Klf4基因3′UTR的扩增及PMIR-Klf4-3′UTR重组质粒的构建 PCR反应条件为:95 ℃,2 min;95 ℃,30 s;63.4 ℃,30 s;72 ℃,30 s;72 ℃,10 min;4 ℃保存.PCR产物经1%琼脂糖凝胶电泳,用凝胶回收试剂盒回收.将回收得到的目的条带与PMIR-REPORTTM载体分别用限制性内切酶HindⅢ和MluⅠ酶切后,经T4连接酶连接、转化.挑取阳性单克隆菌落测序.
1.2.5 生物信息学分析 利用NCBI获取不同物种的Klf4基因序列,并使用DNAstar、Mega 6.0软件计算奶牛与不同物种间的遗传距离、同源性以及进化树的构建;使用ProtParam软件预测基因编码蛋白的理化性质;使用ProtScale软件进行亲/疏水性分析;利用Net Phos 3.1、PSORTⅡ和TargetP 1.1软件进行磷酸化位点和亚细胞定位分析;利用SignalP-4.1软件的Sever程序进行蛋白信号肽预测;利用SOPMA和SWISS-MODEL软件预测蛋白的二级结构和三级结构.
2 结果与分析
2.1 Klf4基因CDS区的克隆
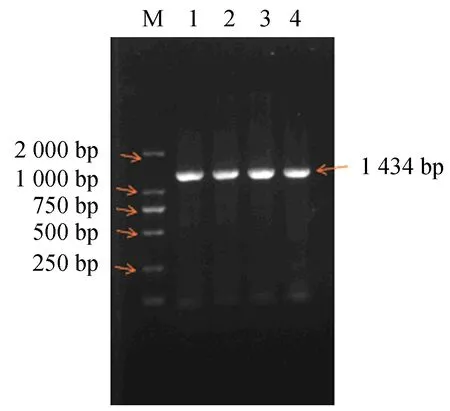
M:DL2000 marker;1~4:样品扩增产物.图1 Klf4基因CDS区的扩增电泳图谱Fig.1 PCR amplification electrophoresis product of the Klf4 gene CDS
Klf4基因CDS区的扩增结果如图1所示.结果显示检测到长度为1 400 bp左右的目的条带,条带明亮清晰,且与预期大小一致.测序结果经比对,显示与NCBI中牛的Klf4基因序列一致.
2.2 Klf4基因3′UTR的扩增
Klf4基因3′UTR的扩增结果如图2所示.结果显示检测到长度为366 bp的目的条带,片段大小符合预期结果.利用限制性内切酶对重组质粒进行双酶切,得到长度分别为366和6 470 bp大小的两条带,与预期一致.
2.3 Klf4基因及蛋白序列的生物信息学分析
2.3.1 同源性分析和进化树的构建 牛Klf4基因与兔、山羊、斑马鱼、人、小鼠、野猪、绵羊、大鼠的同源性分别为92.9%、98.5%、54.9%、82.8%、88.4%、94.7%、98.3%、88.6%(图3).基于KLF4氨基酸序列同源性构建的系统发育进化树(图4)显示,牛Klf4基因与山羊、绵羊的亲缘性最近,达到98%以上,然后是猪,最后是斑马鱼.

A:扩增(M为DL2000 marker;1~3为样品扩增产物);B:酶切(M为DL5000 marker;1为PMIR-Klf4-3′UTR质粒双酶切产物).图2 Klf4基因3′UTR的扩增和酶切电泳图谱Fig.2 Amplification and digestion products of the Klf4 gene 3′UTR
2.3.2 氨基酸的理化性质 采用ProtParam软件对奶牛Klf4基因所编码氨基酸序列的理化性质进行分析.结果显示,KLF4氨基酸序列由477个氨基酸组成,其分子质量为50 759.17 u,分子式为C2231H3458N652O669S20,总原子数为7 030.带正负电荷的残基数分别为48个(精氨酸+赖氨酸)和41个(天冬氨酸+谷氨酸),理论等电点(pI)为8.76,偏碱性.预测不稳定系数为69.28,说明Klf4基因编码蛋白的理化性质是不稳定的,理论半衰期在哺乳动物网织红细胞体外为30 h,而在酵母的体内则需要大于20 h,在大肠杆菌的体内则需要大于10 h.由于其脂肪系数为59.39,总平均亲水系数(GRAVY)为-0.550,说明该蛋白属于亲水性蛋白,与ProtScale软件分析结果一致(图5).而在组成牛Klf4基因编码氨基酸的20种氨基酸中,脯氨酸的含量最多,其比例为13.6%(表2).
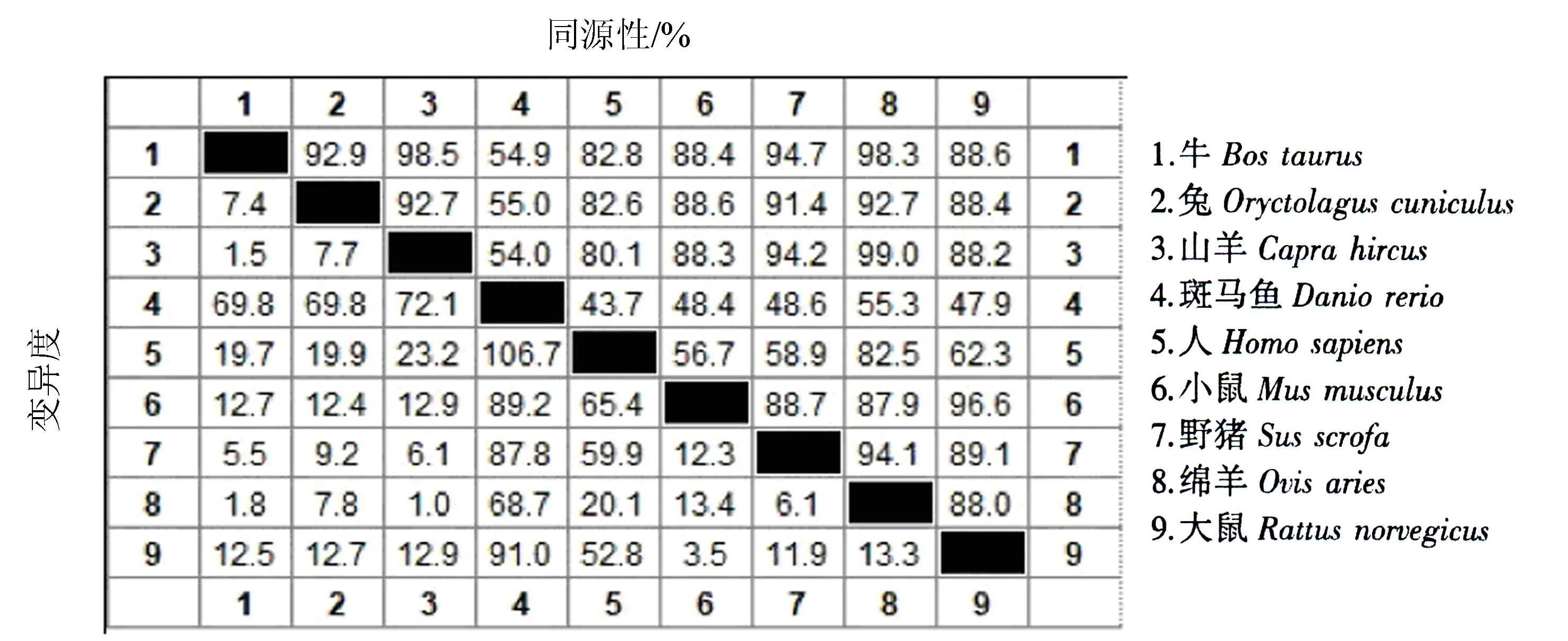
图3 不同物种Klf4基因的同源性比对结果Fig.3 Homology comparison of Klf4 gene sequence from different species
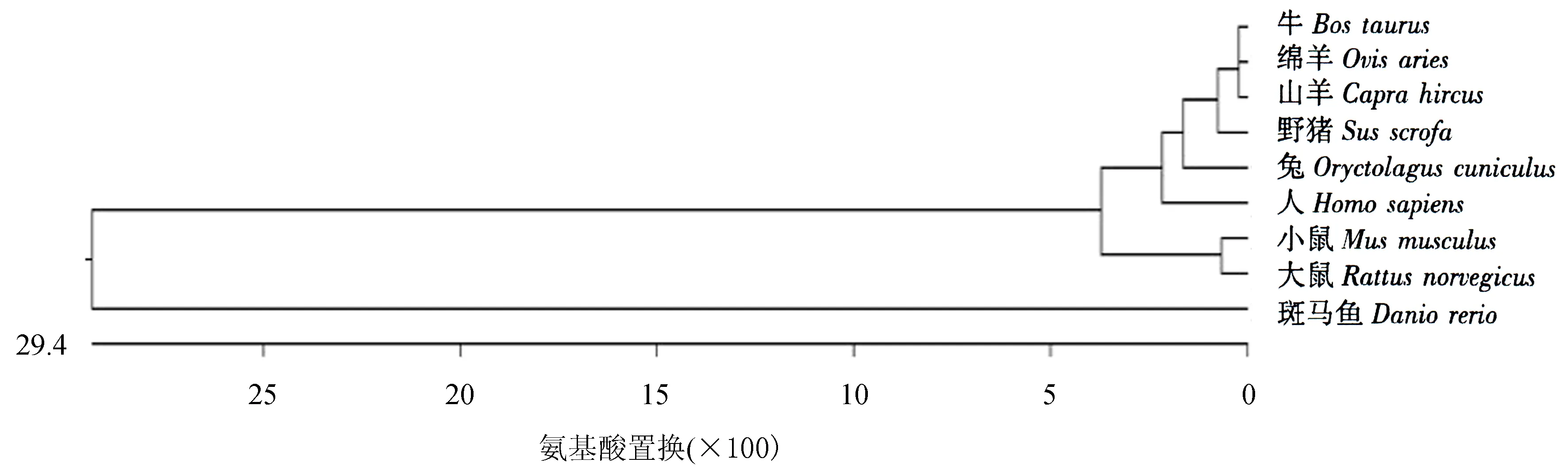
图4 基于KLF4氨基酸序列同源性构建的系统发育进化树Fig.4 Phylogenetic tree based on KLF4 amino acid sequence homology
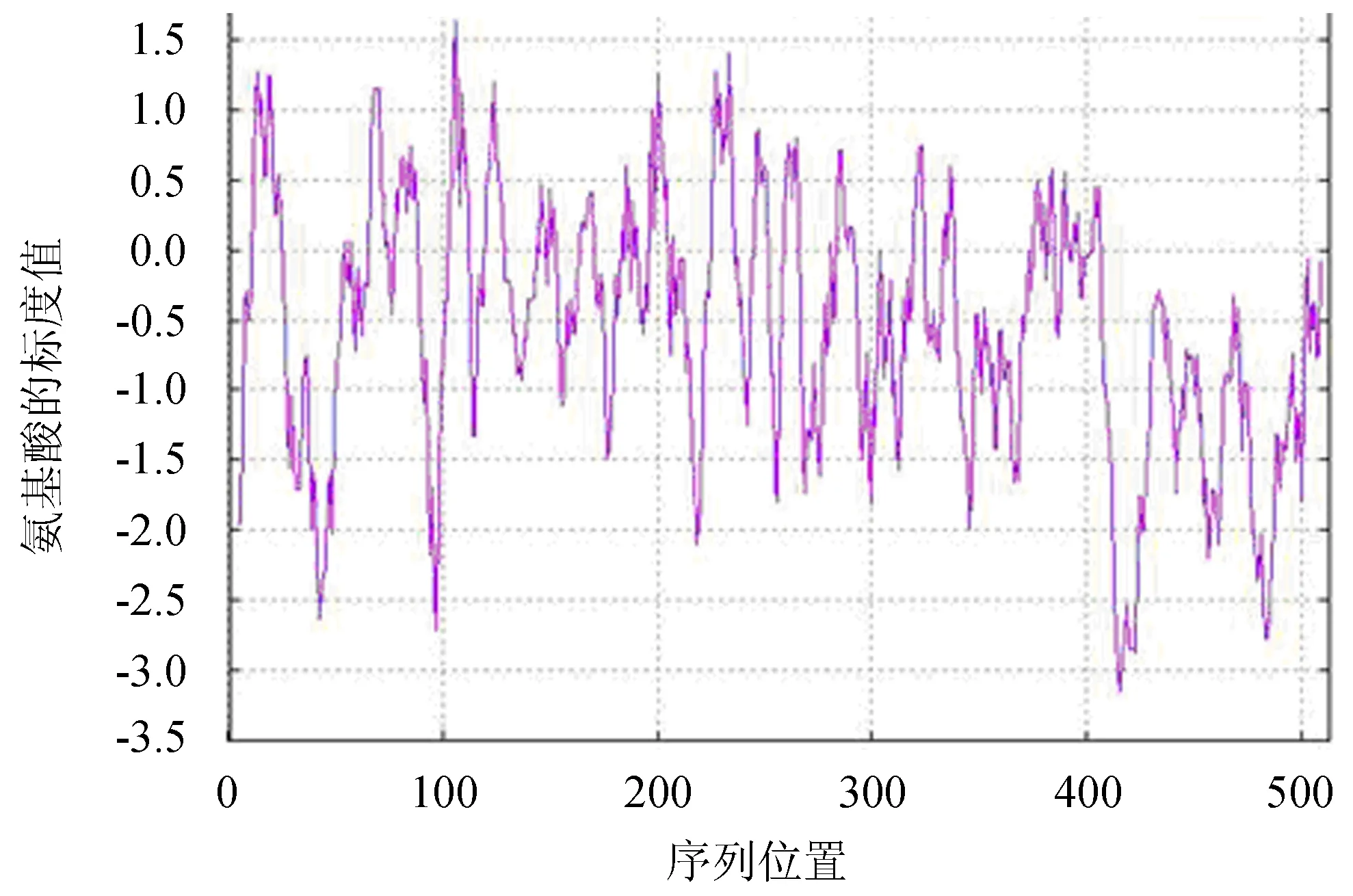
图5 奶牛KLF4蛋白亲/疏水性Fig.5 Hydrophilicity and hydrophobicity analysis of KLF4 protein in dairy cow
2.3.3 磷酸化位点、亚细胞定位和信号肽 利用Net Phos 3.1软件预测Klf4基因编码氨基酸序列的潜在磷酸化位点,其中可能存在56个磷酸化位点,包含16个苏氨酸磷酸化位点、37个丝氨酸磷酸化位点、3个酪氨酸磷酸化位点(图6).奶牛KLF4蛋白亚细胞定位的预测采用TargetP 1.1和PSORTⅡ软件,结果显示线粒体作用位点(mTP)占21.3%,分泌信号通路位点(SP)占12.3%,无信号肽的存在,说明KLF4蛋白不属于分泌型蛋白,且分布于细胞核,可能在396、426、456位点处存在锌指结构域(表3),这与KLF蛋白家族的特性相一致.通过SignalP-4.1软件的Sever程序分析KLF4蛋白的信号肽,结果显示KLF4蛋白不存在信号肽.

表2 奶牛KLF4氨基酸组成成分Table 2 Amino acid composition of KLF4 protein in dairy cow
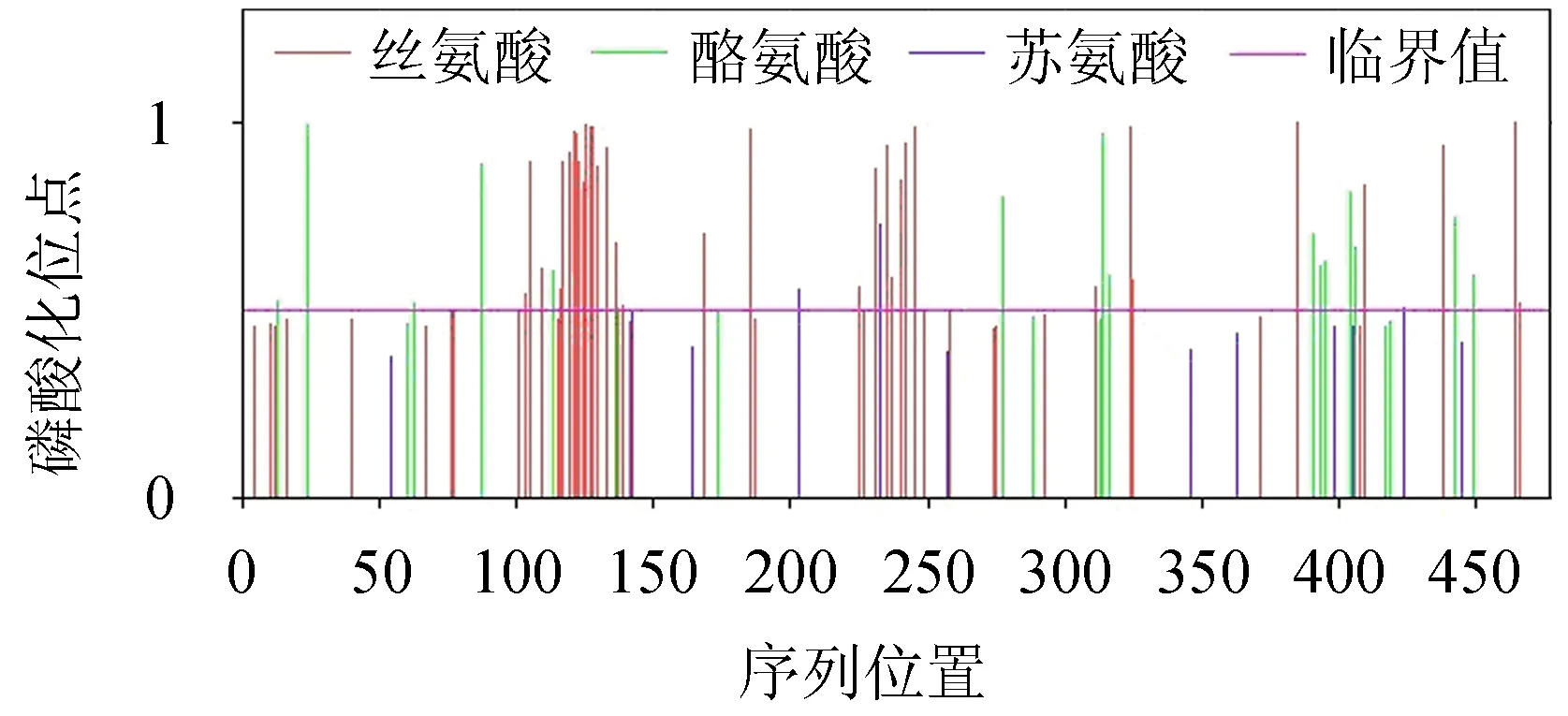
图6 奶牛KLF4蛋白磷酸化位点Fig.6 The prediction of phosphorylation site of KLF4 protein in dairy cow

表3 奶牛KLF4蛋白亚细胞定位Table 3 Subcellular localization of KLF4 protein in dairy cow
2.3.4 二级结构和三级结构预测 牛KLF4蛋白的二级结构采用SOPMA软件预测,结果显示,α-螺旋占18.03%,无规则卷曲占68.76%,β-转角占3.98%,延伸链占9.22%(图7).KLF4蛋白的三级结构与二级结构一致(图8).

字母“c”和紫色短竖线表示无规则卷曲;字母“h”和蓝色长竖线表示α-螺旋;字母“e”和红色中长竖线表示延伸链;字母“t”和绿色中短竖线表示β-转角.图7 奶牛KLF4蛋白二级结构的预测结果Fig.7 The prediction of secondary structure of KLF4 protein in dairy cow
3 讨论
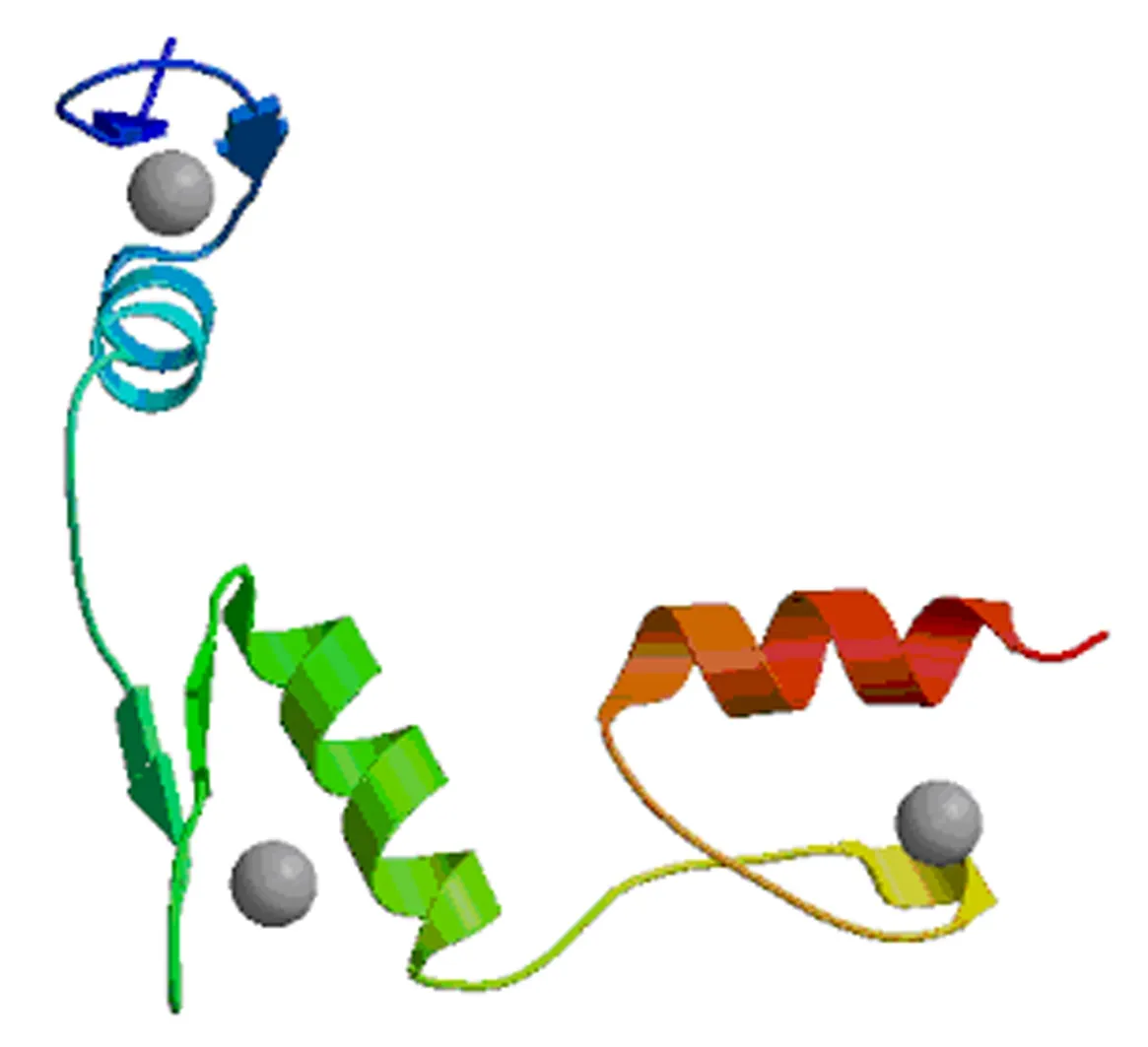
图8 奶牛KLF4蛋白三级结构的预测结果Fig.8 The prediction of tertiary structure of KLF4 protein in dairy cow
奶牛乳腺炎是影响奶牛养殖业的主要疾病,不仅降低了奶牛的产奶量,同时造成了乳制品质量的下降[1].尽管国内外学者在生理学、生物学和遗传学等多学科上做了大量研究,取得了大量进展,但奶牛乳腺炎致病机制中仍有许多生物学机制亟待研究.近年来的研究显示,miRNA在固有免疫、病原体感染与免疫以及炎症免疫调控中具有十分重要的作用[25-26].miRNA通过与其种子序列互补配对的靶基因结合,引起靶基因mRNA的降解或抑制其翻译,从而在转录后水平调控基因的表达.奶牛miRNA与其靶基因互作在奶牛乳腺炎中的分子机制是近期研究乳腺炎致病机制的重要方法.KLF4是一种具有结合位点特异性真核生物锌指蛋白转录因子,属于KLF蛋白家族一员,具备KLF蛋白家族的结构特性.在人乳腺癌细胞系中,Klf4基因敲除后乳腺癌细胞标志物明显减少,乳腺癌细胞增殖、迁移及裸鼠成瘤均受到明显抑制,说明Klf4基因可以促进乳腺癌细胞的生长、迁移和浸润[27].为探究Klf4基因在奶牛乳腺炎中靶向调控miRNA的作用,本研究通过扩增Klf4基因3′UTR区域,获得长度为366 bp的目的片段,并构建PMIR-REPORTTM-Klf4重组质粒,为研究其互补配对miRNA之间的作用提供参考.
人Klf4基因定位于染色体9q31,覆盖6 300 bp的基因段,包含5个外显子,其开放式阅读框(ORF)长度为1 413 bp,编码470个氨基酸[28].将克隆的人Klf4基因全长序列与慢病毒载体pCDH连接,重组载体pCDH-Klf4转染人膀胱癌5637细胞,Klf4基因mRNA表达明显增高.通过在膀胱癌细胞系中过表达Klf4基因可以抑制肿瘤细胞的增长并促进凋亡,说明Klf4基因在膀胱肿瘤的形成和发展中具有抑制作用[29-30].而小鼠的Klf4基因定位于染色体4B3,编码483个氨基酸,小鼠与人的KLF4蛋白高度同源,在羧基端与人的KLF4有103个氨基酸残基完全一致.携带小鼠Klf4基因的重组慢病毒载体pLVX-Klf4转染RAW264.7细胞,Klf4基因的过表达促进了RAW264.7细胞的增殖[31].猪的Klf4基因位于染色体1q28~29处,编码区全长1 533 bp.对猪Klf4基因原核、真核和慢病毒表达载体的构建,主要用于验证Klf4基因在猪成脂分化和前脂肪细胞中的作用[32-34].为了研究大熊猫Klf4基因的结构和功能,近期吴宏娟等[35]通过RACE技术克隆了大熊猫Klf4基因,cDNA序列全长2 431 bp,其中,CDS区域长1 437 bp,编码479个氨基酸.与人、小鼠KLF4比较,大熊猫KLF4的N端少了9个氨基酸残基.利用RNA-seq技术研究Klf4基因在大熊猫MSCs中的调控作用,发现大熊猫Klf4基因在进化过程中相对保守,在细胞增殖、细胞凋亡、RNA转运和蛋白质生物过程中发挥重要的生理作用.研究表明,在乳腺癌中,Klf4基因通过减少snail(上皮间质化与转移的关键中介)的表达,从而抑制上皮—间质转化,进而抑制肿瘤的转移[36].Klf4基因在上皮—间质转化的过程中能够激活上皮基因的转录并且抑制间质基因的表达.Klf4基因在正常细胞、癌细胞、干细胞重编程及上皮—间质转化过程中发挥着重要作用.奶牛乳腺炎是炎症引起的乳腺上皮细胞的间质转化.Klf4基因在奶牛乳腺炎引起的乳腺上皮细胞间质转化中可能存在潜在的调控作用.
本研究成功克隆了牛Klf4基因,其CDS序列全长1 434 bp,编码477个氨基酸残基,定位于8号染色体.牛Klf4基因与人、小鼠、猪的Klf4基因的同源性分别为82.8%、88.4%和94.7%.在KLF4蛋白羧基端的DNA结合结构域含有3个连续的C2H2锌指结构,符合KLF蛋白家族锌指蛋白转录因子的结构特性[9].但牛的KLF4蛋白不存在跨膜结构,也无信号肽,存在较多个磷酸化位点.奶牛Klf4基因CDS区域的克隆为进一步构建表达载体、研究KLF4蛋白的表达在奶牛乳腺上皮细胞(BMEC)中的作用提供了参考.

