医用射线防护剂防治乳腺癌根治术后急性放射性皮肤损伤的疗效研究
韦淑贞 宋增 丁洁 沙晓锋
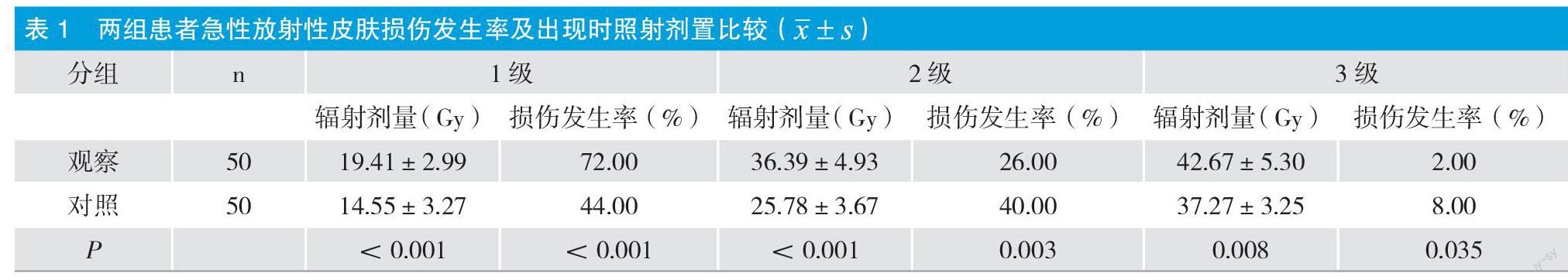
摘要:目的:观察医用射线防护剂在预防和治疗根治性乳腺切除术后急性辐射引起的胸壁皮肤损伤中的作用。方法:选取根治性乳腺切除术后放疗患者100例,随机分为观察组(医用防辐射剂治疗)和对照组(常规治疗)各50例。结果:两组均无4级急性放射性皮肤损伤;观察组1级急性放射性皮肤损伤发生率高于对照组;2级和3级急性放射性皮肤损伤发生率低于对照组,差异有显著性(P<0.05);觀察组发生1、2级急性放射性皮肤损伤时的辐射剂量高于对照组(P<0.05)。当累计辐射剂量为10 Gy、20 Gy、40 Gy时,观察组急性放射性皮肤损伤的发生率低于对照组,且差异有显著性(P<0.05)。结论:医用防辐射剂可有效降低乳腺癌患者术后放疗靶区的放射性皮肤损伤发生率。
关键词:医用射线防护剂;乳腺癌根治术;皮肤损伤
医学影像已成为现代医学诊断的核心组成部分[1]。电离辐射对细胞具有直接、可测量的有害影响,包括增加活性氧 (ROS)、产生单链 DNA 断裂 (SSB) 和双链 DNA 断裂 (DSB)[2~3]。
放疗的急性毒性主要是由于放射细胞杀伤所致,而晚期放疗相关的毒性是由于伤口愈合中涉及的生长因子的长期炎症和失调所致。减少急性和慢性放疗引起的毒性的一种方法是使用辐射防护剂来抵消辐射损伤[4~6]。
电离辐射广泛用于医学诊断、癌症相关治疗,并具有其他工业应用。与人类暴露于电离辐射相关的已知危害包括:诱导细胞死亡、基因突变和致癌作用。除了直接的细胞效应外,辐射暴露还可以通过产生活性氧(即过氧化氢、脂质氢过氧化物、超氧化物、氢氧化物、氢化物和过氧亚硝酸盐)来损害细胞。当电离辐射被细胞生物大分子周围的小分子(主要是水)吸收时,就会形成活性氧 (ROS)。这些 ROS 与细胞内容物发生反应,包括 DNA 和蛋白质。
细胞通过产生天然抗氧化剂(包括超氧化物歧化酶、谷胱甘肽、过氧化氢酶)来响应增加的自由基浓度,这些天然抗氧化剂可以最小化或消除自由基对细胞结构的诱导损伤。谷胱甘肽过氧化物酶主要催化氢氧根离子向水的转化。超氧化物歧化酶将超氧离子转化为过氧化氢,然后通过过氧化氢酶转化为氧气和水。超氧化物歧化酶存在于几种不同的亚型中,每一种都专用于细胞的特定区域。当暴露于越来越高的电离辐射水平时,细胞会增加抗氧化酶的表达。然而,当 ROS 的水平压倒这些细胞防御时,细胞将遭受损伤(以剂量依赖性方式),从而导致致癌、致畸、坏死或细胞凋亡[7]。
使用辐射防护剂作为减少辐射有害影响的一种方式。抗氧化剂具有作为自由基清除剂的潜力,从而减少由电离辐射引起的某些 DNA 损伤。从理论上讲,这种干预将使细胞防御与辐射暴露产生的自由基保持同步(假设辐射暴露时细胞内的抗氧化剂水平足够)。辐射防护化合物可抑制自由基形成、清除自由基、诱导天然辐射防护剂的产生(如超氧化物歧化酶、谷胱甘肽过氧化物酶和过氧化氢酶),增强 DNA 修复,减少辐射后炎症反应,甚至延迟细胞分裂,从而有更多时间进行细胞修复或经历凋亡。尽管辐射防护物质已被证明可有效减少放射治疗的副作用,但目前还没有用于诊断放射学的辐射防护剂。
1资料与方法
1.1 一般资料
选取2019年2月~2020年12月于我院行乳腺癌根治术后放疗的患者100例;患者均为女性,年龄35~62岁,分为观察组和对照组各50例,放疗总剂量均为50Gy;两组患者临床资料差异无显著性(P>0.05)。本研究经我院伦理委员会备案,所有受试者在入组前均知情。
1.2 治疗方法
观察组采用医用射线防护剂(放肤膏),自放疗第1天开始使用,轻揉使药物渗透到皮肤深处,每日2次,直至放疗结束后1周;并嘱患者穿戴柔软内衣,保持照射部位皮肤干燥清洁,避免刺激及摩擦。对照组不使用医用射线防护剂,其余治疗相同。所有患者治疗结束后8周内通过受试者每周返院或电话回访的方式进行随访。
1.3 观察指标
急性放射性皮肤损伤分级标准:0级无变化; 1级皮肤毛囊暗红色斑块,脱发,脱皮干燥,出汗减少;2 级触痛或皮肤鲜红色斑块,斑片状湿脱皮,中度水肿;3 级在皮肤皱襞以外的区域出现湿性脱皮、水肿;4级皮肤溃疡、出血、坏死。从放疗开始至治疗结束,每天观察视野内皮肤变化,记录皮肤反应发生的时间、分级和持续时间。若出现斑片状湿脱皮2级皮肤反应,暂停放疗,继续涂抹药膏,待皮肤愈合后再继续放疗。
2结果
两组均无4级急性放射性皮肤损伤;观察组1级急性放射性皮肤损伤发生率高于对照组; 2、3级急性放射性皮肤损伤发生率低于对照组,差异有统计学意义(P<0.05); 观察组发生1、2级急性放射性皮肤损伤时的辐射剂量高于对照组(P<0.05),见表1。观察组急性放射性皮肤损伤发生率低于对照组。对照组在10Gy、20Gy和40Gy的累积剂量下,差异有显着性。
3讨论
探索辐射防护剂潜在作用的文献正在迅速增长。与辐射防护剂的研究主体相关的三个重要警告:研究辐射剂量、不受控制地暴露于辐射防护剂(通过饮食)和长期影响。首先,许多研究人员对测试动物和细胞模型进行比医学成像过程中使用的辐射剂量高得多的辐射。这种趋势可能使研究能够确定夸大的辐射防护作用。尽管存在这些差异,研究表明,即使是低剂量的电离辐射,也会产生与较大辐射剂量类似的细胞反应(双链断裂、自由基形成、脂质过氧化、细胞坏死、细胞凋亡)。在2011年的一项研究中,作者在 CT 血管造影后测量了人类淋巴细胞中的 DSB,发现扫描完成 30 min后 DSB 显着增加。出于这个原因,辐射防护剂可能仍然是有益的。其次,文献中研究的许多辐射防护剂在饮食中广泛存在,可能会混淆对辐射防护剂有效性的研究。第三,虽然辐射暴露与 DSB 和其他类型的 DNA 损伤有关,但没有长期数据证明 DSB 的减少会导致致癌和致畸的减少。换句话说,用放射防护剂预防与成像相关的 DSB 可能没有实际的临床价值。
各自的辐射防护剂通过增加天然抗氧化剂的能力或作为直接自由基清除剂起作用。一些药剂已经提出了细胞周期和细胞凋亡途径的影响,尽管其他药剂也可能影响细胞周期。鉴于电离辐射对人体细胞的影响已得到充分研究,以及成像在现代医学中的日益普及,一种减少电离辐射引起的细胞损伤的方法有可能有助于降低发病率和死亡率。文献中有足够的证据表明,对患者进行放射防护剂治疗前和/或后治疗,可能会减少电离辐射造成的损害。不管观察到的这些影响如何,还需要更多的研究来确定放射防护干预是否会在临床相关人群中提供长期益处或降低毒性。
炎症性损伤是放射防护剂显示出前景的另一个领域。有趣的是,炎症损伤与细胞抗氧化剂的消耗有关。一些研究表明,辐射防护剂通过减少辐射后的炎症反应来减少细胞损伤(甚至可能是细胞死亡)。尽管氧化剂与电离辐射的机制不同,但严重败血症和败血性休克等情况也会产生富含氧化的环境,导致天然细胞抗氧化剂(如谷胱甘肽)耗尽,并导致细胞损伤和死亡。因此,由严重败血症和败血性休克等条件产生的富含氧化剂的环境在某些方面类似于电离辐射产生的条件。有人提出炎性损伤可能是抗氧化保护不足的结果。此外,至少一项研究表明,抗氧化剂可能在保护患者免受 ICU 炎症相关细胞损伤方面發挥作用。因此,辐射防护剂可能在减少炎症损伤方面具有更大的应用,超出了对辐射暴露的反应。但需要更多的研究来确定该领域未来的临床应用。
综上所述,本研究表明,医用防辐射剂可有效降低乳腺癌患者术后放疗靶区的放射性皮肤损伤发生率,值得在临床上推荐。
参考文献
[1]黎彩霞,陈汝桂. 放射治疗皮肤防护剂在肿瘤患者放疗中的防护疗效[J]. 保健文汇,2021,22(2):189-190.
[2]葛梦雅,陈天宾. 皮肤放疗防护剂预防面颈部放疗引起皮肤损伤的疗效评价[J]. 中国基层医药,2014,21(12):1776-1777.
[3]裘丹珊,万贤琴,陈彦敏. 医用射线防护喷剂对乳腺癌术后放疗患者皮肤的保护效果[J]. 中国乡村医药,2020,27(1):8-9.
[4]房丽君,郭永红,焦建峰. 氧疗联合医用射线防护剂防治宫颈癌放疗会阴部放射性皮炎的临床疗效观察[J]. 临床医药文献电子杂志,2020,7(69):48,53.
[5]刘瑛,李丽莎,谢逢安,等. 医用射线防护剂可减轻头颈部鳞癌患者的放疗皮肤损伤[J]. 南方医科大学学报,2016,36(3):443-444.
[6]古俊钊,韦英林,廖超龙. 医用射线防护喷剂预防鼻咽癌放疗后鼻窦炎的效果观察[J]. 中国保健营养,2019,29(20):4-5.
[7]吴珊,王林娟. 射线防护剂在放疗鼻咽癌患者皮肤护理中的应用效果[J]. 检验医学与临床,2016,13(1):104-106.

