SOCS1调控JAK/STAT通路传导抑制肝癌细胞增殖、侵袭、迁移的机制研究
邓桢,雷钊,朱红伟,李志强,余枭,杨智,孙吉春,金晓馨
(1.中南大学湘雅三医院肝胆胰外科, 湖南长沙 410013; 2.中南大学湘雅医院结直肠肛门外科,湖南长沙 410008;3.中南大学湘雅二医院胃肠外科,湖南长沙 410011)
肝癌是全球范围内最常见的致命恶性肿瘤,据统计,2020年全球新增肝癌患者905 677例,死亡病例830 180例[1]。肝癌具有隐匿性,患者发病时通常被诊断为肝癌晚期,由于侵袭性较强、复发率高,导致其预后不良,目前对于肝癌患者,早期治疗以根治性切除为主,但50%的术后患者在5年内出现转移和复发[2-3]。近年来,细胞因子信号转导抑制因子(suppressors of cytokine signalling, SOCS)表达变化被报道与多种疾病和癌症的发生发展密切相关[4]。SOCS家族重要成员SOCS1基因可由多种细胞因子和生长因子诱导,并以负反馈方式抑制其信号传导,进而发挥抗肿瘤作用[5-6]。有研究表明SOCS1基因在肝癌组织中的表达水平显著低于正常组织,且SOCS1在肝细胞癌(hepatocellular carcinoma, HCC)中的表达具有独立的预后价值[7-8],然而SOCS1在肝癌进展中的功能及分子机制尚未明确。本研究旨在探讨SOCS1表达变化对肝癌细胞增殖、迁移和侵袭的影响,并初步揭示SOCS1在抑制肝癌发生发展中的作用机制,希望在探讨SOCS1抑制肝癌进展机制的同时,能够为临床治疗肝癌寻找新的分子靶标和治疗靶点提供新的切入点。
1 材料与方法
1.1 主要试剂
DMEM培养基购置于美国Thermo Fisher Scientific公司,胎牛血清(fetal bovine serum, FBS)购自Gibco公司。RNA提取试剂盒、蛋白质提取试剂盒、BCA试剂盒购自上海碧云天公司,反转录试剂盒、SYBR green qRT-PCR试剂盒购自日本Takara公司。Anti-SOCS1(ab)、Anti-JAK2(ab108596)、Anti-p-JAK2(ab32101)、Anti-STAT3(109085)、Anti-p-STAT3(ab76315)、GADPH抗体、羊抗、兔二抗均购自美国Abcam公司。
1.2 细胞培养及转染
人正常肝细胞HL-7702购自美国生物资源保藏中心(American Type Culture Collection, ATCC);肝癌细胞系HepG2和Hep3B购自中国科学院细胞库; HuH-7细胞系购自日本科研生物资源细胞库。使用添加100 U/ml链霉素/青霉素和10%(v/v)胎牛血清(FBS)的DMEM培养基,温度37℃,含5% CO2环境培养细胞。由上海吉玛公司合成pcDNA3.1-SOCS1,pcDNA3.1-siRNA-SOCS1实现SOCS1的过表达或干扰表达。
1.3 MTT实验检测细胞增殖能力
收集对数期细胞接种于96孔细胞培养板, 调整细胞悬液浓度为5×105个/ml,每孔加入100 μl细胞悬液培养, 待贴壁后48 h加入MTT溶液(5 mg/ml) 20 μl,孵育4 h,弃培养液,加150 μl的DMSO,振荡10 min;检测波长490 nm下的OD值,计算细胞增殖活性。
1.4 RNA提取及qRT-PCR分析
选择对数生长期的细胞,使用RNase free PBS洗涤,加入Trizol溶液,室温放置5 min使细胞充分裂解,12 000 rpm、4℃离心10 min,取澄清上清液,加入三氯甲烷室温静置3~5 min,4℃下12 000 rpm离心15 min,取上清液加入异丙醇,室温静置10 min后4℃下12 000 rpm离心10 min,75%乙醇洗涤2次,提取细胞的总RNA,使用反转录试剂盒将总RNA反转录为cDNA,然后通过SYBR green qRT-PCR试剂盒检测SOCS1,JAK2和STAT3的mRNA水平,qRT-PCR分析采用7500HT qRT-PCR系统。
1.5 Western blot检测相关蛋白的表达情况
将对数生长期的细胞用细胞裂解液裂解,转速13 000 rpm 4℃,离心30 min,取上清液提取总蛋白,用BCA法测定蛋白浓度,然后100℃水中煮5 min使蛋白变性。放置冰上3 min,13 000 rpm,4℃离心15 min。12%SDS-PAGE浓缩胶进行蛋白分离,电泳结束后,将胶中的蛋白湿转至PVDF膜,加含5%(w/v) 脱脂奶粉的TBS/T封闭缓冲液, 摇床封闭2 h。回收封闭液加入相应一抗(4℃孵育过夜),然后使用TBST冲洗膜后加入二抗,最后进行蛋白质条带显色检测。使用GAPDH作为内源性对照。
1.6 细胞划痕实验检测细胞迁移能力
将各组细胞以浓度为5×105个/ml接种于细胞培养板上,第二天使用枪头在每个孔上划出一条直线,用PBS洗细胞3次,去除划下的细胞,加入无血清培养基。放入37℃ 5%CO2培养箱进行培养。在0 h,24 h和48 h时取样拍照,在光学显微镜下观察细胞的迁移距离。
1.7 Transwell实验检测细胞侵袭能力
用50 mg/L Matrigel 1∶8稀释液包被Transwell小室底部膜的上室面,4℃风干。将小室放入培养板中,在上室加入300 μl预温的无血清培养基,室温静置15~30 min,使基质胶再水化,再吸去剩余培养液。 使用胰酶消化细胞,终止消化后离心弃去培养液,用PBS洗1~2遍,用含BSA的无血清培养基重悬,调整细胞密度至5×105,取细胞悬液100 μl加入Transwell小室,常规培养48 h,使用结晶紫染色20 min后,轻轻擦掉上层未迁移细胞,检测穿过的细胞数。
1.8 统计学方法

2 结 果
2.1 SOCS1在肝癌细胞系中低表达
收集和培养人正常肝细胞HL-7702和肝癌细胞系HepG2,HuH7,Hep3B, qRT-PCR和Western blot检测SOCS1在各细胞系中的表达水平。结果如图1所示,相较于人正常肝细胞HL-7702,SOCS1 mRNA和蛋白表达水平在肝癌细胞系HepG2、HuH7、Hep3B中均显著下调(P<0.01),其中HepG2下调最为显著(见图1)。

图1 SOCS1在人肝癌细胞系中低表达(A,qRT-PCR检测人正常肝细胞和肝癌细胞系中SOCS1 mRNA表 达水平; B, Western blot检测人正常肝细胞和肝癌细胞系中SOCS1蛋白表达水平, ** P<0.01)
2.2 SOCS1抑制肝癌细胞增殖、迁移、侵袭
通过pcDNA-SOCS1和pcDNA-si-SOCS1及空载体对照转染肝癌细胞HepG2,构建SOCS1过表达和干扰表达的肝癌细胞系,用于后续实验。MTT实验检测SOCS1表达变化对肝癌细胞增殖活性的影响,结果显示SOCS1过表达可显著降低肝癌细胞增殖活性,而SOCS1干扰表达则显著增强细胞增殖活性(P<0.01)。细胞划痕实验结果显示,SOCS1过表达组肝癌细胞24 h、48 h迁移距离显著降低,且1/2划痕愈合时间增长,而SOCS1干扰表达组24 h、48 h迁移距离显著上升,1/2划痕愈合时间缩短(P<0.01)。Transwell实验结果显示SOCS1过表达能够显著抑制肝癌细胞侵袭,SOCS1干扰表达则显著促进细胞侵袭(P<0.01)(见图2)。

图2 SOCS1抑制肝癌细胞增殖、 迁移和侵袭(A, qRT-PCR和Western blot检测SOCS1过表达/干扰表达载体转染效 率; B, MTT实验检测SOCS1表达变化对肝癌细胞增殖活性的影响; C, 细胞划痕实验检测SOCS1表达变化对 肝癌细胞迁移能力的影响; D, transwell实验检测SOCS1表达变化对肝癌细胞侵袭能力的影响,** P<0.01)
2.3 SOCS1通过影响JAK2和STAT3磷酸化水平调控JAK/STAT信号通路活性
进一步检测SOCS1表达变化对JAK/STAT信号通路的影响,结果如图3。qRT-PCR检测结果显示SOCS1干扰表达或过表达后肝癌HepG2细胞中JAK/STAT通路相关蛋白JAK2和STAT3 mRNA均无显著变化。Western blot检测JAK2和STAT3蛋白表达水平和磷酸化水平,结果显示SOCS1表达变化不影响JAK2和STAT3蛋白表达水平,磷酸化水平检测结果显示SOCS1干扰表达可显著上调JAK2和STAT3磷酸化水平,而SOCS1过表达显著下调JAK2和STAT3磷酸化水平,表明SOCS1能够影响肝癌细胞中JAK/STAT信号通路的活性。

图3 SOCS1调控JAK/STAT信号通路活性 (A, qRT-PCR检测SOCS1表达变化对JAK2mRNA水 平的影响; B, qRT-PCR检测SOCS1表达变化对STAT3 mRNA水平的影响; C, Western blot 检测SOCS1表达变化对JAK2、 STAT3蛋白表达水平和磷酸化水平的影响, ** P<0.01)
2.4 SOCS1通过调控JAK/STAT信号通路影响肝癌细胞增殖、迁移和侵袭
SOCS1和JAK/STAT通路抑制剂氯硝柳胺共处理肝癌细胞HepG2,MTT实验结果显示干扰SOCS1表达后细胞增殖活性显著上升, 而氯硝柳胺处理则能抑制SOCS1干扰表达对肝癌细胞增殖的影响(P<0.01)。细胞划痕实验结果显示si-SOCS1和氯硝柳胺共处理组肝癌细胞迁移速度显著下降,1/2划痕愈合时间显著增加(P<0.01)。Transwell实验结果表明si-SOCS1和氯硝柳胺共处理能够显著抑制肝癌细胞侵袭能力(P<0.01)。以上结果提示,SOCS1能够通过调控JAK/STAT信号通路影响肝癌细胞生长。
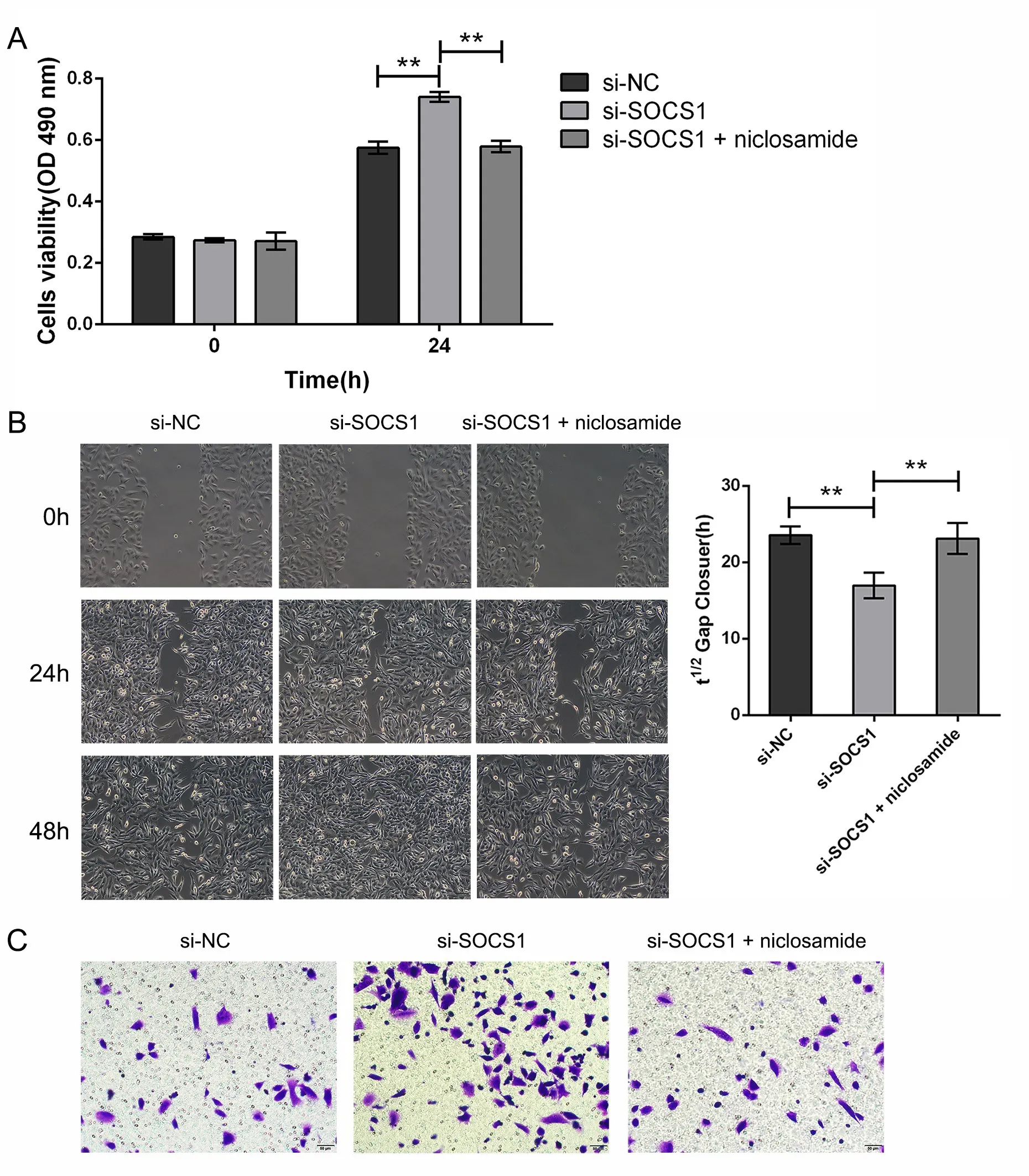
图4 SOCS1通过调控JAK/STAT信号通路影响肝癌细胞的生长 (A, MTT实验检测si-SOCS1和JAK/STAT通路抑制剂细胞增殖活性的影响; B, 细胞划痕实验检测si-SOCS1和氯硝柳胺共处理对肝癌细胞迁移能力的影响;C, transwell实验检测肝癌细胞si-SOCS1和氯硝柳胺共处理对肝癌细胞侵袭能力的影响,**P<0.01)
3 讨 论
肝癌是全球面临的一个重大的公共卫生挑战,严重威胁人类生命健康,在所有肝癌病例中,90%患者为HCC。目前,肝癌的治疗主要以根治性切除、化疗及免疫治疗为主,然而疗效均不理想,且预后较差[2,9]。因此,寻找新的分子靶标和治疗靶点,开发新的靶向治疗特效药物及治疗方法是目前亟待解决的问题。
研究表明,SOCS家族与多种癌症和肿瘤进展相关,特别是SOCS1和SOCS3[10]。鉴于SOCS1在多种癌症中的低表达,在癌组织中检测SOCS1蛋白表达水平是评估SOCS1作为潜在癌症生物标记物的直接方法。本研究检测SOCS1在人正常肝细胞和各种肝癌细胞系中的表达差异,结果显示SOCS1在3种肝癌细胞系中均显著低表达,结果与先前的文献报道一致[7]。SOCS1被发现与多种疾病和肿瘤的发生发展及预后密切相关,如,前列腺切除样本中SOCS1蛋白表达变化可能和前列腺癌预后相关,并且SOCS1可能作为与远处转移相关的血清生物标志物,成为前列腺癌个性化治疗的靶点[11];卵巢癌中SOCS1 mRNA的低甲基化率增加了SOCS1 mRNA的表达,从而促进卵巢癌的发生发展[12];SOCS1可通过抑制Toll样受体(Toll-like receptor, TLR)通路促进糖尿病性肾病(diabetic nephropathy, DN)大鼠肾损伤修复[13]等。SOCS1基因可能成为未来肿瘤治疗的新靶点,为肿瘤治疗和预后评价提供新的希望,然而SOCS1在肝癌中作用机制的研究报道较少,且都局限于SOCS1在病灶组织中的表达检测及其在免疫调节中的作用,如,丙型肝炎病毒(hepatitic C virus, HCV)患者SOCS1基因表达与血红蛋白(hemoglobin, Hb)和血小板计数呈正相关,而与白细胞数与其表达情况呈负相关[14];SOCS1基因甲基化状态可能在肝癌发生过程中发挥重要作用,SOCS1结合血清甲胎蛋白(alpha fetoprotein, AFP)可作为HCC诊断和预后的非侵袭性生物标志物[15]。SOCS1是否能对肝癌细胞的生长产生影响,进而控制肝癌的进展,仍需要通过研究来验证。本研究通过在肝癌细胞中过表达或干扰表达SOCS1,检测SOCS1表达变化对肝癌细胞生长的影响,结果显示过表达SOCS1能够显著抑制肝癌细胞的增殖、迁移和侵袭,而干扰表达SOCS1则结果相反,证实了SOCS1在肝癌中的抑癌作用。
SOCS1是经典的Janus激酶/信号转导与转录激活子(the Janus kinase/signal transducer and activator of transcription, JAK/STAT)信号通路的抑制剂,研究表明SOCS1可以靶向未磷酸化的JAK,SOCS1的激酶抑制区域可高特异性靶向结合JAK的底物结合槽,从而通过阻止JAK的磷酸化来抑制信号传导[16]。SOCS1/JAK/STAT途径也在多种疾病中表现出调控作用,如,靶向SOCS1可通过抑制JAK/STAT信号通路减轻糖尿病患者的肾脏和血管氧化应激[17];抑制SOCS1可促进JAK/STAT信号通路的持续激活,并启动与增殖和侵袭相关基因的转录,促进鼻咽癌的恶性进展[18];SOCS1基因甲基化导致SOCS1基因沉默,影响了SOCS1对下游JAK2/STAT信号通路的抑制,从而促进急性髓系白血病细胞的生长和增殖[19]。虽然目前SOCS1/JAK/STAT途径在肝癌中作用尚未见报道,但有研究显示,Ⅲ型干扰素可通过诱导SOCS1的表达,延迟和延长JAK/STAT信号通路的激活,在HCV患者治疗中发挥重要作用[20]。本研究结果显示SOCS1能够通过调控JAK/STAT信号通路活性,影响肝癌细胞的增殖、迁移和侵袭能力,提示SOCS1介导的JAK/STAT信号通路调控肝癌进展的可能性。并且JAK/STAT通路抑制剂处理能够恢复SOCS1表达变化对肝癌细胞的影响,进一步证实了SOCS1是通过介导JAK/STAT信号通路影响肝癌细胞的生长。
综上所述,本研究表明SOCS1在肝癌中能通过影响JAK2和STAT3磷酸化水平调控JAK/STAT信号通路的活性,进而抑制肝癌细胞的增殖、迁移和侵袭,为临床治疗肝癌寻找新的分子靶标和治疗靶点提供新的切入点。

