鹰嘴豆芽素A诱导人成骨肉瘤MG63细胞凋亡作用研究△
黄 乾,廖世杰,林成森,刘 云,李波香,陈县祥,刘建宏,丁晓飞*
(广西医科大学第一附属医院a:骨科;b:广西再生医学研究中心,广西南宁530021)
骨肉瘤是最常见的原发性骨肿瘤,儿童、青少年 好发[1]。骨肉瘤是高度侵袭性和破坏性的肿瘤,疾病早期易发生周围的骨骼和血管转移[2]。虽在应用新辅助化疗后,非转移性骨肉瘤患者的生存率有一定改善,但复发或转移患者5年生存率仍低于33%;并且常规化疗常存在严重副作用[3~5]。而近20年来骨肉瘤患者的长期生存时间并没有明显的提升[6]。
雌激素可通过调控成骨细胞凋亡来维持骨密度稳定[7]。有研究表明,17β-雌二醇(E2)对骨肉瘤细胞的增殖、迁移、侵袭和凋亡具有调控作用[8]。但长期或大量应用雌激素会带来副作用。分子研究表明,植物雌激素在结构上类似于17β-雌二醇(E2),并且可以结合和激活细胞内雌激素受体,只引起轻微副作用[9]。植物雌激素可抑制多种肿瘤细胞[10]。鹰嘴豆芽素A(biochanin-A,BA),是源于豆科植物鹰嘴豆、红车轴草等的一种异黄酮,具有类雌激素作用[11]。鹰嘴豆芽素A具有多种药理作用。然而,其对人骨肉瘤细胞的作用研究中较少涉及。本项研究主要探索鹰嘴豆芽素A对MG-63人成骨肉瘤细胞的细胞毒性作用及诱导凋亡机制。
1 材料与方法
1.1 实验细胞与处理
1.1.1 细胞培养
MG-63细胞购自中国科学院上海生物化学与细胞生物学研究所细胞库。MG-63细胞使用含10%胎牛血清、1%100 U/ml青霉素和100 U/ml链霉素(四季青,杭州,中国)的高糖DMEM(Gibco,Life Tech⁃nologies,美国)培养基,置于37℃、5% CO2温箱中培养,使用Trypsin+EDTA消化传代。
1.1.2 主要试剂
鹰嘴豆芽素A购自中国上海Aladdin公司;MTT[3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐]购自美国Sigma-Aldrich公司;Annexin V-FITC/PI凋亡检测试剂盒购自美国BD Pharmingen公司;DAPI核酸染色试剂盒购自中国北京Solarbio公司;兔单克隆抗体phospho-p38 MAPK(Thr180/Tyr182)、p38 MAPK(D13E1)、phospho-p44/42MAPK(ERK1/2) (Thr202/Ty204) 、 p44/42 MAPK (Erk1/2)(137F5)、 Phospho-SAPK/JNK (Thr183/Tyr185)、Caspase-3 (8G10)、Cleaved Caspase-9 (Asp330)、PARP (46D11)、Bax (D2E11)、Bcl-2 (D55G8)、β-Actin(D6A8)和辣根过氧化物酶标记的二抗购自美国Cell Signaling Technology公司;重组兔单克隆抗体 Anti-JNK1+JNK2+JNK3 antibody(EPR18841-95)购自英国Abcam公司。
1.2 检测指标
1.2.1 MTT检测
将MG-63细胞[(6~8)×104/ml]接种于96孔板,进入对数期后用鹰嘴豆芽素A(0、2.5、5、10、20、40、80、160 μmol/L)在恒温培养箱中培养 24 h 和 48 h。将 MTT(20 μl,5 mg/ml)加入到每个孔中。于37℃避光温育2 h后,向各孔中加入150 μl二甲基亚砜(DMSO)。使用酶标仪(Spectramax Plus 384,Molecular Devices,美国)在570 nm处获得吸光度。每个浓度梯度设置6个复孔,实验总体重复3次。细胞活性表示为半数抑制浓度(IC50)值。
1.2.2 荧光显微镜观察
用DAPI染色评估核形态的变化。将MG-63细胞(7.5×104/ml)接种在6孔板中,并加入鹰嘴豆芽素 A(0、40、80 μmol/L)处理 24 h。PBS 洗涤后在4%多聚甲醛中固定20 min,并于室温用10 μg/ml DAPI染料染色10 min。使用荧光显微镜观察随机视野中捕获的细胞核形态。
1.2.3 流式细胞检测
取MG-63细胞(1.0×105/ml)接种在6孔板中,用鹰嘴豆芽素A(0、40、80 μmol/L)处理MG-63细胞48 h,PBS洗涤两次,然后以600 g离心5 min。去除上清液,将500 μl的1X结合缓冲液加入到细胞中。向细胞中加入Annexin V(FITC,5 μl)和碘化丙啶(PI,5 μl),然后避光孵育15 min。在1 h内通过BD Accuri C6流式细胞仪(Becton&Dickin⁃son Co.,美国)测定细胞凋亡率。
1.2.4 Western印迹分析
用鹰嘴豆芽素 A(0、20、40、80 μmol/L)处理MG-63细胞24 h,总蛋白质从MG-63细胞中提取,BCA法检测总蛋白。将等量的蛋白质(40 μg)加入10%~15%十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶(PAGE)中电泳,然后直接将蛋白转移到NC膜上。将膜在5XBSA溶液中室温封闭1 h;用特异性抗体 p-p38、p38、p-JNK、JNK、p-ERK1/2、ERK1/2、β-Actin、Bcl-2、Bax、caspase-3、caspase-9 和PARP在4℃孵育过夜。洗膜后用辣根过氧化物酶标记的相应二抗室温孵育1 h。使用ChemiDOC™XRS+系统(Bio-Rad Laboratories,美国)检测免疫复合物。
1.3 统计学方法
使用 GraphPad Prism(版本 7.0,GraphPad Soft⁃ware,美国)进行统计分析。结果以平均值±平均值的标准误差(SEM)给出。单因素方差分析(ANO⁃VA)用于比较3个或更多组。P<0.05为差异具有统计学意义。
2 结果
2.1 鹰嘴豆芽素A抑制MG-63细胞的活性
将人骨肉瘤MG-63细胞用不同浓度的鹰嘴豆芽素 A(0、2.5、5、10、20、40、80 μmol/L)处理 24 h和48 h后使用MTT法测量。MG-63细胞的IC50值在 24 h 为 106.70 μmol/L,48 h 为 75.57 μmol/L。细胞活性显着下降,并呈时间和剂量依赖性效应(图1)。
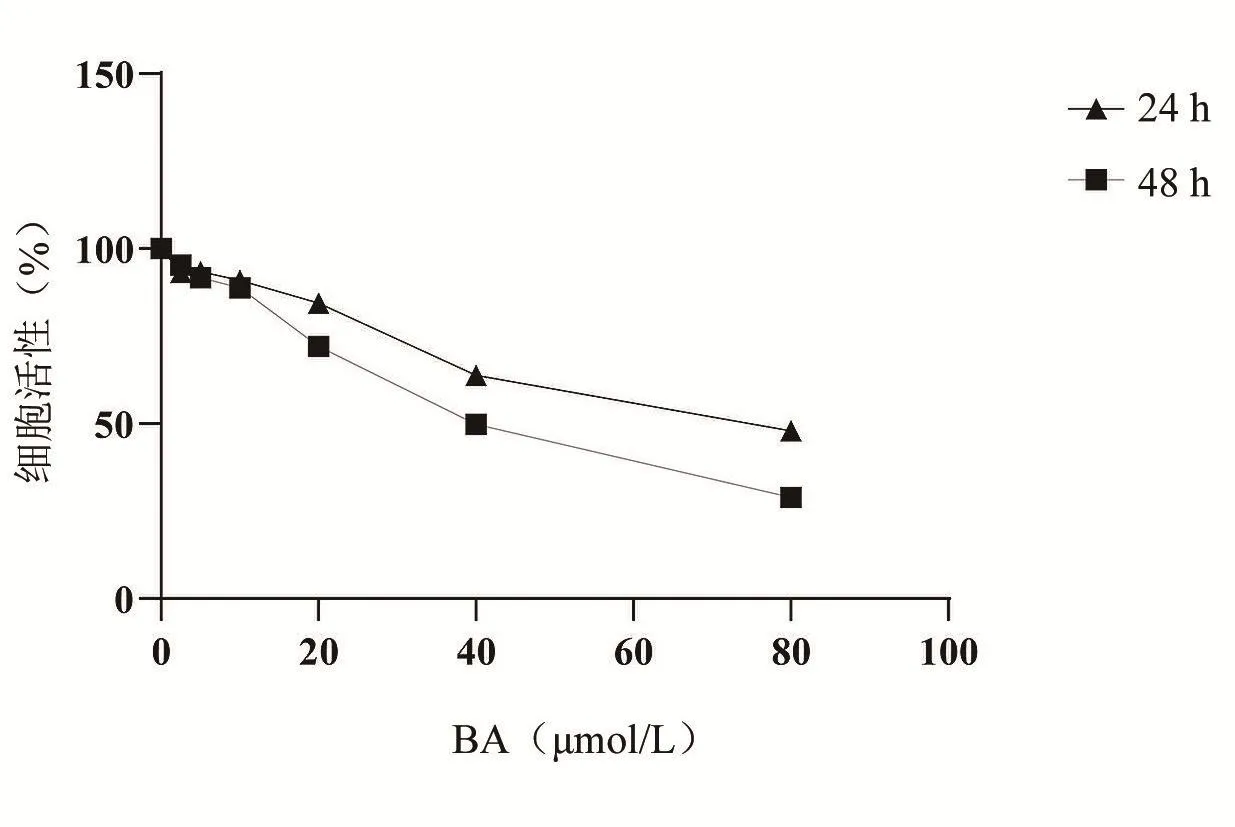
图1 MTT实验结果表明鹰嘴豆芽素A可抑制MG-63细胞活性,并呈时间和剂量依赖性效应
2.2 鹰嘴豆芽素A诱导MG-63细胞凋亡
用不同浓度鹰嘴豆芽素A(0、40、80 μmol/L)处理MG-63细胞24 h,DAPI荧光染色后使用荧光显微镜观察。在×200视野下,可明显观察到早期凋亡的MG-63细胞,并随着鹰嘴豆芽素A浓度的增加,细胞量较正常组少,凋亡细胞比例较正常组增多(图2a~2f)。
用不同浓度鹰嘴豆芽素A(0、40、80 μmol/L)处理MG-63细胞48 h,用流式细胞仪检测细胞凋亡率,显示凋亡率以剂量依赖方式增加。与正常组相比,使用40 μmol/L和80 μmol/L鹰嘴豆芽素A处理MG-63细胞明显促进其凋亡。当鹰嘴豆芽素A浓度为40 μmol/L和80 μmol/L时,细胞凋亡率分别为(45.28±3.79)%和 (82.51±5.23)%,高于正常组(5.31±3.14)%(P<0.001;P<0.001)(图 2g~2i)。
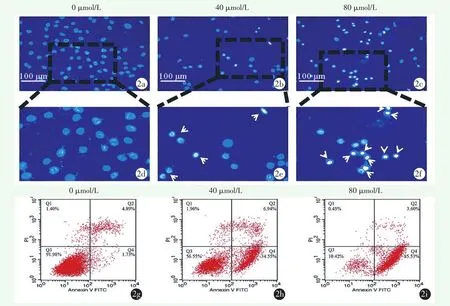
图2 鹰嘴豆芽素A诱导MG-63细胞凋亡 2a~2f:不同浓度鹰嘴豆芽素A处理后,DAPI染色观察凋亡MG-63细胞核形态改变(倒置显微镜,×200),凋亡细胞核染色质致密深染(如白色箭头所示)(2a:正常组,2b:40 μmol/L鹰嘴豆芽素A,2c:80 μmol/L鹰嘴豆芽素A,2d~2f:分别对应2a~2c的局部放大区域) 2g~2i:Annexin V/PI双染法流式细胞术结果表明鹰嘴豆芽素A诱导MG-63细胞凋亡(2g:正常组,2h:40 μmol/L鹰嘴豆芽素A,2i:80 μmol/L鹰嘴豆芽素A)
2.3 鹰嘴豆芽素A促进MAPK通路的磷酸化p38、磷酸化JNK与磷酸化ERK1/2的表达
用不同浓度鹰嘴豆芽素 A(0、20、40、80 μmol/L)处理MG-63细胞24 h,使用Western blot检测发现,鹰嘴豆芽素A可促进磷酸化p38蛋白的表达,呈剂量依赖方式。鹰嘴豆芽素A也可促进磷酸化JNK蛋白与磷酸化ERK1/2蛋白的表达,以80 μmol/L最明显(图 3a,3b)。
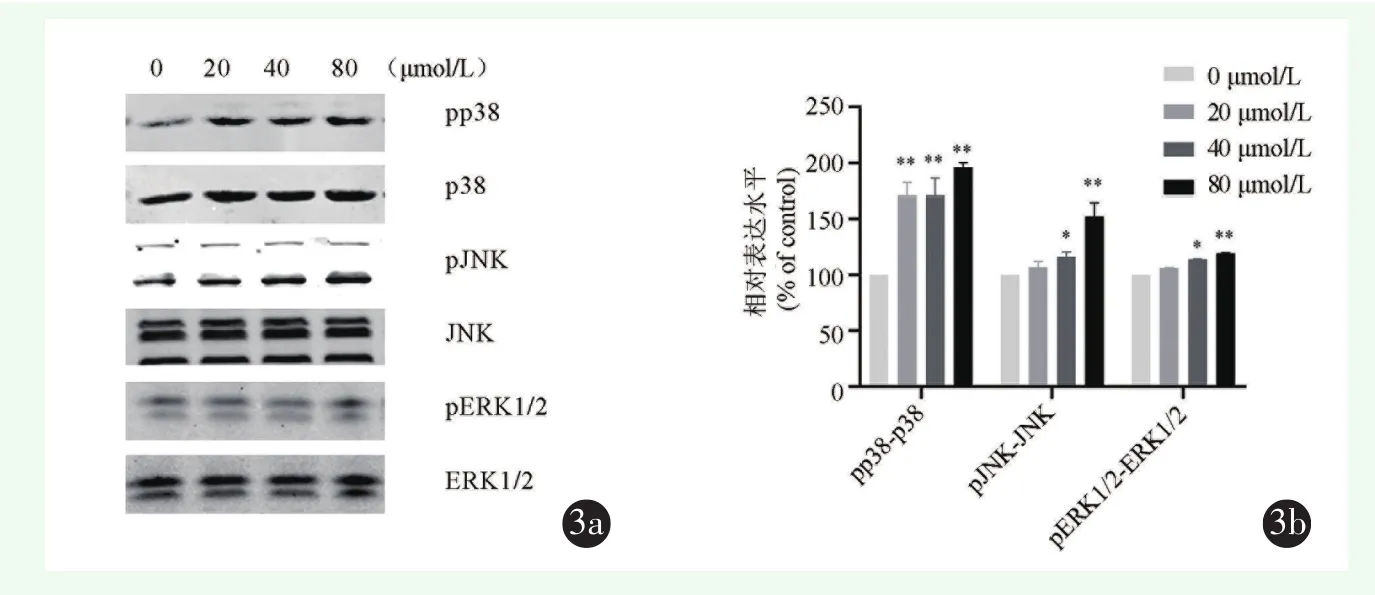
图3 Western blot检测鹰嘴豆芽素A促进MG-63细胞MAPK信号通路相关蛋白表达 3a:鹰嘴豆芽素A促进MG-63细胞磷酸化p38蛋白、磷酸化JNK蛋白与磷酸化ERK1/2蛋白的表达 3b:相对蛋白表达水平统计分析结果(*P<0.05,**P<0.01,***P<0.001)
2.4 鹰嘴豆芽素A可调控Bcl-2蛋白家族的表达
用不同浓度鹰嘴豆芽素 A(0、20、40、80 μmol/L)处理MG-63细胞24 h,使用Western blot检测主要凋亡途径蛋白Bcl-2蛋白家族中Bax和Bcl-2基因和蛋白的表达。结果显示:鹰嘴豆芽素A以剂量依赖方式上调Bax和下调Bcl-2的表达(图4a,4b)。
2.5 鹰嘴豆芽素A可促进caspase蛋白家族的表达
用不同浓度鹰嘴豆芽素 A(0、20、40、80 μmol/L)处理MG-63细胞24 h,使用Western blot检测主要凋亡途径蛋白caspase蛋白家族。结果显示:随着鹰嘴豆芽素A浓度的增加,cleaved caspase-9、cleaved caspase-3和cleaved PARP的表达增加(图4a,4b)。
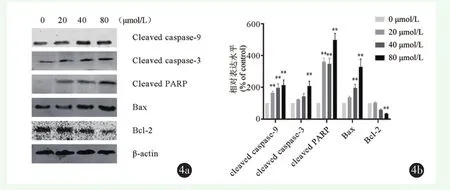
图4 Western blot检测鹰嘴豆芽素A促进MG-63细胞凋亡相关蛋白的表达 4a:鹰嘴豆芽素A促进MG-63细胞凋亡相关蛋白的表达 4b:相对蛋白表达水平统计分析结果(*P<0.05,**P<0.01,***P<0.001)
3 讨论
骨肉瘤严重威胁全球年轻人的健康成长,探索新的骨肉瘤治疗策略十分重要。本研究结果显示鹰嘴豆芽素A以时间和剂量依赖效应来抑制MG63细胞的活性,并通过激活p38、JNK信号通路和主要凋亡信号通路Bcl-2家族和caspase家族来诱导细胞凋亡。
细胞凋亡被广泛认为是一个关键的生理过程,是一种细胞内基因和相关蛋白发挥作用引起的程序性细胞死亡。细胞死亡或凋亡的失常可导致癌症发生[12]。核质浓缩、核膜核仁破碎为细胞凋亡典型形态学表现[12]。本研究通过DAPI染色,观察MG-63细胞核的形态学变化。结果显示鹰嘴豆芽素A可诱导MG-63细胞凋亡,并呈浓度依赖效应。使用An⁃nexin V-FITC和PI染色检测细胞凋亡后,发现随着鹰嘴豆芽素A的浓度增高,MG-63细胞的凋亡率增高。
丝裂原活化蛋白激酶(MAPK)信号通路在癌症的发生发展起重要作用[13]。JNK和p38通路为MAPK通路的重要部分,与凋亡密切相关[14]。Chen等[15]证实植物雌激素DDTD可通过激活p38信号通路诱导骨肉瘤细胞的凋亡。Modrowski等[16]证实过表达syndecan-2可活化p38和JNK通路诱导骨肉瘤细胞凋亡。本研究通过Western blot实验检测MAPK信号通路相关蛋白,显示鹰嘴豆芽素A可上调磷酸化p38,磷酸化JNK和磷酸化ERK1/2的表达。
Bcl-2家族中的促凋亡和抗凋亡基因相互影响来维持细胞平衡[17]。Bcl-2是公认的与肿瘤发生相关的抗凋亡因子。组织和器官中的促凋亡因子Bax在线粒体外膜上广泛表达。Bcl-2和Bax的相互拮抗对肿瘤细胞凋亡的调控起重要作用。线粒体通路为细胞凋亡主要通路之一[18]。在启动阶段,线粒体释放细胞色素 C激活 caspase家族,引发级联反应[19]。Cho等[20]研究表明,鹰嘴豆芽素A可以通过上调Bax,下调 Bcl-2,促进 cleaved caspase-9、cleaved cas⁃pase-3和cleaved-PARP的表达来诱导咽鳞癌细胞凋亡。本研究通过Western blot实验证实,鹰嘴豆芽素A通过下调Bcl-2和上调Bax的表达诱导骨肉瘤细胞凋亡。同时检测到凋亡相关蛋白cleaved caspase-9、cleaved caspase-3和cleaved-PARP随着鹰嘴豆芽素A浓度的增加而增加,提示鹰嘴豆芽素A可诱导人成骨肉瘤细胞凋亡。
总之,植物雌激素鹰嘴豆芽素A可以抑制人成骨肉瘤MG-63细胞的活性,并通过激活MAPK/凋亡信号通路诱导细胞凋亡。其可以作为治疗骨肉瘤的一种潜在的新药物。但鹰嘴豆芽素A其他的抗肿瘤机制仍未完全明确,仍需更深层次的多方面探讨。

