无头精子症的表型、遗传学分析与治疗策略*
李维娜,刘刚,张欢,朱文兵(1.湖南光琇高新生命科技有限公司,长沙10001;2.中信湘雅生殖与遗传专科医院男科学部,长沙10081;3.湖南省生殖与遗传临床医学研究中心,长沙10081;.中南大学基础医学院生殖与干细胞工程研究所,长沙10081)
无头精子症(acephalic spermatozoa),又被称为断头精子症(decapitated spermatozoa或decaudated spermatozoa)或大头针样精子症,指精液中大部分精子呈现精子头部缺失、头部与尾部断开或松散连接。无头精子症是导致男性不育的原因之一,几乎不可能通过自然妊娠的方式获得后代。关于无头精子症遗传学病因分析的报道较少,SUN5[1-2]、PMFBP1[3-4]、TSGA10[5-7]、BRDT[8]基因突变可导致无头精子症。目前对不同致病基因不同位点变异导致的无头精子症的临床表型与治疗策略尚无深入研究。本研究招募了10例严重无头精子症患者,通过全外显子组测序对其进行遗传学分析,并对每种突变类型的精子形态表型进行细致划分,为今后无头精子症的治疗提供参考。
1 对象与方法
1.1 研究对象 2020年1至12月于中信湘雅生殖与遗传专科医院就诊的严重无头精子症患者10例,按《人类精液检查与处理实验室手册》(第5版)评估特异性精子缺陷。纳入标准:(1)婚后同居1年以上,性生活正常,未采取避孕措施的不育男性;(2)资料完整;(3)已找到已知致病基因的变异(包括文献已报道的和我们新发现的);(4)严重无头精子症(单一畸形率>70%)。排除标准:(1)染色体核型异常;(2)Y染色体微缺失;(3)未找到已知无头精子症相关基因的变异。本研究获得中信湘雅生殖与遗传专科医院伦理委员会批准(批准文号:LL-SC-2019-018),所有纳入研究对象均被告知本研究的目的以及外周血、精液去向,并签署了知情同意书。
1.2 标本采集与处理
1.2.1 外周血标本采集 采集研究对象静脉血2~3 mL于EDTA-K2抗凝管中,-80℃保存。
1.2.2 DNA抽提 取外周血200μL,用外周血DNA抽提试剂盒(GIAGEN)提取基因组DNA,按说明书操作。用Nanadrop2000检测DNA浓度及纯度。
1.2.3 精液标本采集 采集精液样本前禁欲2~7天,手淫法获取全部精液于无菌广口采精杯中。采精杯注明姓名,检验申请单上注明采集日期和时间、未射精天数,立即放入37℃恒温箱内。待精液完全液化后进行检测。报告中注明样本采集是否完整,尤其注明是否有富含精子的射精最初部分丢失。如有丢失应在禁欲2~7 d后再次采集精液做进一步检测。
1.3 精液常规分析 按照《人类精液检查与处理实验室手册》(第5版)进行操作。先用肉眼观察精液标本的量、颜色、黏稠度及是否液化。如标本已经液化,用pH试纸测其pH值。将完全液化后的精液充分混匀,用移液枪吸取3μL精液于一次性精子检测板(赛司医疗科技北京有限公司)中,采用全自动精子质量分析仪(赛司医疗科技北京有限公司)对精子浓度、活力等参数进行分析,人工镜检采用Makler计数板(以色列Sefi-medical instruments公司)。精液参数参考区间:精液量≥1.5 mL,精子浓度≥15×106/mL,前向运动精子百分率(PR)≥32%,精子活动率≥40%。
1.4 精子巴氏染色 将完全液化后的精液充分混匀,滴10μL精液于洁净的载玻片上,以45°、1 s的速度刮片,待其自然干燥。根据《人类精液检查与处理实验室手册》(第5版)提供的改良巴氏染色方法配制染液(苏木素染色液、EA50染液、橘黄G染液均购自BASO公司)并染片。
1.5 临床资料收集 收集患者的基本资料(性别、年龄、配偶年龄、配偶病史、双方生育史、吸烟嗜酒史、遗传性疾病家族史、全身慢性疾病病史、性功能障碍病史、大量吸烟饮酒和长期接触有害物质史、精索静脉曲张、生殖系统器质性病变、生殖道感染等);收集患者配偶的实验室及临床结局(助孕方式、卵母细胞总数、MⅡ期卵母细胞数、受精卵母细胞数、优质胚胎数、移植胚胎数、临床妊娠结局)。
1.6 遗传学分析
1.6.1 全外显子组测序 收集患者外周血gDNA样本送武汉华大公司进行全外显子组测序(WES)。用Agilent SureSelect version 6捕获外显子,采用BGISEQ-500平台测序,测序深度>100×,Q30≥80%。测序得到的原始数据使用Burrows-Wheeler Aligner(BWA)v0.7.15和GATK软件进行序列比对和变异识别,用ANNOVAR工具对变异进行注释。过滤筛选样本中的单核苷酸位点变异(single nucleotide variants,SNV)、插入和缺失(insertion-deletion,InDel):(1)过滤掉ExAC、1000Genomes和gnomAD、dbSNP数据库中>1%的变异;(2)保留位于外显子区(错义、无义、移码)和剪切区位点的变异;(3)去掉同义突变(synonymous SNV);(4)保留ClinVar数据库中注释为“Pathogenic”或“Likely pathogenic”的位点;(5)保留ClinVar、OMIM、HGMD、文献中已报道与无头精子症相关的致病基因突变位点;(6)在小鼠/人睾丸组织中特异性高表达的纯合或双等位基因杂合突变。
1.6.2 Sanger验证 根据SUN5(NM_080675.3)、TSGA10(NM_025244.2)、PMFBP1(NM_031293.2)基因序列(GRCh37/HG19),用在线Primer 3.0(http://primer3.ut.ee)软件设计引物。对候选致病突变位点所在基因组区域进行PCR扩增,纯化PCR扩增产物,送长沙擎科公司进行双向Sanger测序验证。
1.7 精子表型分析 由同一专业检验人员严格按照《人类精液检查与处理实验室手册》(第5版)形态学分类标准进行精子形态学分析,在油镜下计数至少200个精子,计算正常形态精子百分率、异常形态精子百分率、头部缺陷率、主段缺陷率、尾部缺陷率。
1.8 ICSI治疗 通过阴道B超及血清雌二醇(E2)水平监测卵泡发育,卵泡发育成熟后肌内注射人绒毛膜促性腺激素(HCG),36 h后在B超引导下取卵,取卵4~6 h后行卵细胞质内单精子注射(ICSI)。男性取精前禁欲2~7 d,采用直接洗涤法优化处理精液,由于这些患者精子的头尾部连接非常脆弱,实验室工作人员在ICSI操作中必须非常小心(避免造成精子头尾分离),将完整精子注入卵母细胞;如果未找到完整的精子,则将分离的精子头部和尾部全部注入MⅡ卵母细胞,授精后16~18 h观察受精情况。根据Racowesky法对胚胎进行评级,D3卵裂球≥6的Ⅰ~Ⅱ级胚胎为优质胚胎;根据患者胚胎和子宫内膜情况取卵后3 d选择1~2个新鲜优质胚胎移植,移植后行黄体支持。移植35 d后B超下见孕囊及原始心管搏动为临床妊娠。
2 结果
2.1 精液分析和分子遗传学分析 在10例严重无头精子症患者(表1)中,鉴定到3个基因SUN5、TSGA10、PMFBP1的11种纯合或杂合变异(表2)。

表1 严重无头精子症患者的精液分析

表2 严重无头精子症患者的致病变异和临床妊娠结局
2.2 精子表型分析 无头精子主要有2个亚型[5]:一种是没有核物质的小针头端;另一种是头部-中段连接错位的精子[9-10]。我们对10例严重无头精子症患者的精子形态进行分析(图1)发现:(1)即使是同一位患者的无头精子都有多种形态,在2种主要亚型的基础上,不同精子在结构上有许多细微的差异(例如:尾部结构的部分缺失、尾部顶端有残留的胞质小滴、无头尾部、无尾头部、松散的头部、头颈部连接错位等);(2)不同的致病基因(SUN5、TSGA10、PMFBP1)变异可产生类似的无头精子症表型;(3)同一个致病基因不同位点的变异产生的无头精子症表型没有明显差异,但在细微结构和所占比例上会有区别;(4)无头精子症的基因型(指本研究涉及的SUN5、TSGA10、PMFBP1三个基因,其他基因的情况还有待研究)与巴氏染色表型(不包括透射电镜)没有明显的相关性。
2.3 ICSI妊娠结局分析 10例患者ICSI治疗周期的结果见表2。除P9患者未进周期外,其他9例患者的受精率为85.79%(169/197),优胚率为55.03%(93/169),妊娠率为66.67%(6/9)(3位患者P1、P5、P6未妊娠)。其中P1配偶年龄为51岁,仅获卵1枚,没有可移植胚胎。
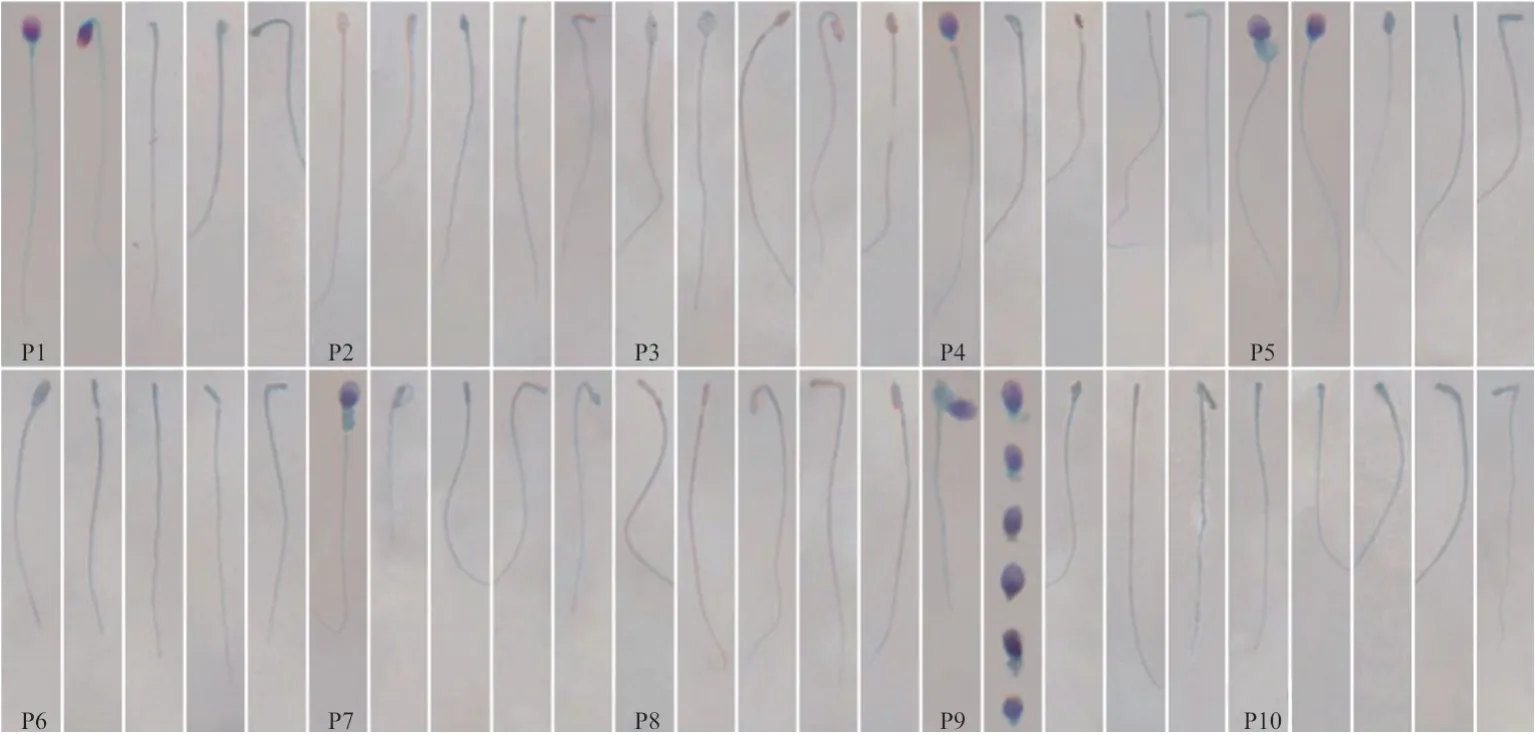
图1 10例严重无头精子症患者的精子表型
3 讨论
根据精子的超微结构和遗传学变异,可将无头精子的颈部断裂点分为3个亚型[4,11-12](图2):(1)亚型Ⅰ的断裂点在2个中心粒之间。无尾头部连接到完整的近端中心粒[10,13],具有完整的植入窝和基底体[13-15]。(2)亚型Ⅱ的断裂点在细胞核和近端中心粒之间,无尾头部缺乏植入窝和/或基底体,存在完整的近端和远端中心粒[2-3,15-18]。SUN5、HOOK1、PMFBP1基因突变与该类缺陷有关[2-3,16]。(3)亚型Ⅲ的断裂点在远端中心粒和精子中段之间,在精子尾部的近端可观察到胞质小滴,有/无不完整的线粒体鞘。TSGA10、BRDT基因突变与该类缺陷有关。但通过精子巴氏染色并不能有效区分这3种亚型。精子的中心粒如果不能正常迁移和附着在精子细胞核的尾极,则精子头部和尾部会分别独立发育,产生缺乏头部或头部-中段排列异常的精子、无头尾和松散的头部[19-20]。松散的精子头部在我们的研究中并不常见,因为它们通常都被支持细胞吞噬[20-21]。
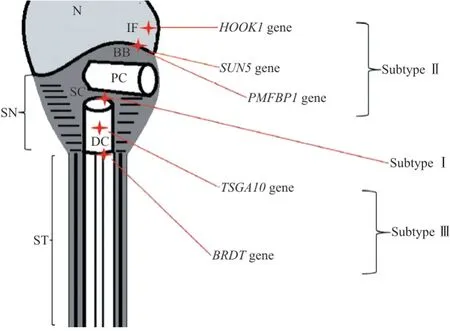
图2 无头精子症相关基因和亚型的模式图[11]
SUN5蛋白定位于精子头尾连接处的植入窝和核膜上,可能参与头尾黏连作用(将耦合装置与精子头部细胞核膜连接);PMFBP1蛋白定位于SUN5所在位置和节柱、小头之间,包含有染色质交联活性的重要功能结构域Smc;TSGA10蛋白定位于中心粒区域且可能参与中心粒功能。许多研究者认为,父系遗传的中心粒在胚胎发育中是必不可少的,因此导致精子没有近端中心粒的TSGA10突变会影响ICSI治疗中早期胚胎的发育[9,20,22]。但在本研究中,9例患者的受精率为85.79%,优胚率为55.03%,妊娠率为66.67%;10例患者有3例为TSGA10突变(P2、P3、P4),均已成功生育子代;且P3、P4、P8多年前已在我院通过ICSI成功生育第一胎,现为生育二胎再次来我院行ICSI治疗。分析P5、P6失败原因可能为子宫腺肌症、宫腔粘连术后、胰岛素抵抗等。因此,我们认为ICSI的成功率与患者携带的无头精子缺陷相关基因(TSGA10、SUN5、PMFBP1)变异、形态学表型无关。不同遗传变异引起的无头精子缺陷可能只影响精子形态,ICSI注入松散的精子头部或头尾连接异常的精子,均可以获得较为理想的受精率,并不影响早期胚胎质量和临床妊娠。同时,导致植入失败的女性因素不容忽视。
我们认为在治疗无头精子症时应注意以下几点。首先,ICSI可用于治疗无头精子症。成熟的精子头部在射精或获能后从尾部脱落。如果患者射出精液中没有精子头部,可从睾丸中收集精子来进行ICSI。第二,即使患者的正常形态精子百分率是0,100%的精子都是无头精子,仍然可以找到几个有完整头部的精子或松散的无尾精子头部。第三,确定高比例和单一类型精子畸形患者无头精子症相关的基因变异和形态学亚型在临床上仍然有一定意义。第四,应谨慎对待该实验结果,本研究涉及TSGA10、SUN5、PMFBP1三个基因,不可外推至其他基因。第五,在双等位杂合子/纯合子突变的无头精子患者及其配偶中筛选这些已知的致病基因,以避免将突变传递给后代。第六,如果配偶同时携带突变,在ICSI移植时可考虑优先女性胚胎[3,23],尽管ICSI可以解决无头精子症患者的生育问题,男性胚胎有50%的机会在成年后面临与父亲相同的不育问题。
综上所述,ICSI可用于治疗无头精子症,不同基因变异引起的无头精子缺陷可能只影响精子形态,可以获得较为理想的受精率。本研究的患者数量相当有限,仍有待进一步的全面研究,为今后无头精子症的治疗提供参考策略。

