补肾活血中药复方含药血清通过调节NCC和CLC-5对高盐诱导的体外NRK-52E细胞发挥保护作用*
莫 枢,孙柯焕,崔 琰,梅雯慧,彭勋潜,何海滨,彭博佳,朱晓峰,张荣华△
(暨南大学1附属第一医院中医科,2中医学院,3药学院,广东广州510630)
基于高浓度NaCl增加尿钙排泄的原因,高盐饮食成为骨质疏松的主要危险因素。研究显示摄入食盐量与尿钙的排泄呈正相关[1],长期高盐饮食所导致的尿钙排泄增加可以减少骨量,增加骨吸收,继而诱发骨质疏松或加重其发展[2-3]。
高盐饮食导致钠在肾小管的重吸收减少,进而平行减少了钙的重吸收。肾小管重吸收过程中,其分布的一些离子通路调节着机体的钙平衡,对骨代谢起着重要作用,如钠氯同向转运体NCC(Na-Cl cotransporter,NCC)和电压门控性氯离子通道5(voltage-gated chloride channels 5,CLC-5)[4-6]。NCC是一个具有同时转运钠、氯离子功能的协同转运蛋白,参与机体血压、血钾、酸碱平衡和尿钙排泄的调节[4-5]。抑制NCC可通过增加矿化结节的形成[7]及成骨细胞分化而提高骨密度[8]。CLC-5主要影响近端肾小管对氯离子的重吸收,影响尿钙排泄[6],其基因缺失将导致Dent′s病和X连锁隐性低磷性佝偻病,二者主要表现为高尿钙及佝偻病[9]。
补肾活血中药复方(nourishing kidney and activating blood recipe,NKABR)由淫养藿、杜仲、枸杞子、龟板、熟地、牛膝、当归和秦艽组成,具有补肾壮骨、活血止痛的功效。既往研究显示,补肾活血中药复方含药血清(nourishing kidney and activating blood recipe serum,NKABRS)能促进体外培养的大鼠骨髓间充质干细胞的骨向分化,并促进成骨细胞分化及矿化能力[10-11];动物实验证明NKABR能显著增加去卵巢骨质疏松模型大鼠的骨密度,提高大鼠血清中与骨重建相关因子的表达[12-13];在临床上NKABR可提高骨质疏松患者的骨密度,缓解骨痛症状[14],但以上研究均以“骨”为直接检验模型,基于“咸入肾,肾主骨,过咸伤骨”理论,本项工作以体外的大鼠肾小管上皮细胞NRK-52E作为研究模型,从“肾”方面对高浓度NaCl及NKABRS能否通过调控NCC和CLC-5发挥骨代谢影响作用进行探讨。
材料和方法
1 细胞
大鼠近端肾小管上皮细胞株NRK-52E购自中国科学院细胞库。
2 动物
SPF级2月龄雌性SD大鼠30只,体重180~200 g,购自济南朋悦实验动物繁育有限公司,生产许可证号为SCXK(鲁)2014-0007;动物饲养于暨南大学实验动物中心,许可证号为SCXK(粤)2017-0174。
3 药物
NKABR药物由淫养藿、杜仲、枸杞子、龟板、熟地、牛膝、当归和秦艽组成。补肾活血中药复方液体提取物(由广州博济医疗生物科技有限公司提取,批次编号:20150601)。
4 主要试剂
注射用青霉素钠(华北制药股份有限公司);氯化钠分析纯(广州化学试剂厂);胎牛血清(fetal bovine serum,FBS)为Biological Industries产品;DMEM低糖培养液(Gibco Life Technologies);CCK-8试剂盒和Annexin V-FITC/PI细胞凋亡试剂盒(Dojindo);BCA蛋白测定试剂盒(Thermo Fisher Scientifc);骨形态发生蛋白7(bone morphogenetic protein 7,BMP-7)和NCC抗体(Stress Marq);1α-羟化酶(CYP27B1)抗体(Rab MAb);骨桥蛋白(osteopontin,OPN)抗体(Affinity Biosciences);CLC-5抗体(Zen-Bio);GAPDH抗体和实验中所用Ⅱ抗(Cell Signaling Technology);RNA逆转录试剂盒(TaKaRa);免疫荧光试剂盒(碧云天生物技术研宄所)。
5 主要方法
5.1 NKABRS的制备取SPF级2月龄雌性SD大鼠30只,随机分为对照(control)组与NKABR组,每组各15只,以制备对照血清(control-serum,Control-S)和NKABRS。灌胃给药:参考既往研究文献[15],NKABR组予NKABR 23.4 g·kg-1·d-1灌胃,control组以等体积蒸馏水灌胃,连续灌胃7 d,每天1次。采取血清的方法参考既往研究文献[11]进行。
5.2 NRK-52E细胞的培养及药物干预NRK-52E细胞于37℃、5%CO2条件下,用含5%胎牛血清的DMEM低糖培养液(NaCl浓度为0.11 mol/L)培养,实验前应用无血清培养液同步化24 h。后续实验分4部分进行。第一部分,NaCl对细胞活力的影响:细胞分为对照(control)组、0.15 mol/L NaCl组、0.25 mol/L NaCl组、0.35 mol/L NaCl组和0.45 mol/L NaCl组,培养后测定细胞活力。第二部分,NKABRS对细胞活力的影响:NKABRS浓度参考既往研究文献[10-11],细胞分为control组(加入等体积含5%FBS的DMEM低糖培养液)、Control-S组(分别加入等体积含3%、5%、7%、9%Control-S的DMEM低糖培养液)、NKABRS组(分别加入等体积含3%、5%、7%、9%NKABRS的DMEM低糖培养液)、NaCl组(加入等体积含0.25 mol/L NaCl的DMEM低糖培养液)、NaCl+NKABRS组(加入等体积含0.25 mol/L NaCl和5%FBS的DMEM低糖培养液),培养后测定细胞活力。第三部分,NKABRS(3%)及NaCl(0.25 mol/L)对细胞的影响:细胞分为control组、NaCl组及NaCl+NKABRS组,加入相应培养液干预细胞24 h。第四部分,NCC和CLC-5基因沉默处理分组:NCC基因沉默后,细胞分为control组、NaCl(0.25 mol/L)组、NaCl+NKABRS(3%)组、si-NC+NaCl+NKABRS组(在转染阴性对照siRNA的细胞中加入等体积含0.25 mol/L NaCl和3%NKABRS的DMEM低糖培养液)、si-NCC+NaCl+NKABRS组(在转染NCC siRNA的细胞中加入等体积含0.25 mol/L NaCl和3%NKABRS的DMEM低糖培养液),细胞均干预培养24 h;CLC-5基因沉默后,细胞分为control组、si-NC+0.11 mol/L NaCl组(在转染阴性对照siRNA的细胞中加入等体积含0.11 mol/L NaCl和5%FBS的DMEM低糖培养液)、si-CLC-5+0.11 mol/L NaCl+NKABRS组(在转染CLC-5 siRNA的细胞中加入等体积含0.11 mol/L NaCl和3%NKABRS的DMEM低糖培养液),各组细胞均干预24 h。
5.3 CCK-8检测NRK-52E细胞活力细胞以1×107/L的密度接种于96孔板,每组设5个复孔。药物作用6、12和24 h后每孔加入10μL CCK-8溶液,37℃孵育2 h,使用酶标仪(Bio-Rad)检测450 nm处吸光度(A)值。并用SPSS软件计算(Bliss法)24 h细胞半数致死量(LD50)。
5.4 流式细胞术检测细胞凋亡率0.05%胰蛋白酶消化各组细胞(1×106)并收集至离心管中,加入5%FBSDMEM低糖培养液重悬细胞,于高速台式冷冻离心机离心,并抽弃上清液后用预冷的PBS洗涤细胞,高速台式冷冻离心机离心并抽弃上清液,加入300μL的1×Binding Buffer结合缓冲液重悬细胞,加入5μL的Annexin V-FITC溶液均匀混合,于25℃下避光静置15 min。使用流式细胞仪(FACSAria,Becton Dickinson)检测前加入5μL的PI溶液染色5 min,。
5.5 细胞转染及验证siRNA由广州维伯鑫生物科技股份有限公司根据NCC和CLC-5的基因序列设计并合成。基因序列如下:CLC-5 siRNA-1:5′-GGACCUAUGAUGAUUUCdTdT-3′;CLC-5 siRNA-2:5′-CCGCUCCAUCAAUCCAUdTdT-3′;CLC-5 siRNA-3:5′-CCACUUCAACACUAGCadTdT-3′;NCC siRNA-1:5′-CCUACGAACACUACGCudTdT-3′;NCC siRNA-2:5′-CCAGGUGCUGU CUUUCdTdT-3′;NCC siRNA-3:5′-GGUCAUCAUGUUCCUGCdTdT-3′。
抽弃6孔板中原有培养液,每孔用2 mL新鲜培养液代替。25℃下均匀混合125μL DMEM低糖培养液和各组siRNA后加入4μL Lipofectamine 8000转染试剂均匀混合。将该混合物逐滴加入各组细胞中,37℃培养48 h。RT-qPCR鉴定siRNA是否转染成功。
5.6 免疫荧光检测CLC-5、NCC和OPN的蛋白含量及分布4%甲醛溶液固定细胞10 min,100%冰乙醇室温封闭1 h。免疫染色洗涤液洗涤3次,加入NCC(1∶200)、CLC-5(1∶100)Ⅰ抗4℃孵育过夜。免疫染色洗涤液洗涤3次,Cy3荧光标记Ⅱ抗(1∶1 000)室温避光轻摇孵育1 h。抽弃Ⅱ抗,加入细胞染色液DAPI,室温避光染色5 min。PBS避光洗涤3次。滴加抗荧光淬灭剂,封片。使用倒置荧光显微镜(Leica)、Imaris 4.0软件获取细胞的荧光图像。
5.7 RT-qPCR检测CLC-5、NCC、BMP-7、CYP27B1和OPN的mRNA表达PBS洗涤细胞2次,用Trizol试剂提取总RNA。使用分光光度计检测细胞RNA纯度(每样品A260/A280比在1.8~2.1之间)。每组取2 μg的总RNA反转录为cDNA。使用iQTM5系统(Bio-Rad)与SYBRGreen试剂一式三份进行qPCR分析。使用特异引物,每25μL反应中总共添加100 ng总RNA。引物的序列如下:BMP-7正向引物序列为5′-AGTGGAGCACGACAAGGAAT-3′,反向引物序列为5′-TAGATCCTGAACTCGGCTGC-3′;CYP27B1正向引物序列为5′-CCCAGCTACCCCTGCTAAAG-3′,反向引物序列为5′-TCTGCCAAGCGTCTCCCTAT-3′;NCC正向引物序列为5′-TTGGAAGGAAGGGGAAGTGC-3′,反向引物序列为5′-CTGCCACACTGGACATCACT-3′;CLC-5正向引物序列为5′-ATGATGCCCACATCCGTCTC-3′,反向引物序列为5′-CGGGGCTT-CATCACATCCAT-3′;OPN正向引物序列为5′-AGCCATGAGTCAAGTCAGCT-3′,反向引物序列为5′-ACTCGCCTGACTGTCGATAG-3′;内参照GAPDH正向引物序列为5′-TGTGTCCGTCGTGGATCTGA-3′,反向引物序列为5′-TTGCTGTTGAAGTCGCAGGAG-3′。执行以下循环条件:95℃2 min;94℃20 s,58℃20 s,72℃20 s,40个循环。使用2-ΔΔCt定量方法分析mRNA表达量。
5.8 Western blot法检测CLC-5、NCC、BMP-7、1α-羟化酶和OPN的蛋白表达预冷的PBS洗涤细胞2次,在冰上用预冷的细胞裂解缓冲液RIPA裂解细胞后提取总蛋白,BCA法定量蛋白浓度并将其调整一致。每泳道予等量的蛋白质(30μg)通过SDS-PAGE后分离并转移至PVDF膜。用含有0.05%Tween-20和5%脱脂奶粉的缓冲液轻摇封闭PVDF膜1 h,加入目标蛋白Ⅰ抗(1∶1 500)4℃孵育过夜。次日洗膜后加入Ⅱ抗(1∶3 000)室温轻摇孵育1 h。洗膜后滴加超敏发光试剂显色,凝胶成像系统(Bio-Rad)显影。采用Quantity One软件进行分析处理,以目标蛋白与内参照β-actin的灰度值比值做统计分析。
6 统计学处理
使用SPSS16.0统计软件进行统计分析,数据均采用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用最小显著性差异法(LSD法),以P<0.05为差异有统计学意义
结 果
1 NaCl与NKABRS对细胞活力的影响
各浓度的NaCl处理NRK-52E细胞后,CCK-8结果表明,0.25 mol/L、0.35 mol/L和0.45 mol/L NaCl组在药物作用12和24 h后细胞活力下降(P<0.01),见图1A。计算24 h的NaCl中位致死剂量(LD50)约为0.25 mol/L,因此选择0.25 mol/L作为后续研究中高浓度NaCl的实验浓度。
分别采用3%、5%、7%和9%浓度的Control-S和NKABRS处理细胞后,CCK-8结果表明,与相同浓度的Control-S组相比,3%和5%NKABRS处理细胞24 h后细胞活力提高(P<0.01),且3%NKABRS组细胞活力显著高于5%NKABRS组(P<0.05),见图1B。因此选择3%为后续实验中NKABRS的实验浓度。
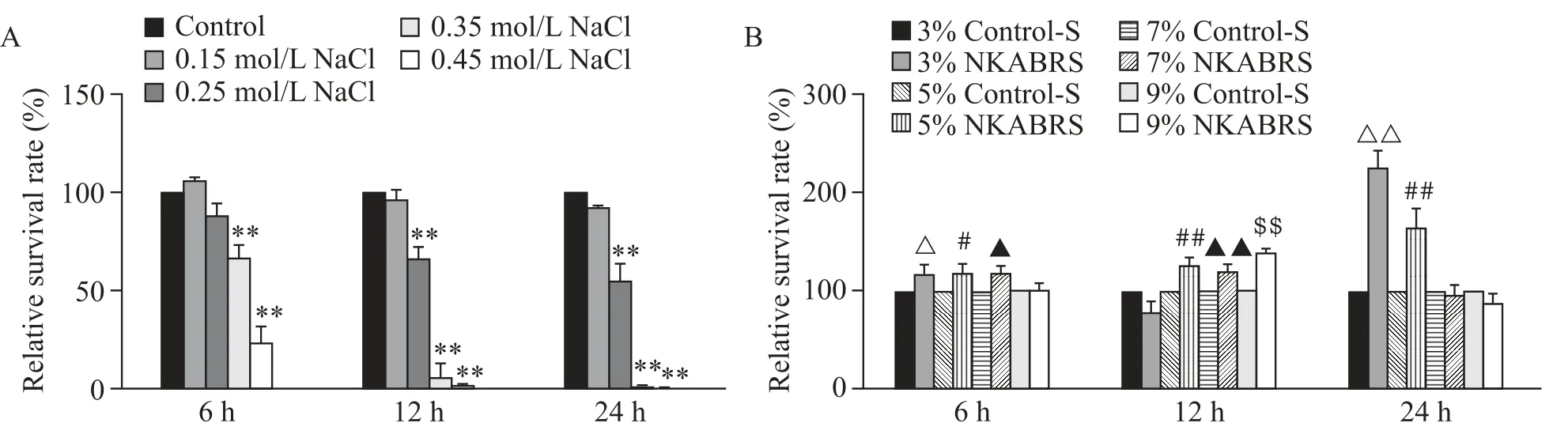
Figure 1.Effects of NaCl and NKABRSon cell viability.A:effects of different concentration of NaCl on cell viability;B:effects of different concentration of NKABRSon cell viability.Mean±SD.n=6.**P<0.01 vs control group;△P<0.05 vs3%Control-S group;#P<0.05,##P<0.01 vs5%Control-Sgroup;▲P<0.05,▲▲P<0.01 vs7%Control-Sgroup;$$P<0.01 vs9%Control-Sgroup.图1 NaCl与NKABRS对细胞活力的影响
2 NKABRS和高浓度NaCl对细胞内OPN表达及细胞凋亡的影响
光镜下观察细胞显示,control组和NKABRS组细胞呈扁平不规则的多角形;NaCl组细胞形态变为长梭形,细胞间连接减少,大部分细胞与周围细胞脱离,皱缩悬浮于培养液中;与NaCl组相比,NaCl+NKABRS组的细胞皱缩脱离显著减少,见图2A。流式细胞仪检测结果表明,与control组相比,各组细胞凋亡率均增加(P<0.05);与NKABRS组相比,NaCl组及NaCl+NKABRS组的细胞凋亡率增加(P<0.01);与NaCl组相比,NaCl+NKABRS组的细胞凋亡率减少(P<0.01),见图2B、C。CCK-8结果表明,与control组相比,NKABRS组细胞活力提高(P<0.05),NaCl组的细胞活力下降(P<0.01);与NKABRS组相比,NaCl组及NaCl+NKABRS组的细胞活力均下降(P<0.01);与NaCl组相比,NaCl+NKABRS组细胞活力升高(P<0.01),见图2D。
RT-qPCR和Western blot结果表明,与control组相比,NKABRS组OPN mRNA和蛋白表达减少(P<0.01),NaCl组和NaCl+NKABRS组OPN mRNA和蛋白表达增加(P<0.01);与NKABRS组相比,NaCl组和NaCl+NKABRS组OPN mRNA和蛋白增加(P<0.01);与NaCl组相比,NaCl+NKABRS组OPNmRNA和蛋白减少(P<0.01),见图2E。
3 NKABRS和高浓度NaCl对细胞内CYP27B1、BMP-7、NCC和CLC-5的影响
RT-qPCR和Western blot结果表明,与control组相比,NaCl组CYP27B1、BMP-7和CLC-5 mRNA及蛋白表达减少(P<0.01),NCCmRNA和蛋白表达增加(P<0.01);与NaCl组 相 比,NaCl+NKABRS组CYP27B1、BMP-7和CLC-5 mRNA及蛋白表达增加(P<0.01),NCC mRNA和蛋白表达减少(P<0.01),见图3A、B。免疫荧光结果表明,与control组相比,NaCl组NCC的荧光强度增强,CLC-5的荧光强度减弱(P<0.01);与NaCl组相比,NaCl+NKABRS组NCC的荧光强度减弱,CLC-5的CY3荧光强度增强(P<0.01),见图3C、D。
4 siRNA沉默NCC和CLC-5基因模型构建
三种不同浓度(25、50、100 nmol/L)的siRNA(si-NCC 1/2/3和si-CLC-5 1/2/3)对NRK-52E细胞进行转染后,RT-qPCR结果表明,与si-NC(NCC/CLC-5)组相比,除25 nmol/L浓度的si-NCC 3组外,其余各组NCC及CLC-5 mRNA表达均减少(P<0.01),见图4。本研究选择100 nmol/L浓度的si-NCC 1及si-CLC-5 1转染组的细胞进行后续研究。
5 沉默NCC和CLC-5基因后NKABRS和高浓度NaCl对细胞BMP-7、CYP27B1和OPN表达的影响
沉默NCC基因后,RT-qPCR结果表明:与si-NC+0.25 mol/L NaCl组相比,si-NCC+0.25 mol/L NaCl组的OPNmRNA表达减少(P<0.01),CYP27B1和BMP-7 mRNA表达增加(P<0.01);与si-NC+0.25 mol/L NaCl+NKABRS组相比,si-NCC+0.25 mol/L NaCl+NKABRS组的CYP27B1和BMP-7 mRNA增加(P<0.05);与si-NCC+0.25 mol/L NaCl组相比,si-NCC+0.25 mol/L NaCl+NKABRS组的CYP27B1和BMP-7的mRNA增加(P<0.01),见图5A。
前部分研究显示,control组的细胞CLC-5表达高于NaCl(0.25 mol/L)处理组(P<0.01),见图3。细胞CLC-5基因沉默将抑制CLC-5表达,因此在CLC-5基因沉默后我们予0.11 mol/L NaCl干预细胞以尝试促进细胞CLC-5的表达增加,进而观察CLC-5和NKABRS对细胞的调节作用。沉默CLC-5基因后,RTqPCR结果表明:与si-NC+0.11 mol/L NaCl组相比,si-CLC-5+0.11 mol/L NaCl组的OPN mRNA表达增加(P<0.01);与si-NC+0.11 mol/L NaCl+NKABRS组相比,si-CLC-5+0.11 mol/L NaCl+NKABRS组的OPN mRNA表达增加(P<0.01);与si-CLC-5+0.11 mol/L NaCl组相比,si-CLC-5+0.11 mol/L NaCl+NKABRS组的OPN mRNA表达减少(P<0.01)。与si-NC+0.11 mol/L NaCl组相比,si-CLC-5+0.11 mol/L NaCl组的CYP27B1和BMP-7 mRNA表达减少(P<0.01);与si-NC+0.11 mol/L NaCl+NKABRS组相比,si-CLC-5+0.11 mol/L NaCl+NKABRS组的CYP27B1和BMP-7 mRNA表达减少(P<0.01);与si-CLC-5+0.11 mol/L NaCl组相比,si-CLC-5+0.11 mol/L NaCl+NKABRS组的CYP27B1和BMP-7 mRNA表达增加(P<0.01),见图5B。
讨 论
现代医学研究显示,高盐摄入可以影响骨代谢,减少骨量和骨密度,与传统医学“咸入肾,肾主骨,过咸伤骨”理论相符合,但具体分子机制尚未完全阐明。现代学者对肾藏象理论中肾和骨的联系也进行了总结与描述,研究显示与肾脏相关的作用于骨骼的细胞因子中,肾小管内的BMP-7和骨化三醇参与不同阶段的骨形成、重塑和修复,在骨代谢中起着至关重要的作用[16-17]。高盐饮食引起的高尿钙排泄被认为是骨质疏松的关键诱因之一,近年来研究发现肾小管内的NCC和CLC-5通过对钠、氯离子的调节而影响尿钙排泄,与骨代谢密切相关[4-6]。因此肾小管内的影响骨代谢的细胞因子及离子通路可能是探索“咸入肾,肾主骨,过咸伤骨”理论的途径之一。
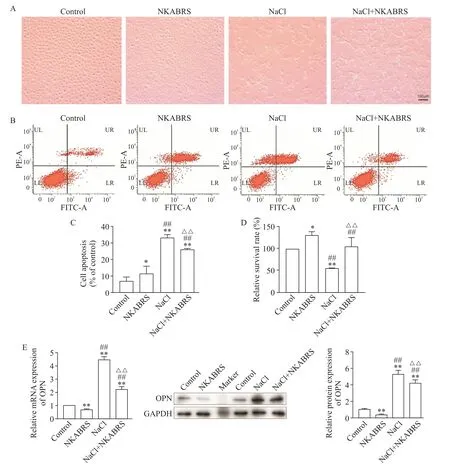
Figure 2.Effects of NKABRSand high concentration of NaCl on the OPN expression and cell viability and apoptosis of NRK-52E cells.A:the microscopic images showed that the cells in the control group and the NKABRSgroup were irregular polygons(Scale bar=100μm),the cells in the NaCl group were long and spindle shaped,the connection between cells reduced,and most cells shrunk and were suspended in the culture solution,the cells shrinkage and shedding of the NaCl+NKABRS group was significantly reduced,compared with the NaCl group;Band C:the apoptosis of cultured NRK-52Ecells was determined by flow cytometry;D:effects of NKABRSand high concentration of NaCl on cell viability;E:the expression of OPN mRNA and protein.Mean±SD.n=6.*P<0.05,**P<0.01 vs control group;##P<0.01 vs NKABRSgroup;△△P<0.01 vs NaCl group.图2 NKABRS和高浓度NaCl对细胞OPN mRNA、蛋白表达和细胞凋亡的影响

Figure 3.Effects of NKABRSand high concentration of NaCl on the mRNA and protein expression of CYP27B1,BMP-7,NCCand CLC-5 in NRK-52E cells.A:the protein expressions of CYP27B1,BMP-7,NCCand CLC-5;B:the mRNA expressions of CYP27B1,BMP-7,NCCand CLC-5;Cand D:the distribution of NCCand CLC-5 protein was determined by immunofluorescence(Scale bar=50μm).Mean±SD.n=6.**P<0.01 vs control group;##P<0.01 vs NaCl group.图3 NKABRS和高浓度NaCl对细胞CYP27B1、BMP-7、NCC和CLC-5 mRNA及蛋白表达的影响

Figure 4.Relative mRNA expression of NCCand CLC-5 after transfection.Mean±SD.n=6.*P<0.05 vs the siRNA NCgroup.图4转染后细胞NCC和CLC-5 mRNA的表达变化
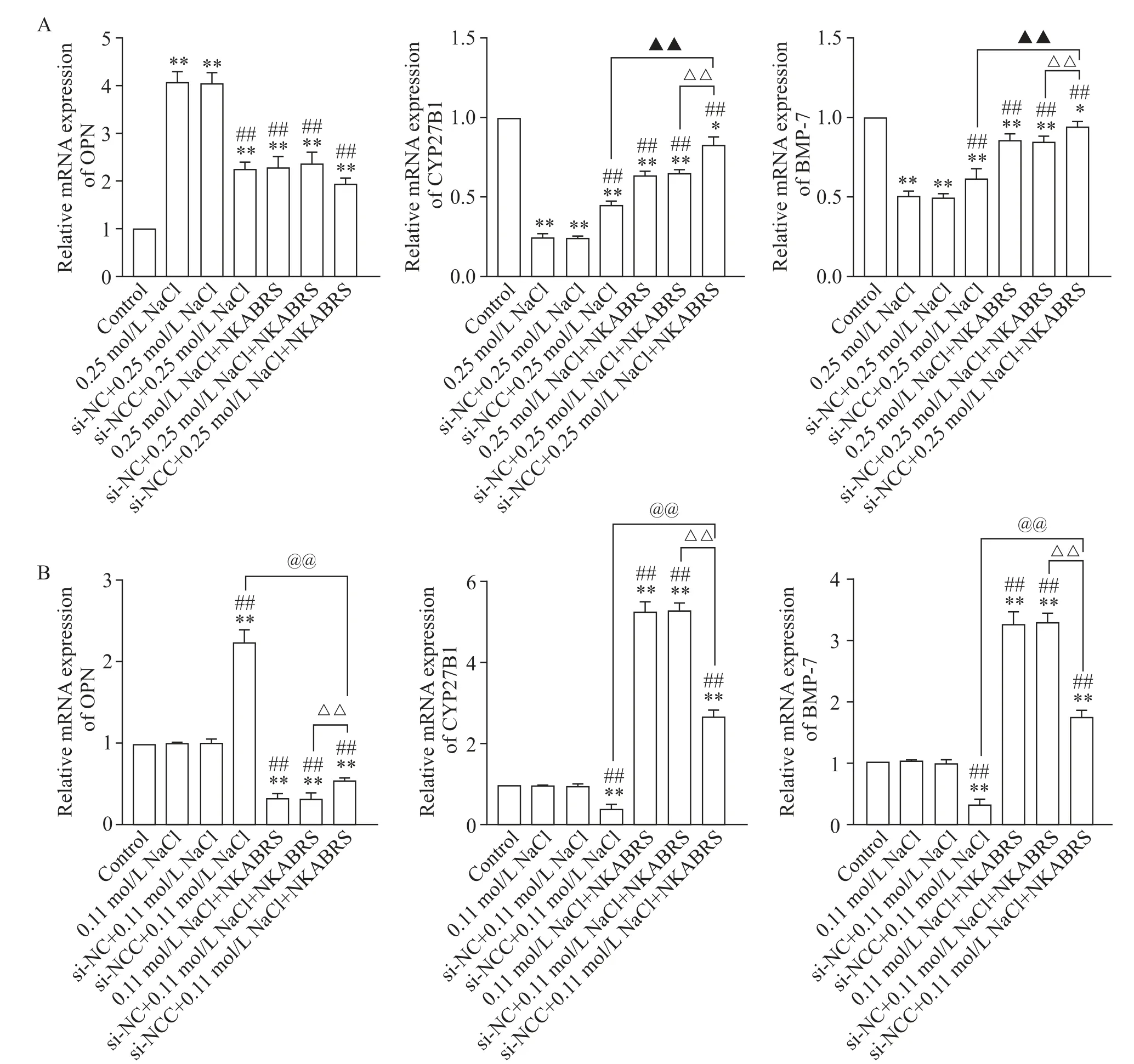
Figure 5.Effects of NKABRSand high concentration of NaCl on the mRNA expression of BMP-7,CYP27B1 and OPN after NCC(A)and CLC-5(B)gene silencing in NRK-52Ecells.Mean±SD.n=6.*P<0.05,**P<0.01 vs control group;##P<0.01 vs NaCl group;▲▲P<0.01 vs si-NCC+0.25 mol/L NaCl group;△△P<0.01 vs si-NC+NaCl+NKABRSgroup;@@P<0.01 vs si-CLC-5+0.11 mol/L NaCl group.图5 沉默NCC和CLC-5基因后NKABRS和高浓度NaCl对细胞BMP-7、CYP27B1和OPN mRNA表达的影响
肾小管上皮细胞的健康和正常表型对于尿钙排泄十分重要,钙稳态可能会受到肾脏损伤的严重影响[18]。肾脏中的OPN蛋白是肾小管上皮细胞的生存因子和肾小管间质损伤的早期标志物[19]。本研究显示高浓度(0.25 mol/L)NaCl可增加体外NRK-52E细胞的OPN表达,并降低细胞活力,诱导细胞凋亡;而NKABRS可显著抑制高浓度NaCl作用下OPN的表达水平,提高细胞活力并减少细胞凋亡率,表明高浓度NaCl可以损伤体外NRK-52E细胞并诱导其凋亡,而NKABRS可对细胞产生保护作用。关于高盐对肾脏的损伤作用,研究显示高盐饮食对肾脏具有血流动力学改变之外的独立损害作用[20-22],其中肾小管上皮-间充质转化(epithelialmesenchymal transition,EMT)导致的肾纤维化对肾损害影响尤为显著[22]。OPN亦是肾纤维化的启动因子[23],而BMP-7除了是骨骼生长的调节因子,还是维持肾小管上皮细胞正常表型的重要调节因子[24]。在各种急性肾损伤或慢性肾纤维化动物模型中BMP-7的表达均显著降低,且BMP-7的升高还可抑制EMT[25-26]。此外有研究报道CLC-5可能是治疗肾纤维化的新型治疗靶标,体外的人肾小管上皮细胞和小鼠肾皮质内的CLC-5过表达可以阻止EMT[27]。本研究显示,高浓度NaCl可抑制体外NRK-52E细胞BMP-7和CLC-5的表达,而NKABRS可部分阻抑高浓度NaCl对细胞BMP-7和CLC-5表达的影响。且本研究中高浓度NaCl处理体外NRK-52E细胞后,细胞变为长锤形且细胞间连接减少,这与肾小管上皮细胞的EMT形态一致,而NKABRS可部分抑制细胞骨架的改变。以上结果表明,高浓度NaCl可诱导体外NRK-52E细胞损伤,并可能诱导或加剧EMT进程,而NKABRS可抑制NRK-52E细胞的损伤及EMT进程。
BMP-7和1-α羟化酶被认为是“肾主骨”理论的物质基础[16-17],二者对骨密度的增加起着关键作用。机体发育所必须的BMP-7主要由肾脏合成[20],在外髓质小管中表达最高[28],并通过血液循环以激素样方式作用于远处骨组织[29]。1α-羟化酶主要存在于肾近曲小管上皮细胞内,是骨化三醇羟化的关键酶[30],由CYP27B1基因编码[31]。体内的维生素D必须被1α-羟化酶羟化才可合成骨化三醇并具有调节骨代谢的生理作用[32]。本研究显示,高浓度NaCl可抑制体外NRK-52E细胞BMP-7和1α-羟化酶的表达,而NKABRS可显著提升高浓度NaCl作用下的BMP-7和1α-羟化酶水平。BMP-7和1α-羟化酶主要在肾小管中表达,二者在肾小管上皮细胞内的表达减少将导致其在机体中的表达量相应减少。本研究提示,高盐可能通过下调肾小管上皮细胞内BMP-7及1α-羟化酶水平而抑制机体内其二者对骨密度的正向调节作用,而NKABRS可能通过提高肾小管上皮细胞内的BMP-7和1α-羟化酶水平发挥对骨密度的保护作用。此外本研究中,高浓度NaCl亦影响了体外NRK-52E细胞内的离子通路NCC和CLC-5。NCC具有同时转运钠、氯离子的功能,在肾小管中负责钠钙离子的重吸收,参与调节机体骨矿化及尿钙排泄[4,33],而CLC-5参与氯离子的重吸收并影响尿钙排泄[6,34]。本研究显示,高浓度NaCl可增加体外NRK-52E细胞内NCC水平并降低CLC-5水平,而NKABRS可显著抑制高浓度NaCl所诱导的NCC过表达并升高CLC-5水平。现已明确NCC过表达或抑制CLC-5可导致机体尿钙排泄增加,而为了维持血钙浓度机体将释放骨钙,最终导致骨密度降低。以上结果提示,高浓度NaCl可能通过诱导肾小管上皮细胞内NCC过表达并抑制CLC-5表达导致机体尿钙排泄增加进而影响骨密度,NKABRS可能通过抑制NCC过表达并上调CLC-5表达从而防治高盐饮食所引起的骨密度减少。
为了进一步探究NKABRS作用下NCC和CLC-5在肾小管上皮细胞高盐损伤中的作用以及与BMP-7、1α-羟化酶之间的关系,本研究在体外NRK-52E细胞内敲减了NCC和CLC-5基因。本研究证实抑制NCC可抑制高浓度NaCl所诱导的OPN高表达,并逆转高浓度NaCl诱导的BMP-7和1α-羟化酶低表达,而NKABRS可进一步上调1α-羟化酶和BMP-7表达。抑制CLC-5可增加OPN表达并降低BMP-7和1α-羟化酶的表达水平,而NKABRS可抑制OPN表达并上调BMP-7和1α-羟化酶的表达水平。1α-羟化酶表达水平的降低与前期研究[35-36]中CLC-5基因敲除小鼠模型的实验结果相符合,但与一部分动物和临床实验结果相反[37-38],有研究认为这是由于体内实验中尿钙的提高刺激肠道钙吸收而间接导致的[39]。因此,体内外实验中CLC-5对1α-羟化酶的调节作用可能有所差异,仍需进一步验证。
综上所述,本研究证明高浓度NaCl可通过诱导体外NRK-52E细胞的NCC过表达并下调CLC-5表达以调节OPN、BMP-7和1α-羟化酶表达水平,从而诱导细胞损伤并加速EMT进程,而肾小管上皮细胞内骨代谢相关因子的表达减少在机体中可能会导致骨密度降低;NKABRS可通过抑制NCC和OPN表达并上调CLC-5、BMP-7和1α-羟化酶表达对高浓度NaCl作用下的体外NRK-52E细胞产生保护作用。这为高盐通过肾小管上皮细胞影响骨密度的作用机制以及NKABRS在其中的防治作用提供了参考资料。
- 中国病理生理杂志的其它文章
- ERK信号通路介导的EP300过表达在苯肾上腺素诱导小鼠心肌细胞肥大中的作用*
- 益肾通络方对大鼠勃起功能障碍及NO-cGMP通路的影响*
- 静脉注射SCAD重组腺病毒减轻自发性高血压大鼠心肌肥厚和纤维化*
- Thioredoxin-interacting protein contributesto cardiac fibrosisby elevating oxidative stress in cardiac fibroblasts*
- 延髓头端腹内侧部NADPH氧化酶2激活导致活性氧簇释放在皮肤/肌肉切开和牵拉引起的慢性术后疼痛中的作用*
- 干扰海马spastin表达通过抑制突触传递介导小鼠认知功能障碍*

