血糖控制水平对冠心病患者氯吡格雷抵抗的影响
苏嘉 周宏林 郁清琳 陈晓敏
血小板激活、聚集所导致的血栓形成,是动脉粥样硬化性疾病,尤其是急性冠脉综合征(acute coronary syndrome,ACS)的主要过程。抗血小板治疗是患者经皮冠状动脉介入(percutaneous coronary intervention,PCI)术后治疗的基石。抗血小板药物氯吡格雷通过抑制血小板膜上的二磷酸腺苷(adenosine diphosphate,ADP)受体P2Y12,减少ADP诱导的血小板聚集,降低冠心病患者再发心血管事件的风险[1]。但是,大量患者仍会持续出现缺血性事件[2],这与血小板抑制程度偏低相关。临床将这种氯吡格雷不能有效抑制血小板聚集和活化,导致心血管不良事件发生的现象,称为氯吡格雷抵抗(clopidogrel resistance,CR)。影响CR的因素有很多,糖尿病可能是导致CR的重要原因。本研究检测冠心病PCI术后患者的血小板功能,分析血糖控制水平与CR之间的关系,现将结果报道如下。
1 对象和方法
1.1 对象选择2014年1月至2017年12月在宁波市第一医院心内科住院行PCI治疗的冠心病患者206例,依据血小板功能检测结果,将其分为CR患者(CR组)85例和非CR患者(NCR组)121例。CR组男61例,女24例,年龄51.2~78.5(64.8±12.5)岁;NCR组男93例,女28例,年龄52.6~75.7(63.5±11.9)岁。依据患者是否合并糖尿病,将患者分为糖尿病组83例和非糖尿病组123例,糖尿病组男63例,女20例,年龄53.4~78.4(65.8±11.6)岁;非糖尿病组男91例,女32例,年龄51.3~77.2(62.8±10.3)岁。将糖尿病组患者依据血小板功能的差异,分为糖尿病CR亚组42例及糖尿病NCR亚组41例,糖尿病CR亚组男33例,女9例,年龄54.1~78.4(64.9±10.8)岁;糖尿病NCR亚组男30例,女11例,年龄53.2~75.3(63.5±11.8)岁。CR组、NCR组,糖尿病组、非糖尿病组,糖尿病CR亚组、糖尿病NCR亚组患者性别、年龄比较,差异均无统计学意义(均P>0.05)。纳入标准:(1)经皮冠状动脉造影提示心脏左主干、左前降支、旋支、右冠状动脉中存在1支或以上血管狭窄程度>70%;(2)1个月内接受过PCI治疗;(3)进行规律的抗血小板治疗。排除标准:(1)1型糖尿病;(2)合并未控制的高血压、风湿性疾病,严重的肺、肝、肾疾病;(3)高热、肿瘤、严重水电解质紊乱、免疫系统或血液系统疾病;(4)纽约心脏协会(New York Heart Disease Assocation,NYHA)心功能分级>Ⅲ级;(5)严重出血倾向;(6)资料不全。本研究经过医院医学伦理委员会批准,患者或其家属均签署知情同意书。
1.2 方法
1.2.1 治疗方法(1)规律的抗血小板治疗:均采用双联抗血小板治疗,具体方案如下:采用阿司匹林肠溶片(商品名:拜阿司匹林,规格:100 mg/片,国药准字:J20171021,拜耳医药保健有限公司)及硫酸氢氯吡格雷片(商品名:波立维,规格:75mg/片,国药准字:J20180029,赛诺菲杭州制药有限公司),负荷剂量:阿司匹林肠溶片300 mg+硫酸氢氯吡格雷片300 mg,维持剂量:阿司匹林肠溶片100 mg+硫酸氢氯吡格雷片75 mg,1次/d,持续1年。(2)强化血糖治疗:采用甘精胰岛素(商品名:来得时,规格:3 mL∶300 U,国药准字:J20140052,赛诺菲北京制药有限公司)1次/d及赖脯胰岛素(商品名:优泌乐,规格:3 mL∶300 U,国药准字:J20140152,礼来苏州制药有限公司)3次/d,根据实际血糖调整剂量,持续6个月。
1.2.2 一般资料采集及血小板功能指标检测规律抗血小板治疗30 d后,采集患者的一般资料,包括高血压病、糖尿病、高脂血症、吸烟、饮酒、体重指数(body mass index,BMI)等一般资料。同时,采用美国Accumetrics公司VerifyNow P2Y12检测仪评估患者的血小板功能指标,包括血小板活性单位(platelet reactivity unit,PRU)和血小板抑制率。将PRU≥240反应单位定义为存在CR[3]。
1.2.3 血糖控制水平指标检测规律抗血小板治疗30 d后,采用葡糖糖氧化酶法、免疫透射比浊法和微粒子化学发光法,检测糖尿病组血糖控制水平指标,包括空腹血糖、空腹胰岛素、空腹C肽、餐后2 h血糖、餐后2 h胰岛素、餐后2 h C肽、糖化血红蛋白等。
1.2.4 强化血糖治疗后糖尿病CR亚组血小板功能指标及血糖控制水平指标检测糖尿病CR亚组在强化血糖治疗6个月后,再次检测血小板功能指标及血糖控制水平,观察血小板功能指标变化及血糖达标情况。
1.3 统计学处理 采用PASW Statistics 18.0统计软件。计量资料以表示,比较采用t检验。计数资料以百分率表示,比较采用χ2检验或Fisher精确概率检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者的一般资料及血小板功能指标比较见表1。
由表1可见,CR组糖尿病患者比例、PRU水平高于NCR组,血小板抑制率低于NCR组,差异均有统计学意义(均P<0.05)。两组其余项目比较,差异均无统计学意义(均P>0.05)。
2.2 治疗30 d后糖尿病组、非糖尿病组患者血小板功能指标的比较见表2。
由表2可见,与非糖尿病组比较,糖尿病组患者发生CR的概率更高,血小板抑制率更低,差异均有统计学意义(均P<0.05)。两组患者PRU比较,差异无统计学意义(P>0.05)。
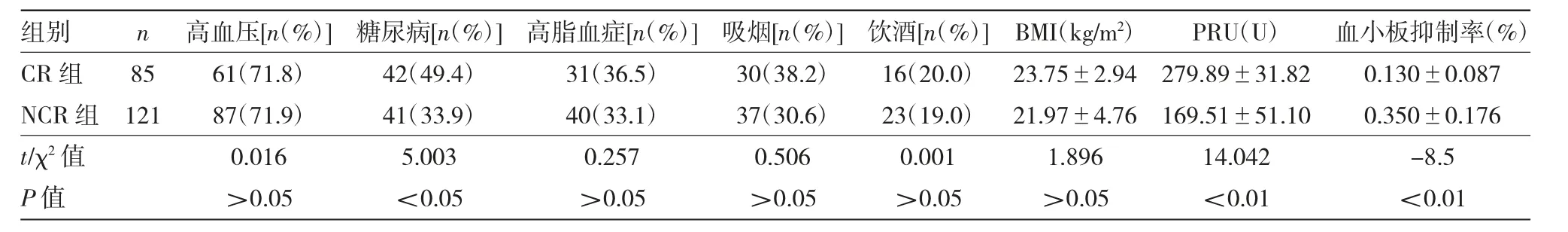
表1 两组患者的一般资料及血小板功能指标比较
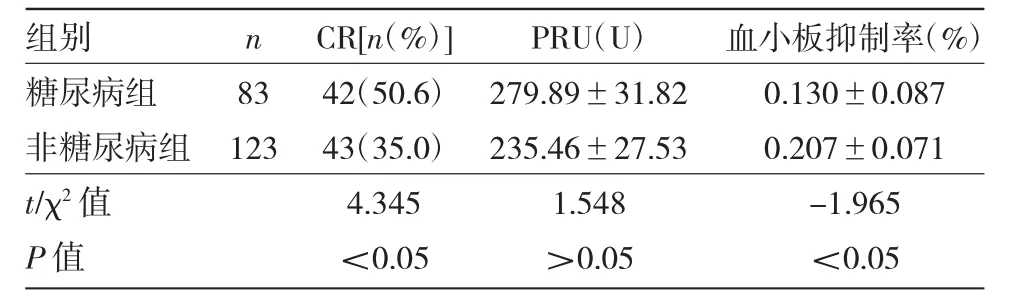
表2 治疗30 d后糖尿病患者和非糖尿病患者血小板功能指标的比较
2.3 治疗30 d后糖尿病CR亚组与糖尿病NCR亚组血糖控制水平指标比较见表3。
由表3可见,与糖尿病NCR亚组比较,糖尿病CR亚组患者空腹胰岛素水平较低,餐后2 h血糖较高,两组比较差异有统计学意义(均P<0.05)。两组其它血糖控制水平指标比较,差异无统计学意义(均P>0.05)。
2.4 糖尿病CR亚组治疗前后血小板功能指标及血糖控制水平比较强化血糖治疗6个月后,糖尿病CR亚组空腹血糖为(7.03±1.56)mmol/L,餐后2 h血糖为(8.15±0.99)mmol/L,糖化血红蛋白为(6.34±0.52)%,PRU为(223.56±25.78)U,均较治疗前下降,血小板抑制率为(0.166±0.051)%,较治疗前上升,其中治疗前后餐后2 h血糖、糖化血红蛋白、PRU、血小板抑制率比较差异均有统计学意义(t=2.329、2.156、4.476、-2.759,均P<0.05)。
3 讨论
抗血小板治疗是冠心病治疗的基石,对降低冠心病患者再发心血管事件的危险至关重要。虽然新型抗血小板药物(普拉格雷和替格瑞洛)在临床中已开始应用,表现出了更加持续、快速、有效的P2Y12受体抑制作用[4];但是,在接受普拉格雷治疗的患者中,大出血的风险较氯吡格雷明显升高[5];同时,通过对出血事件的分层分析,发现:在应用替格瑞洛时,尤其是90 mg 2次/d时,研究定义的大出血和小出血事件的风险较氯吡格雷75 mg 1次/d时增加11%[6]。此外,大量的研究发现:东亚患者血栓形成和出血的风险预测因素与高加索人群不同,并且韩国学者Jeong等[7]提出了“东亚悖论”现象,即:在接受PCI的东亚患者中出现缺血事件的概率与白人相似甚至更低。因此,对于同属东亚的中国患者,氯吡格雷临床获益可能更为明显;在冠心病患者抗血小板治疗中,氯吡格雷依旧是一线用药。
多种临床因素会影响氯吡格雷抗血小板效应,包括糖尿病、肾功能减退、药物相互作用(如质子泵抑制剂)、吸烟、炎症状态、左心室射血分数下降、BMI的增加等[8-12]。而糖尿病作为心血管疾病的主要危险因素,在CR中可能起重要作用。与非糖尿病患者比较,糖尿病患者更易发生CR[13]。本研究也提示,糖尿病患者氯吡格雷的血小板抑制率偏低;而空腹胰岛素水平及餐后2 h血糖可能影响不同的抗血小板效应。此外,国外也有研究提出胰岛素抵抗是氯吡格雷治疗下血小板低反应的预测因素[14];同时,糖化血红蛋白与冠心病PCI术后氯吡格雷使用下的PRU相关[15]。如果血糖控制良好,则糖尿病患者的抗血小板效应明显改善。一项国外的研究也得出了类似的结论[8]。因此,糖尿病可能在CR中起关键作用。
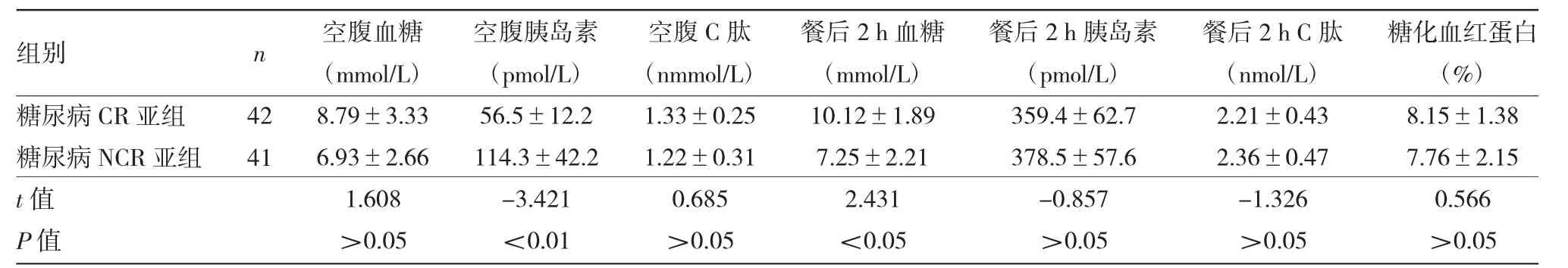
表3 治疗30 d后糖尿病CR亚组与糖尿病NCR亚组血糖控制水平指标比较
糖尿病患者CR的机制可能包括以下几个方面[16]:(1)胰岛素的异常分泌可导致血小板活性增加。有研究认为这与胰岛素受体底物相关,比如细胞间钙离子浓度的升高[8]。也有研究认为这与胰岛素受体底物无关,而是由一氧化氮(nitrogen oxide,NO)和前列环素I2(prostaglandin I2,PGI2)分子减少引起[16];(2)高血糖能够通过糖化血小板表面的蛋白(损伤细胞膜的流动性从而增加血小板的黏附)激活蛋白激酶C途径,进而诱导P选择素的表达,导致渗透效应;(3)代谢状态异常与糖尿病患者高血小板活性普遍相关,包括肥胖、血脂异常、系统性炎症反应等;(4)内皮细胞功能的紊乱是糖尿病的另一个主要特征,其会通过降低NO和PGI2的产生,释放组织因子,导致血栓前状态,从而增强血小板活性。此外,还有一些因素也会导致糖尿病患者血小板活性增加,如钙代谢调节紊乱、P2Y12受体通路的上调、ADP暴露的增加、血小板更新的增加、氧化应激等。
除此之外,遗传因素亦是导致CR的重要原因。一方面,有研究者从氯吡格雷代谢相关基因及其单核苷酸多态性(single nucleotide polymorphism,SNP)出发,发现十二指肠转运的ABCB1基因[17],肝脏代谢的CYP家族基因、PON-1基因,P2Y12基因等SNP会影响氯吡格雷的抗血小板反应。这其中,ABCB1 C3435T的多态性与ACS患者长期服用氯吡格雷后出现短期及中远期心血管事件相关[18-19]。而全基因组关联研究发现CYP2C19、PEAR1、N6AMT1等基因的遗传变异与氯吡格雷不同的抗血小板效应及临床终点事件的发生相关[20-21],其中CYP2C19这一靶点已写入临床指南;最新的一项韩国人群研究也再次确认了亚洲人群中CYP2C19对远期心血管事件的预测价值[22]。此外,对于糖尿病相关的基因研究发现:胰岛素可以通过血小板上的胰岛素受体底物1(insulin receptor substrate1,IRS1)调节血小板的活性;而IRS1的SNP(rs956115和rs13431554)与冠心病合并糖尿病患者在氯吡格雷使用下的高血小板活性和不良心血管事件的增加相关[23-24]。另一方面,表观遗传学的发展,为研究CR的机制提供了新的视角。近年来不少研究发现,DNA甲基化可能与CR存在联系。目前人们通过研究P2Y12基因及ABCB1启动子甲基化水平与CR的关系,发现他们之间存在相关性[25-26]。今后,更大规模、更加深入的表观研究(如转录水平的RNA m6A甲基化修饰、翻译水平的组蛋白修饰),有助于进一步明确其潜在的分子机制。
综上所述,糖尿病患者氯吡格雷的血小板抑制率偏低;而空腹胰岛素水平及餐后2 h血糖可能影响不同的抗血小板效应;如果血糖控制良好,则糖尿病患者的抗血小板效应明显改善。因此,糖尿病及其血糖控制水平可能是CR的危险因素。由于本研究中部分临床患者的降糖方案及并存疾病的药物使用存在一定的差异,因此结果可能会有混杂偏移,今后更大样本量的研究、精细的分层以及基础药理探索有助于我们进一步了解血糖控制在氯吡格雷抗血小板不同反应性中的作用,为临床实践提供理论支持和循证依据。