XAGE-1b在肝癌增殖侵袭中的生物学作用
门 慧 谈 顺
肝癌是常见的消化系统恶性肿瘤,发病率及死亡率均呈上升趋势,死亡率位居第三位[1],由于起病比较隐匿,大多患者难于早期发现,直至进展至中晚期才确诊。由于缺乏有效的监测手段,临床治疗手段如射频消融、肿瘤切除等都会受到不同程度限制,进而错过最佳治疗时机,严重影响患者预后及生存[2-3]。
查阅文献发现,XAGE-1属GAGE 家族,2000年,Liu等研究发现该基因定位于人染色体Xp11.21-Xp11.22上,全长611 bp,包括3个内含子和4个外显子,XAGE-1有4种转录异构体,依次为XAGE-1a、XAGE-1b、XAGE-1c和XAGE-1d,其中XAGE-1a、XAGE-1c 和 XAGE-1d表达谱较窄,XAGE-1b却具有较广泛表达谱、表达率及免疫原性而被广泛研究。XAGE-1b是主要的转录本存在形式,由于表达模式及序列具有相似性,亦属于CT(癌-睾丸)抗原家族[4-5]。XAGE-1b在除睾丸、胎盘、脑及卵巢组织以外的正常组织中几乎不表达[6],但在肿瘤组织中广泛表达,XAGE-1b表达见于黑色素瘤[7]、尤文氏肉瘤[4]、肺癌[8-10]、膀胱癌[10]、涎腺腺样囊性癌[11-12]、胃癌[13]、乳腺癌[13-14]、结直肠癌[15-16]、前列腺癌[17-18]、肝癌[19-21]。研究发现XAGE-1b在肝癌的有显著表达,与患者预后呈负相关,敏感度大于AFP监测[19-21],但XAGE-1b在肝癌的生物学作用至今没有报道。本研究将探讨XAGE-1b在肝癌增殖侵袭的作用,为肝癌患者治疗提供更深入的靶向依据。
1 材料与方法
1.1 材料
肝癌细胞株来自海口市人民医院,干扰载体购于广州锐博生物科技有限公司,1640细胞培养液、胎牛血清购于BI生物公司,0.25%消化细胞胰酶购自Life公司,Matrigel基质胶、Boyden小室购于美国BD公司,CCK-8检测试剂盒购于日本同仁公司,TRIzol、逆转录试剂盒、荧光定量试剂盒购于TaKaRa公司,4 ℃超速离心机购于Thermo公司。
1.2 方法
1.2.1 细胞培养 培养人肝癌细胞株需要含10%胎牛血清1640培养液,并放于37 ℃、5%CO2细胞培养箱,培养过程中注意无菌操作以及胰酶消化时间,待细胞状态佳时进行实验。
1.2.2 细胞转染干扰载体 XAGE-1b干扰片段(sense,5′-GCTGCATCAGTCAAACACC-3′),siRNA成品为粉末,先加入250 μl无菌DEPC水配制成10 μM/l工作液置于-20 ℃保存。选取生长状态良好细胞于前一天铺6孔板,细胞融合度达50%~70%,细胞贴壁后使用lipo2000转染,用opti-MEM培养基给细胞换液1.5 m/孔,配制A液及B液,各250 μl/孔,A液:245 μl optiMEM+5 μl lipo2000,B液:240 μl optiMEM+10 μl SiRNA。A液配好后室温静置孵育5 min,加到配好B液中混匀,孵育205 min,将混合液缓慢滴入6孔板中,置于37 ℃、5% CO2细胞培养箱培养4~6 h,更换含10%血清培基培养,24~48 h后提取RNA。
1.2.3 荧光定量PCR 培养细胞至细胞铺满瓶底,先吸出培养基,再用PBS洗1~2次,加入1 ml Trizol试剂进行冰上裂解(5 min),吹打细胞,再加入氯仿(0.2 ml氯仿/1 ml trizol)混匀吹打细胞,再冰上裂解2~3 min,将裂解液收集EP管中,4 ℃、12 000 rpm离心机离心15 min,吸取上层水相移并移至去酶的1.5 ml EP管,在剩余沉淀中加入等体积异丙醇,在室温中静置10 min,4 ℃、12 000 rpm离心机离心10 min,去除上清,留沉淀,沉淀物用已处理过的DEPC水配制成的75%乙醇进行洗涤,4 ℃、12 000 rpm离心机离心5 min,重复1遍,室温放置至沉淀自然干燥,加入适量DEPC水溶解RNA,测RNA浓度,进行逆转录反应:把所需逆转录试剂先上下轻颠混匀,小型离心机离心30 s,然后放于冰上备用。按照TaKaRa逆转录试剂盒说明书进行配制反应体系,在PCR仪中37 ℃反应15 min,85 ℃灭活5 min,进行逆转录,用DEPC水稀释逆转录产物约4倍,-20 ℃保存。第二天进行荧光定量PCR反应,PCR引物序列:(upstream-primer:5'TACTGAGACACGGCGGAC3';down-streamprimers:5'TTCCATGTCGCGCACTG3'),按照TaKaRaRT-PCR试剂盒说明书进行配制反应体系,在QPCR仪中依次95 ℃预变性10 min、95 ℃ 15 sec、60 ℃约30 sec、72 ℃ 34 sec,40个循环数。于7500 Fast Real-Time PCR仪取得各模板Ct值,我们采用Folds=2-ΔΔCt值代表基因表达,按照计算公式△△Ct=Ct(实验组)-Ct(对照组)实验重复3次。
1.2.4 CCK8细胞增殖实验 选用细胞状态良好癌细胞进行实验,弃掉培养基,PBS洗1~2次,0.25%胰酶消化细胞,把细胞收集于无菌EP管,置于900 rp离心机离心4 min,弃掉培养基,空培洗涤细胞2次,用空培重悬细胞并调整细胞密度,计数板计数,按照每孔1×103个细胞接种至96孔板并每孔体积100 μl,同时再设5个复孔/每组以及1个blank对照孔(仅加培养基),置于37 ℃、5%CO2细胞培养箱培养7天;在铺板24 h后即测第一天OD值,步骤:弃掉培养基,加入含10%胎牛血清1640液与CCK8试剂混合液(10∶1),110 μl/每孔(避光操作),置于37 ℃、5% CO2细胞培养箱孵育2小时后取出96孔板,在酶标仪进行测值,先将blank对照孔调零,再检测每个孔450 nm处吸光度值(OD值),OD比值象征细胞增殖能力,每组所设5个复孔平均值,依次连测7天,最后绘制增殖曲线。
1.2.5 Boyden小室细胞侵袭实验 选用细胞状态良好癌细胞进行实验,先将小室预处理,滤膜上铺基质胶(RPMI-1640液稀释的Matrigel基质胶按照1∶5混合),50 μl配置胶/小室,整个操作需在冰上进行,迅速把小室置于37 ℃、5%CO2细胞培养箱2~3 h(使胶发生凝固),然后置于超净台紫外照射2 h进行杀菌,再加入适量空培并在细胞培养箱孵育1 h(水化),在超净台中吸出上室中用于水化培养液,下室内加入600 μl含10%胎牛血清1640液,最后在上室中加入200 μl细胞悬液(细胞数200×103个),置于37 ℃、5%CO2细胞培养箱培养48~72 h(目的使细胞进行穿膜运动),取出小室轻轻擦掉上室内未穿过细胞(棉花或棉棒),PBS液轻轻洗小室3次(避免用力),甲醇液固定20~30 min,PBS液轻轻洗3次,苏木精染液染色40 min,镜下观察穿过膜细胞数,选取上、下、左、右、中心5个视野200倍光镜下拍图,细胞计数取均值。
1.3 统计学分析
应用Graphpad Prism 6统计软件进行统计学分析,两组均数间的比较采用配对样本t检验,多组均数间比较采用方差分析法,取α=0.05为检验标准。
2 结果
2.1 QPCR检测肝癌细胞株中XAGE-1b内源性表达
荧光定量Q-PCR检测3株肝癌细胞株7721、97H、HepG2中XAGE-1b的mRNA表达水平,XAGE-1b的表达水平由高至低依次为7721、HepG2、97H(图1)。

图1 QPCR检测3株肝癌细胞株中XAGE-1b的mRNA内源性表达情况
2.2 QPCR检测干扰载体的干扰效率
QPCR检测XAGE-1b干扰载体感染7721细胞后XAGE-1b的mRNA表达水平,与NC组相比,SI组mRNA水平显著降低(P<0.01,图2)。
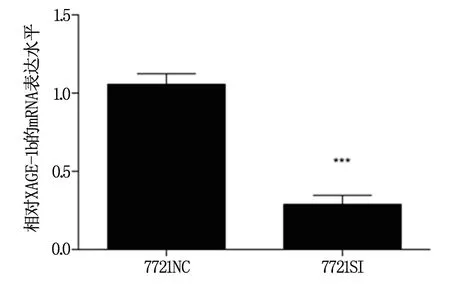
图2 QPCR检测XAGE-1b的干扰效率
2.3 CCK8检测XAGE-1b干扰后对肝癌细胞增殖能力的影响
与NC组相比,7721SI组细胞株增殖率明显降低(P<0.01,图3)。结果表明,XAGE-1b干扰组增殖能力明显降低,干扰XAGE-1b抑制肿瘤细胞的体外增殖能力。
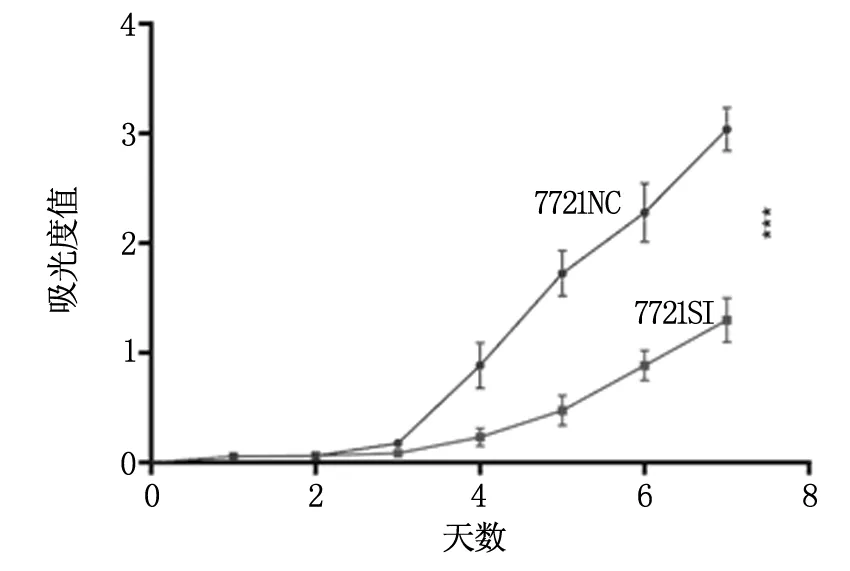
图3 CCK8检测XAGE-1b干扰后7721细胞株的体外增殖情况
2.4 Boyden小室细胞侵袭实验检测XAGE-1b干扰后对肝癌细胞侵袭能力的影响
与NC组相比,7721SI组细胞穿过小室膜数目显著减少(P<0.01,图4)。结果表明,干扰XAGE-1b抑制肿瘤细胞的体外侵袭能力。
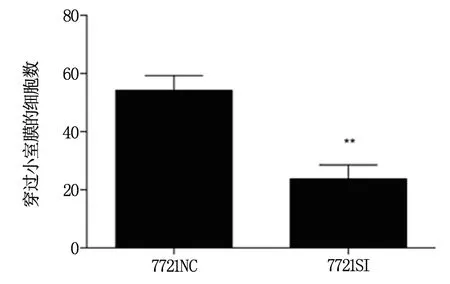
图4 Boyden小室细胞侵袭实验检测XAGE-1b干扰后7721细胞株体外侵袭情况
3 讨论
肝癌是常见的恶性肿瘤,复发及转移是常见的死亡原因,由于起病比较隐匿,难于早期发现,因此采取有效的监测手段是早发现早治疗的关键。XAGE-1b因具有较广泛表达谱、表达率及免疫原性而被广泛研究,XAGE-1b的血浆mRNA及蛋白可作为肿瘤标记协助临床诊断[20]。
XAGE-1属于GAGE 家族,有4种转录异构体,依次为XAGE-1a、XAGE-1b、XAGE-1c 和 XAGE-1d,XAGE-1b是主要的转录本存在形式。XAGE-1b在除睾丸、胎盘、脑及卵巢组织以外的正常组织中几乎不表达,但在肿瘤组织中广泛表达,见于黑色素瘤、尤文氏肉瘤、胃癌、涎腺腺样囊性癌、肺癌、乳腺癌、膀胱癌等多肿瘤中,在生物学功能方面,XAGE-1b可以促进涎腺腺样囊性癌细胞增殖、侵袭、转移及血管生成[22]。XAGE-1b在肝癌中亦有表达且与患者预后相关,但其在肝癌中的生物学行为至今没有研究。
本研究我们通过QPCR检测3株肝癌细胞株XAGE-1b的mRNA内源性表达情况,选取表达量最高1株肝癌细胞株7721进行研究,采用XAGE-1b干扰载体转染7721细胞株,QPCR检测XAGE-1b的mRNA干扰效率,然后采用CCK8细胞增殖实验、Boyden小室细胞侵袭实验进行体外生物学作用分析,发现干扰XAGE-1b能够抑制肝癌细胞体外增殖、侵袭能力,说明XAGE-1b表达与肝癌的增殖、侵袭能力密切相关。
本研究结果表明,沉默XAGE-1b后肝癌细胞的体外增殖、侵袭能力明显降低,但XAGE-1b的相关作用机制仍不清楚,有待进一步深入研究。XAGE-1b有望成为肿瘤标记物的筛查指标,为临床肿瘤诊治及新药研究提供新的靶点依据,进一步提高患者生存质量。

