人工智能实施头颈部患者组织结构自动勾画的评价研究
巩汉顺 戴相昆 曲宝林 章 桦 徐寿平
精确放疗时代下放疗计划中组织结构的准确剂量评估主要基于精确的三维轮廓勾画,因此靶区及危及器官(organs-at-risk,OARs)勾画的准确性是实现患者放疗疗效的重要前提条件之一[1]。但临床工作中OARs勾画的是一项极其耗时且繁琐的工作;同时受勾画者的主观性及自身不同专业素质的限制[2-3],很难保证勾画效果的一致性及准确度[4],这些差异不仅会影响治疗计划的优化及质量,并且会影响疗效评估以及临床模式的评估[5-6]。
头颈部肿瘤尤其是鼻咽癌患者,其肿瘤靶区形状复杂、周围OARs结构众多,OARs勾画工作会更加繁琐耗时。随着科学技术的进步,不同类别的自动勾画软件越来越多地被开发出来。基于图谱库的自动勾画软件发展起步较早[7],主要包括ABAS(Elekta Medical System,Stockholm,Sweden)、SmartAdapt和Velocity(Varian Medical Systems,Palo Alto,USA)、RayDeformable(RaySearch Laboratories,Stockholm,Sweden)、MIM(MIM Software Inc,Cleveland,USA)等[8],但该类方法对图谱库的选择策略以及通常耗时的配准本身的鲁棒性非常敏感[9]。基于不同神经网络机器学习的自动分割技术近年来也逐步应用于OARs的勾画,在保证勾画精度的前提下,大大提高勾画效率、降低勾画者之间的差异性[10-11],使得放疗工作者从勾画等大量重复性的工作中解脱出来,更高效地完成对患者的诊疗收治工作[12]。由于模型构建及算法的差异导致危及器官尤其是微小结构的勾画结果与真实结构存在一定差异。本研究通过利用改进型U-Net神经网络的眼周联合分割优化模型对头颈部患者的组织结构自动与人工勾画进行分析比较。
1 材料与方法
1.1 临床资料
随机选取本院放疗科同一主诊组治疗的鼻咽癌患者118例。患者取仰卧位,采用热塑头肩膜固定,双臂平行放于身体两侧。在西门子CT(SOMATOM Definition AS)下模拟定位,扫描层厚为3 mm,层间距3 mm;扫描范围一般从头顶至隆突。
1.2 人工勾画危及器官
将定位扫描所得图像通过DICOM传输至Pinnacle计划系统。由主诊组经验丰富的医生在CT图像上手动勾画出危及器官。
1.3 基于人工智能危及器官自动勾画
U-Net分割框架由Ronneberger等在全卷积神经网络(fully convolutional neural networks,FCN)[13]基础上提出的,与基于块的深度卷积神经网络(convolutional neural network,CNN)相比,U-Net框架的优势在于使用跨层链接方式,通过裁剪与复制方式对整个图像的上下文进行综合考虑,将多尺度特征信息集成,最终实现对图像低分辨率和高分辨率信息的完美融合;组织结构分割结果更加精确,图像细节还原效果更好[14]。
本研究中利用改进型U-Net神经网络的眼周联合分割优化模型创建头颈部患者危及器官自动勾画模型。此深度学习网络主要通过使用TensorFlow后端的Keras构建和实现,其中层分类网络主要由深度可分离卷积和最大池化层组成;分割网络是从2D U-Net的编解码器结构中提炼出来。训练集优选自三家不同医院343例中勾画质量好的72例,验证集患者18例,测试集来源于本单位同一主诊医师收治的118患者,对所得结构勾画效果与人工勾画进行分析。
1.4 评价指标


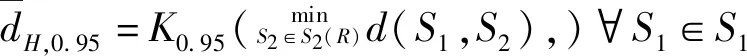

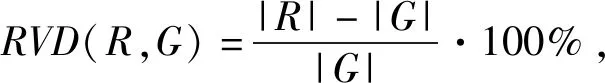
2 结果
对于DSC指标,大部分器官分割效果较为稳定,其中眼球(Eye_L/R)、口腔(Oral Cavity)、脑干(Brainstem)、腮腺(Parotid_L/R)、颌下腺(Submandibular gland_L/R,SMG_L/R)分割效果较好,平均值均在0.820以上,眼球甚至达到0.900以上;耳蜗(Cochlea_L/R)、晶状体(Lens_ L/R)、视神经(Optic_Nerve_L/R)、甲状腺(Thyroid)、脊髓(Spinal Cord)、下颌关节(TMJ_L/R)分割效果一般;垂体(Pituitary)、视交叉(Optic_Chiasm)分割效果较差,最低仅为0.559。
HD值与危及器官大小相关,小体积器官均相对稳定;而脊髓自动勾画效果较差,HD值为23.758。与HD相似,大部分器官的ASSD值较稳定,脊髓的ASSD系数较大。
由于RVD主要体现勾画的体积偏差,对于体积较小的器官更容易造成偏差较大,其中垂体自动勾画范围偏小,偏差值为-0.445;视神经、视交叉勾画效果也相对偏小。右下颌关节由于器官本身体积比较小,造成两种勾画体积差别较大。具体数据结果如表1。

表1 118例头颈部患者危及器官深度卷积神经网络自动勾画与手动勾画分析结果
3 讨论
目前,基于特征的深度学习方法通过捕获不同组织间的差异并将其整合至预测模型中以解决临床工作中遇到的相关问题,已是国内外放疗学者的一项研究热点[20-22]。Zhu等[23]基于AnatomyNet神经网络对头颈部不同组织结构进行自动勾画所得DSC为0.7925;门阔等[24]利用深度反卷积神经网络对头颈部多个危及器官进行自动勾画,平均DSC为0.81;Ibragimov等[25]使用卷积神经网络对头颈部相关危及器官进行自动勾画,所得DSC值范围为0.374~0.895;本研究中所得头颈部各危及器官的平均DSC为0.559~0.905。通过对脊髓等各项指标进行分析,其DSC值较低,而HD及ASSD值较高,对比勾画效果图发现自动勾画与人工勾画的标准存在一定差异,目前该算法会把腰椎勾画在内;修改脊髓的头脚对比范围,只对有勾画的层面进行再次对比,DSC均值从0.747提升至0.850,而HD及ASSD值均有所降低。
对于体积较大的危及器官,较小的体积勾画差异并不会造成整体器官体积指标参数的显著差异,但对小体积的器官即使只在某一层面存在勾画差异也可能会对整个器官结构体积造成较大的差别。虽然采用深度学习的方法能够获得危及器官较好的自动勾画结果,但在实际临床应用过程中仍然存在某些固有的局限性;深度卷积神经网络对于解剖位置相对固定,但体积较小的危及器官的自动勾画存在一定难度;由于网络结构中存在多次卷积迭代及池化过程,较易造成小体积危及器官勾画轮廓信息丢失;而头颈部位本身就包含众多的小体积危及器官,例如晶体、视神经、视交叉及垂体等,其结果对自动勾画的整体精度造成一定负面影响。目前,为提高小体积危及器官的勾画精度通常采用增加训练样本数量或改用计算精度更高的函数等两种常规方法;通过创建患者个性化训练模型也可提高模型勾画精度。Ren等[26]交叉使用多个3D卷积神经网络(3D-CNN)实现头颈部CT图像小组织的自动分割:视交叉、视神经的平均DCS分别为(0.58±0.17)、(0.71±0.08);HD95分别为(2.81±1.56)mm、(2.23±0.90) mm。本研究中对于晶体等小体积危及器官,为进一步地提高勾画精度,利用改进型U-Net神经网络的眼周联合分割优化模型创建头颈部患者微小危及器官自动勾画模型,对于眼球,则取得了很好的勾画效果,平均DSC在0.900以上;晶体DSC也接近0.800;而视神经及视交叉RVD值偏小,主要与训练集勾画数据较少存在一定关系。与人工勾画相比,本研究中所采用的神经网络进行OARs自动勾画可以显著降低时间消耗,头颈部勾画平均需要6 min;并且采用后台工作模式,可一次将多个病例集中导入系统进行自动勾画,进一步减少等待时间,提高勾画效率。
深度卷积神经网络在放疗靶区勾画方面的研究[27]相对较少;同时由于不同医疗机构甚至不同医师之间对靶区勾画具体准则差异性较大,以及目前用于深度学习的神经网络结构在肿瘤靶区边缘界定方面存在一定的不确定性,从而导致靶区自动勾画精度的较大差异性。Li等[28]利用U-Net模型自动分割鼻咽癌患者肿瘤靶区,原发性肿瘤整体DSC为0.740,淋巴结为0.659;HD分别为12.85 mm和32.10 mm。Kuo等[29]使用深度反卷积神经网络对鼻咽癌临床靶区,原发病灶和转移淋巴结进行自动勾画,其DSC分别为:0.826、0.809及0.623。随着技术进步及神经网络结构的改进,靶区自动勾画将是放疗领域下一步研究的热点。
总之,采用高精度优化模型的人工智能对解剖结构较为复杂的头颈部肿瘤患者组织结构的自动勾画基本可能够满足临床需求,随着模型中优质勾画患者数量的增加及对构建模型的不断优化,其勾画准确性和精度将获得进一步的提升;虽然对于某些结构轮廓仍需要进一步人工修改,但人工智能勾画已在很大程度上把放疗工作者从繁琐而重复的工作中解脱出来,减少了在勾画方面不必要的工作量,应该可作为一种高效的放疗辅助工具。

