术前Ki-67、γ-GT水平对原发性肝癌患者TACE治疗后生存期的影响
李 鹏 李浩田 郭永刚
肝癌是1种比较常见的消化系统恶性肿瘤,在我国具有较高的发病率和死亡率,其中80%为原发性肝癌(hepatocellular carcinoma,HCC)[1]。根治性手术是治疗HCC有效的治疗方式,但术后仍存在较高的复发率,预后较差。肝动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)属于1种安全性较高的介入治疗手段,可通过注入栓塞剂或化疗药物来阻断癌组织的供血动脉,达到抑制癌细胞扩散的目的[2]。有学者在研究报告中指出[3],在肝癌根治术后行预防性TACE能提早发现微病灶、微转移,有效防止术后复发,延长患者生存期。Ki-67是1种能反映细胞增殖程度的核抗原,在癌组织中的表达与癌症患者的预后密切相关[4];γ-GT是一项常见的肝功能指标,与HCC的发生、发展及预后具有重要联系[5]。目前,关于Ki-67、γ-GT与HCC患者术后行预防性TACE治疗后生存期关系方面的研究报道较少,因此,本研究旨在探讨术前Ki-67、γ-GT水平与HCC患者TACE治疗后生存期及预后的关系,以期为临床HCC患者TACE术后预后的判断提供一些参考依据,现报告如下。
1 材料与方法
1.1 临床资料
回顾性选取2016年1月至2018年3月期间我院收治的60例HCC根治术后行预防性TACE治疗患者作为研究对象,对患者临床资料和组织血清标本进行回顾性分析。60例患者中男性46例,女性14例,年龄33~75岁,平均年龄(55.47±12.35)岁。纳入标准:①符合2011年《原发性肝癌诊疗规范》HCC相关诊断标准[6],并经病理学诊断确诊为HCC患者;②肝功能Child-Pugh分级为A级或B级者;③均经根治性切除术治疗,术后2个月内行TACE预防性治疗者;④患者均随访至术后2年记录其生存情况,并具备完整的临床、随访资料和血清、组织标本者;⑤术后只进行1次TACE治疗。排除标准:①术前接受放、化疗,射频消融术等抗肿瘤治疗者;②严重凝血功能障碍、严重感染者;③全身免疫性疾病者;④存在严重肾功能障碍、心脏疾病、其他恶性肿瘤者。本研究经过本院医学伦理委员会审批通过,研究内容设计符合《世界赫尔辛基宣言》。
1.2 方法
1.2.1 TACE方法 所有患者均在根治性切除术后2月内行TACE预防性治疗,具体操作为:患者取仰卧位,在局部麻醉后,采用改良Seldinger穿刺技术经右股动脉插管,依据影像学资料中肿瘤的具体位置、体积与供血情况,采用2.6F Progeal微导管在供血动脉中进行超选择性插管,并灌注碘化油(5~20 ml)与表柔比星(30 mg)混合成的乳化剂,在透视下密切监视灌注情况,以碘油灌满癌灶并有返流时为限。然后再缓慢注入少许明胶海绵颗粒或载药微球,聚乙烯醇颗粒等栓塞材料对肿瘤供血血管进行栓塞,动脉血流完全阻断后拔管。
1.2.2 术前血清中γ-GT水平检测 采用Olympus 7060型全自动生化分析仪对患者TACE术前的血清标本的γ-GT含量进行检测,以血清γ-GT≥50 U/l为高表达,<50 U/l为低表达。
1.2.3 肿瘤组织中Ki-67表达检测 采用免疫组化法检测HCC患者癌组织中的Ki-67表达情况。取患者根治性手术后的肿瘤组织样本,经10%甲醛固定、脱水包埋后进行切片,切成4 μm厚度后以小鼠抗人Ki-67单克隆抗体进行免疫染色,经低温孵育、漂洗、显色后进行切片并用苏木精复染,置于光学显微镜下观察。Ki-67染色评价标准:Ki-67阳性着色为细胞核出现棕黄色颗粒,观察细胞核出现棕黄色颗粒为Ki-67阳性细胞,每张切片选取5个高倍视野(×400)随机观察,计算每个视野100个计数细胞中的阳性细胞所占百分数,取其平均值。
1.2.4 随访方案 随访从患者TACE术后首日开始,采用门诊随访以及电话随访的方式对入组患者进行随访,TACE术第1年2~3个月门诊随访1次,复查CT或MRI,检测血清甲胎蛋白;1年后6个月复查1次,随访至死亡日期或TACE术后2年为止。
1.3 统计学处理
采用SPSS 20.0软件对实验数据进行分析,本研究中涉及的计数资料用%表示,采用χ2检验;计量资料采用“Mean±SD”表示,2组间比较采用两样本t检验,对符合正态分布的两数据采用Pearson进行相关性分析,生存分析采用Kaplan-Meier法,组间比较采用Log-rank检验,术后生存率单因素分析及多因素预后分析采用Cox比例风险模型,均以P<0.05提示为差异有统计学意义。
2 结果
2.1 HCC患者术前血清γ-GT和Ki-67表达情况
经检测,60例HCC患者中Ki-67阳性细胞占比为(20.39±5.42)%,中位数为20%;依据Ki-67阳性细胞占比中位数将患者的Ki-67阳性细胞占比≤20%的25例患者划分为低表达组,>20%的35例患者划为高表达组。60例HCC患者血清中γ-GT平均水平为(86.23±21.57)U/l,低表达组患者22例,高表达组
患者38例。
2.2 影响HCC患者预防性TACE治疗后预后的单因素与多因素分析
经2年随访,60例患者均获得完整随访,无删失数据,随访期间共死亡26例,2年总生存率56.67%。对60例患者的2年生存率进行单因素分析的结果显示,HCC患者TACE治疗后的2年生存率与患者的年龄、性别、术前甲胎蛋白水平、肝功能Child-Pugh分级和肝切除方式没有明显相关性(P>0.05),而与患者肿瘤直径、肿瘤包膜完整性、Ki-67表达、γ-GT表达和有无微血管癌栓明显相关(P<0.05),见表1。
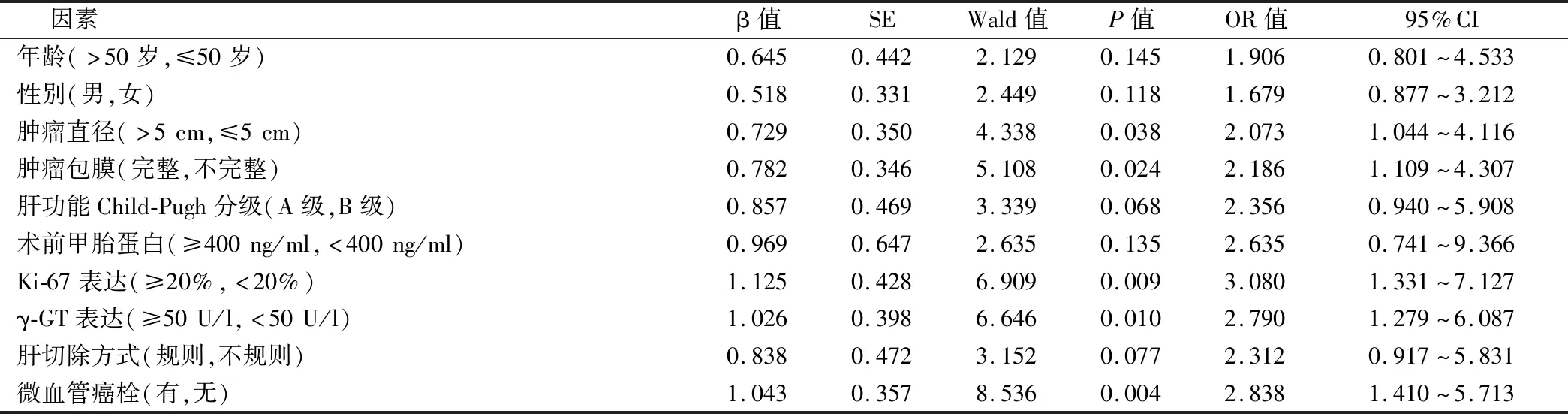
表1 影响HCC患者预防性TACE治疗后预后的单因素分析
将单因素中有相关性的因素引入Cox模型进行多因素生存分析发现,Ki-67表达≥20%、γ-GT表达≥50 U/l和有微血管癌栓是影响HCC患者预防性TACE治疗后预后的独立因素(P<0.05),见表2。

表2 影响HCC患者预防性TACE治疗后预后的Cox比例风险模型分析
2.3 术前Ki-67、γ-GT表达与HCC患者TACE治疗后生存率的关系
Ki-67低表达组中有6例患者死亡,Ki-67高表达组患者中有20例患者死亡,Ki-67高表达组2年生存率明显低于Ki-67低表达组(P<0.05);γ-GT低表达组中死亡5例,γ-GT高表达组中死亡21例,γ-GT高表达组2年生存率明显低于γ-GT低表达组(P<0.05),见表3。术前Ki-67和γ-GT不同表达患者Kaplan-Meier生存曲线如图1、图2所示。

表3 TACE术前不同Ki-67和γ-GT表达患者的生存率比较(例,%)
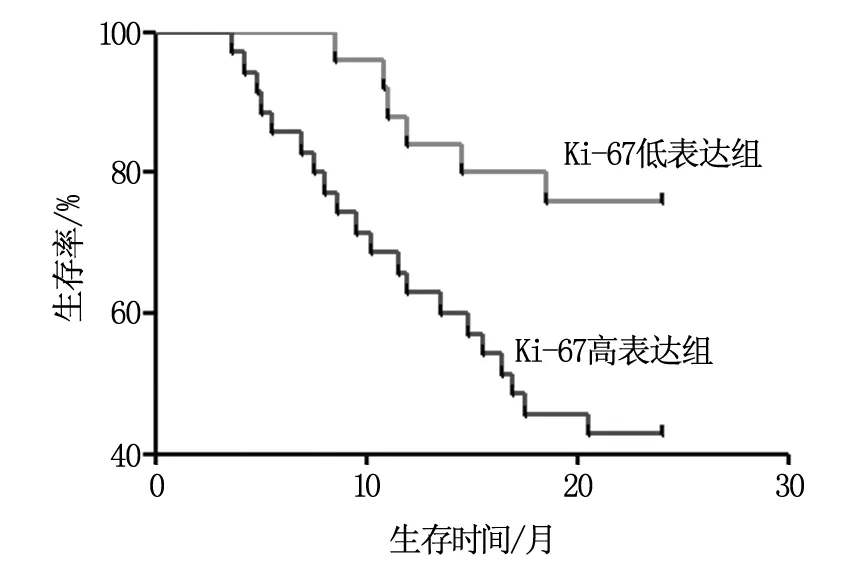
图1 Ki-67高表达组与低表达组的生存曲线图(Log-rank检验P=0.010)

图2 γ-GT高表达组与低表达组的生存曲线图(Log-rank检验P=0.014)
3 讨论
HCC具有肿瘤恶性程度高、进展迅速和预后差等特点,根治性切除手术是其有效的治疗方式,但术后5年复发率仍保持在较高水平,可达60%以上,5年生存率低于10%[7]。有研究报道[8],HCC患者术后行TACE预防性治疗可帮助尽早发现微小病灶,杀死残留癌组织,尤其是肝癌直径>5 cm、多发性肝癌或存在微血管癌栓等患者更能从中获益。本研究60例HCC患者TACE治疗后的2年生存率为56.67%,稍低于国内的研究结果[9],可能与患者病情严重程度、术后放化疗等多种影响因素有关。临床上对HCC患者TACE治疗后预后情况进行预测和评估有利于尽早采取补充治疗措施和干预方案,对于改善患者预后至关重要。本研究主要探讨Ki-67与γ-GT对HCC患者TACE治疗后生存期的影响,发现二者高表达均可导致患者生存率降低,出现预后不良。
本研究单因素生存分析结果显示,HCC患者TACE治疗后的2年生存率与患者肿瘤直径、肿瘤包膜完整性、Ki-67表达、γ-GT表达和有无微血管癌栓明显相关,魏复群等[10]在研究HCC根治性切除手术后行TACE预防性治疗患者的总生期危险因素时亦得出类似的结果。同时,本研究多因素Cox生存分析结果显示,Ki-67表达≥20%、γ-GT表达≥50 U/l和有微血管癌栓是影响HCC患者预防性TACE治疗后预后的独立因素,表明了有微血管癌栓、Ki-67和γ-GT高表达的HCC患者生存期短、预后较差。微血管癌栓已被研究证实是HCC切除术后早期复发的主要危险因素之一,可通过肝内转移进一步导致肿瘤复发,缩短TACE治疗后生存期[11]。Ki-67表达对HCC患者TACE治疗后预后的影响主要在于:Ki-67是1种细胞增殖标志物,在多种肿瘤组织中呈较高表达,其表达量的高低可较好地反映出癌组织的增殖活性,与肿瘤的发生、浸润、转移和预后情况具有重要联系[12]。本研究中Ki-67阳性细胞占比>20%时可见患者癌组织中Ki-67呈高表达,提示癌组织中的肿瘤恶性程度较高,肿瘤细胞的增殖能力较强,即使经过根治性手术和TACE介入治疗,肿瘤组织中癌细胞仍会继续增殖分化,侵袭周围正常组织,最后导致肿瘤出现复发或转移,预后较差。对于γ-GT表达对HCC患者TACE治疗后生存率的影响机制主要认为与其干扰肿瘤细胞的氧化应激平衡有关。γ-GT是一种反应肝脏炎性微环境的血清标志物,主要来自肝脏,其在血清中呈高表达时可能通过干扰机体氧化应激和抗氧化的平衡导致肿瘤细胞持续处于氧化应激状态,进一步促进肿瘤的发生和发展,影响患者术后复发和生存期的延长。代鸿华等[13]在研究γ-GT对HCC患者术后预后的影响时亦发现γ-GT可影响患者术后总生存率,是预测HCC患者预后的独立危险因素。
本研究对不同Ki-67、γ-GT表达患者的Kaplan-Meier生存分析结果显示,Ki-67高表达组2年生存率明显低于Ki-67低表达组,γ-GT高表达组2年生存率明显低于γ-GT低表达组,可见不同Ki-67、γ-GT表达患者其生存期存在明显差异性,这与国内研究结果较为一致[14]。由于Ki-67和γ-GT高表达时可通过增强肿瘤细胞增殖活性和助氧化等促进肿瘤的发展,使患者经TACE治疗后更容易发生复发和转移,导致患者生存率较低。以上结果均提示,Ki-67和γ-GT是参与HCC患者TACE治疗后肿瘤中癌细胞增殖与转移的关键分子,二者有望成为预测HCC预后的分子标志物,对于临床上预测HCC预后和分子靶向治疗具有重要的指导作用。
综上所述,术前Ki-67、γ-GT表达量与HCC患者预防性TACE治疗后的2年生存率密切相关,TACE术前Ki-67、γ-GT高表达可导致预后不良,二者可能作为预测HCC患者TACE术后不良预后的分子标志物。

