有机-无机杂化同多钼酸超分子化合物的合成、晶体结构及电催化性能
历 亳, 刘立红, 胡冬慧, 陈佳明, 邓兆鹏
(1.黑河学院 理学院, 黑河 164300; 2. 黑龙江大学 化学化工与材料学院, 哈尔滨 150080)
0 引 言
多金属氧酸盐(Polyoxometalates),又称多金属氧簇,简称多酸(POMs)。自从1826年Berzelius报道了第一个多酸晶体[1],多酸化学已有悠久的历史,并广泛应用于磁化学、药物化学、工业催化和非线性光学等各个学科领域[2-6]。同多钼酸盐是多酸的一个重要分支,具有丰富的结构,可以形成多样的金属钼簇,如{Mo6}、{Mo8}和{Mo16}等,目前报道的最大的钼簇为{Mo368}[1-2]。同时,同多钼酸盐能够作为氢键受体与不同的有机分子形成各种结构新颖的有机-无机杂化材料[7-10],并在电化学、光催化和医学等领域展现出了潜在的应用价值。特别是作为电化学传感器应用于过氧化氢(H2O2)、多巴胺(DA)等生物小分子的检测成为了近年来的研究热点课题之一[11-13]。为了进一步拓展同多钼酸超分子化合物的结构花样,并探究其作为生物小分子传感器的可能性,本文利用常规的水热合成技术,以预先设计合成的联吡啶胺配体(L: N-(吡啶-3-甲基)吡啶-2-胺)与钼酸铵为反应原料,合成出一个全新的有机-无机杂化同多钼酸超分子化合物[H2L]2[β-Mo8O26],对其进行了元素分析、红外、热重以及粉末和单晶X-射线衍射结构表征,并探究了其对H2O2的电催化性质。
1 实验部分
1.1 仪器与试剂
采用元素分析仪(德国Elementar公司,Vario MICRO型)进行元素分析;傅里叶变换红外光谱仪(德国Bruker公司,EQUINOX 55型),KBr压片法测定红外光谱;热分析仪(美国Perkin Elmer公司,TG/DTA 6300型)进行热重分析实验,测定过程中的升温速率为10 ℃·min-1,空气气氛;利用X-射线衍射仪(靶源为Cu-Kα,λ= 0.154 06 nm,D8型)测定粉末X-射线衍射数据;电化学工作站(上海宸华公司,CHI-760E型)进行电化学测试,三电极系统:工作电极使用玻碳电极(GCE,内径5 mm)和修饰的玻碳电极,辅助电极为铂丝电极,参比电极为饱和甘汞电极(SCE)。所用试剂均为市售分析纯试剂。
1.2 化合物的合成
1.2.1 配体的合成
配体N-(吡啶-3-甲基)吡啶-2-胺(L,图1)按文献[14]的方法制备。准确称取2-氨基吡啶3.75 g,将其溶于75 mL甲苯中,搅拌加热至100 ℃左右,待2-氨基吡啶完全溶解后,再向溶液中逐滴加入3-吡啶甲醛4.6 mL,于180 ℃下加热并回流12 h。将溶液冷却至室温,用旋转蒸发仪于50 ℃~60 ℃下旋蒸出甲苯,并将其冷却至室温固化,再加入40 mL无水乙醇,待固体溶解后,向其中缓慢加入NaBH43.5 g,搅拌18 h。于40 ℃旋蒸出溶液中的乙醇后,向圆底烧瓶中加入30 mL蒸馏水,再于70 ℃水浴向溶液中逐滴加入饱和氯化铵溶液,直至无气泡产生为止。将溶液冷却至室温,抽滤,留溶液部分,于40 ℃旋蒸后,冷却至室温。用乙酸乙酯将溶液萃取三次,取上层溶液。向萃取后的溶液中加入无水硫酸镁,抽滤,于60 ℃旋蒸,冷却后,即得到配体L。

图1 配体L的结构示意图
1.2.2 化合物的合成
准确称取0.124 g (0.10 mmol) (NH4)6Mo7O24·4H2O和0.031g (0.2 mmol) N-(吡啶-3-甲基)吡啶-2-胺,溶于10 mL蒸馏水,在室温下搅拌1 h后,转移至反应釜中,160 ℃温度下反应3 d,反应完毕后析出黄色块状晶体,并用蒸馏水冲洗数遍。产率:49.26%(以元素Mo计算)。化学式为C11H13N3O13Mo4,分子式为[H2L]2[Mo8O26]。元素分析实验值(%):C 16.93, H 1.62, N 5.35;理论计算值(%):C 16.96, H 1.68, N 5.39。红外光谱(cm-1): 3 355(m),3 077(m),1 633(s),1 541(m),1 246(m),916(s),837(s),755(m),689(s),616(s)。
1.3 晶体结构测定


表1 化合物的晶体学和结构精修数据
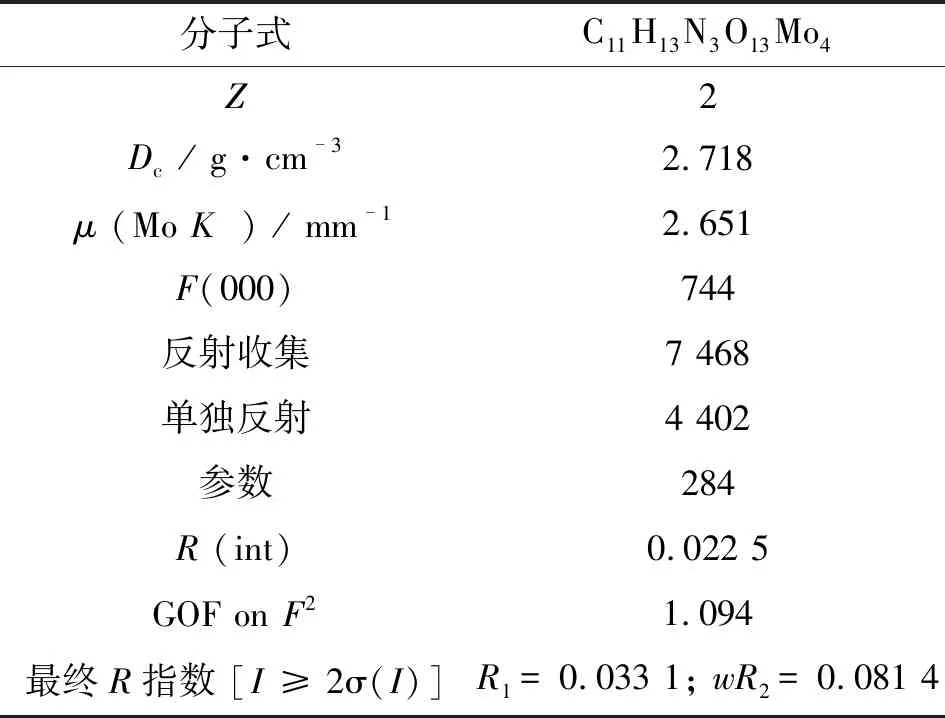
分子式C11H13N3O13Mo4Z2Dc / g·cm-32.718μ (Mo K儊) / mm-12.651F(000)744反射收集7 468单独反射4 402参数284R (int)0.022 5GOF on F21.094最终R指数 [I ≥ 2σ(I)]R1 = 0.033 1; wR2 = 0.081 4

表2 化合物的部分键长(nm)和键角(°)数据

表3 化合物的氢键键长(nm)和键角(°)数据
2 结果与讨论
2.1 物相、红外与热重分析

此外,还对该化合物在空气气氛下的热稳定性进行了考察,结果如图2(c)所示。可以看出,化合物展现出了两步明显的热失重过程。在200~500 ℃,该化合物失重24.51 wt.%,对应于有机配体的热分解(理论失重量24.13 wt.%)。随后的500~700 ℃,热重曲线没有明显的变化,说明形成的MoO3在此温度范围内处于稳定状态。而当温度高于700 ℃,样品快速失重,此过程对应于MoO3的升华过程,失重值为73.23 wt.% (理论值73.91 wt.%)。


图2 化合物的粉末XRD谱图 (a)、IR光谱 (b)及热重曲线(c)
2.2 化合物的晶体结构
化合物的单胞图如图3(a)所示,其分子结构中包含一个(β-Mo8O26)4-阴离子和两个被质子化的配体H2L2+。三者之间通过对称性相关的N1-H19…O13iii(对称操作码: iii)x+1,y+1,z)氢键相连接。需要指出的是,由于配体被质子化后刚性增强,因此,同一个配体中的两个吡啶环间的夹角为80.7°。(β-Mo8O26)4-阴离子由8个扭曲的{MoO6}八面体组成,且这些八面体中含有四种不同配位模式的氧原子,分别为6个μ2-O、4个μ3-O、2个μ4-O和14个端基O(Ot)。每一个Mo8簇与相邻的两个多酸簇阴离子单元通过共用四个氧原子,形成了如图3(b)所示的一维无限长链。与此同时,H2L2+中的两个吡啶N和一个脂肪N原子分别与相邻两个链中的端氧及桥氧通过氢键作用(表3)扩展成复杂的三维有机-无机杂化超分子网络结构,如图3(c)所示。

图3 化合物的分子结构(a)、一维链 (b)及三维网络结构(c)
2.3 化合物的电催化性质研究
以该化合物为电极材料,研究其电催化性质。将5 mg化合物研磨成粉末后,分散在1 mL 0.5 wt.% 萘酚溶液中,超声1 h后,取10 μL该悬浊液(5 mg·mL-1)均匀地滴涂到干净的裸玻碳电极(GCE, Ø5 mm)表面,空气中干燥后,研究该修饰电极在1 mol·L-1H2SO4水溶液中的电化学行为,如图4(a)所示。其-400~+600 mV电势范围的循环伏安曲线有三对氧化还原峰,半波电位E1/2= (Epc+Epa)/2分别为-155.6,10.0和8.4 mV (扫速100 mV·s-1)。每个氧化还原峰归属为Mo的一电子转移过程[10]。此外,随着扫速的增大,阴极峰电势向负方向移动,阳极峰电势向正方向移动,同时,氧化还原峰电流也逐渐增大,峰电流和扫描速度之间存在很好的线性关系,如图4(a)插图所示。相应的线性方程分别为:氧化峰电流Ip(μA)=0.106v+0.102,还原峰电流Ip(μA)=0.046v-0.082,其相关系数分别为Ro= 0.999,Rr= 0.998,这表明电极表面电荷的传导过程为表面控制过程[11]。此外,还研究了该电极材料对H2O2的电催化行为,结果如图4(b)所示。在扫速100 mV·s-1时,随着不同浓度H2O2的不断加入,三个还原峰峰电流明显增大,而相应的氧化峰峰电流减少,表明该电极对H2O2具有良好的电催化活性。
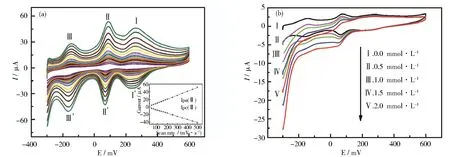
图4 (a) 修饰电极在1 mol·L-1 H2SO4中不同扫速循环伏安图(从内到外: 20~200 mV·s-1);
3 结 论
采用水热合成法构筑了一个新的有机-无机杂化同多钼酸超分子化合物,并对其进行了结构表征和电化学性能测试。结果表明,化合物中的(β-Mo8O26)4-阴离子间共用4个氧原子形成一维链,并通过与质子化配体H2L2+间的氢键连接成三维超分子网络结构。此外,该化合物对过氧化氢具有良好的电催化活性。
致 谢
感谢国家自然科学基金(61801173)的资助。

