儿童脾脏淋巴管瘤七例并文献复习
刘登辉,李勇,唐湘莲,黎明,肖雅玲
湖南省儿童医院普外科,湖南 长沙 410007
淋巴管瘤(lymphangioma, LA)多在儿童时期发现,颈部、腋窝等软组织部位最为常见,但仅有5%的病例发生在眼眶、腹腔及纵隔[1],而发生在脾脏的淋巴管瘤临床上极为少见。1885年Frink[2]报道了第1例脾脏淋巴管瘤(splenic lymphangioma, SLA),到目前为止,文献报道的SLA不足300例[1,3],儿童SLA约占10%左右。本研究回顾性分析我院普外科收治的7例儿童SLA的临床特点、外科治疗策略及预后情况,并检索国内外关于儿童SLA的文献并进行复习,现将研究结果报道如下。
资料与方法
一、一般资料
本研究经过我院医院伦理委员会审批通过(HCHLL-2020-80)。
本组7例患儿中,男性5例,女性2例,年龄3岁2个月~15岁。体检发现病变者3例,有腹痛、呕吐等症状者4例。所有患儿无脾功能亢进、门脉高压及血吸虫病病史。行B超及CT等检查(典型影像学检查,见图1)发现:2例位于脾上段,1例位于脾中段,3例位于脾中下段且肿瘤占据大部分脾脏,1例脾内弥漫性占位病变。7例SLA患儿临床特点总结见表1。

图1 儿童SLA典型影像学表现 A.腹部凸阵探头示脾中下部囊性占位效应;B.高频探头见脾内囊性暗区,内有分隔;C.彩色多普勒超声示脾内囊性暗区分隔上可见条状血流信号,内液性暗区未见彩色血流信号;D.CT增强示脾内囊状液暗均匀低密度影,CT值约17~20 HU,囊壁光整,未见明显强化及壁结节,边缘可见迂曲扩张的管状结构
二、手术方式
4例患儿因肿块大,无法行脾脏部分及脾段切除,选择行开腹脾脏切除及大网膜自体脾片移植术;1例行3D腹腔镜辅助下二级脾蒂离断脾上段切除术;1例行腹腔镜辅助下脾中段切除术;1例因术中病理肿块性质不明,行开腹脾切除术。所有患儿术后恢复良好,无出血、感染等并发症出现。

病人性别年龄症状影像学检查(CT增强)病灶大小(mm)手术方式病理类型随访情况1女3岁2个月腹痛脾内多发低密度影,囊壁不均匀强化48×45×40开腹脾切除+大网膜自体脾片移植术囊状4年2男7岁检查发现脾内多发不规则均匀低密度影,不均匀强化67×50×48开腹脾切除+大网膜自体脾片移植术海绵状3年3女7岁4个月腹痛、呕吐脾内多发类圆形低密度影,呈渐进强化72×52×40开腹脾切除+大网膜自体脾片移植术囊状5年4男7岁5个月检查发现脾内大片状不规则低密度影,未见强化58×48×443D腹腔镜辅助下二级脾蒂离断脾上段切除术囊状5年5男10岁8个月腹痛脾内类圆形低密度影,边缘不规则分隔强化78×56×42开腹脾切除术海绵状4年6男11岁2个月检查发现脾大囊性均匀密度影,无钙化灶,未见强化117×106×88腹腔镜辅助下脾中段切除术囊状2年7男15岁腹痛腹腔多发囊性病变,脾内多发不等类圆形影,病灶边缘及中心均强化137×111×103开腹腹膜后肿块切除、脾切除+大网膜自体脾片移植术海绵状3年
三、文献检索
文献检索策略以“淋巴管瘤”“脾淋巴管瘤”“淋巴管畸形”“儿童”“小儿”“青少年”以及“spleen”“splenic lymphangioma”“lymphatic malformation”“child”“adolescent”“infant”“neonatus”为关键词,检索万方、维普、CNKI、PubMed、Embase、MedLine、Web of Science及Cochrane Library数据库,时间截至2019年12月,剔除无法获得全文资料的病例,检索到儿童SLA文献30篇,英文14篇,中文16篇,剔除数据不全和重复文献7篇,最终纳入本研究分析的文献23篇,患儿29例。
结 果
一、本中心7例SLA患儿预后情况
本中心7例SLA患儿均门诊随访,监测血小板、免疫功能及腹部彩超检查,了解患儿预后情况,随访时间为2~5年。所有患儿无肿瘤复发转移、血小板升高、免疫功能低下及脾切除术后凶险性感染(overwhelming post splenectomy infection,OPSI)发生,4例大网膜自体脾片移植患儿术后通过腹部彩超检查发现均有数量不等移植脾片存活。
二、本中心7例SLA患儿术后病理检查结果
本中心7例患儿术后病理有海绵状及囊状淋巴管瘤两种,无毛细淋巴管瘤。标本术中行快速冰冻病理检查,术后制作病理石蜡切片。
脾脏海绵状LA:镜下见组织中窦隙样管腔间质组织丰富,有均质粉染液体,囊内衬覆扁平内皮细胞、呈“花蕾样”增生,伴浆细胞浸润,可见胶原结缔组织,无异型性。免疫组化染色显示:CD31 (+) 、CD34 (+) 、CD68(-)、F8 (灶+)、Ki67增殖指数低,PAS染色(-),见图2。
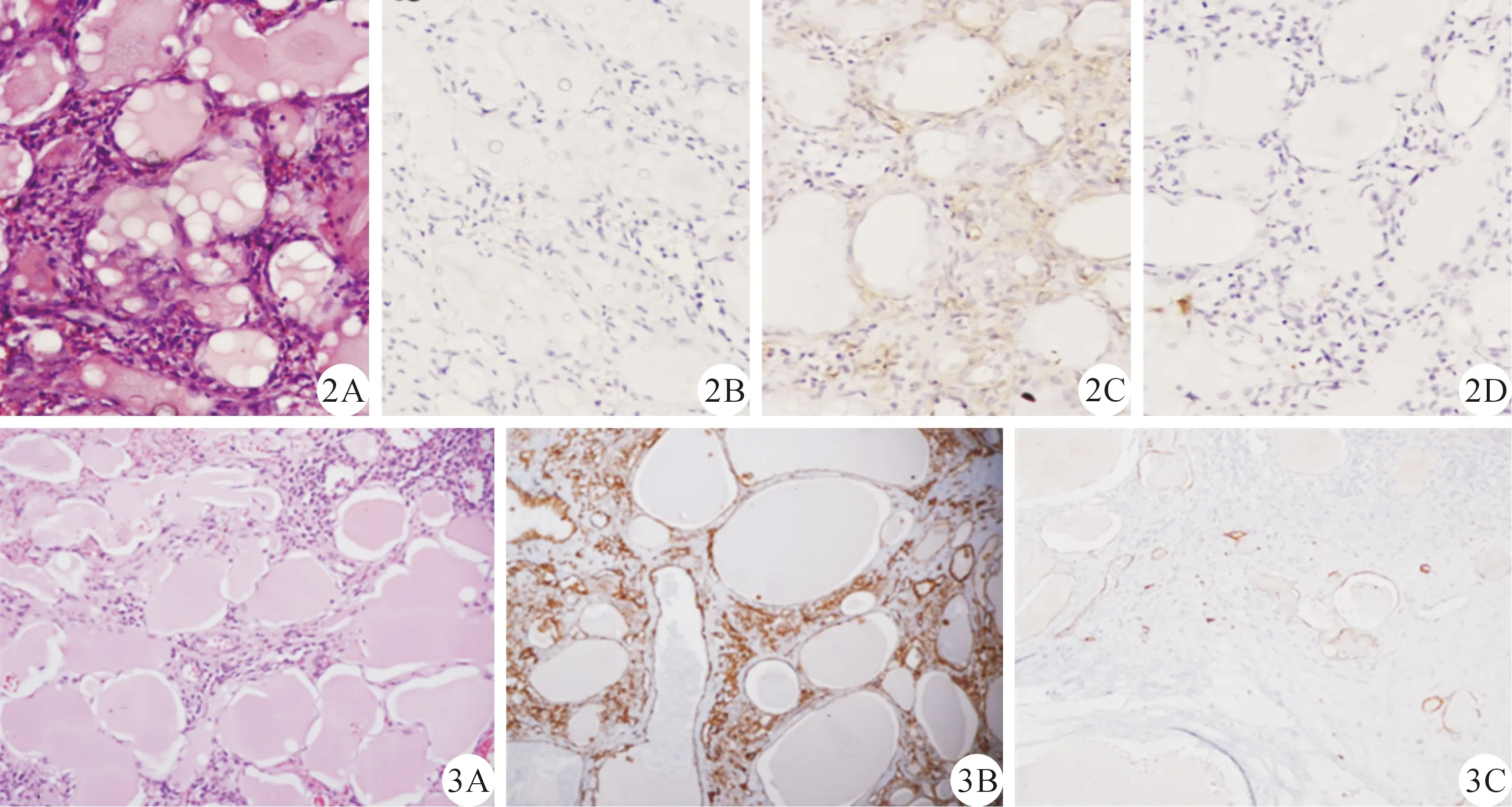
图2 儿童脾脏海绵状淋巴管瘤(LA)病理形态 A.脾脏海绵状LA病理形态学检查(HE染色,×20);B.CD31阳性(免疫组化染色,×20);C.CD34阳性(免疫组化染色,×20);D.局灶性F8阳性(免疫组化染色,×20) 图3 儿童脾脏囊状LA病理形态 A.脾脏囊状LA病理形态学检查(HE染色,×20);B.弥漫CD31阳性 (免疫组化染色,×20);C.内皮细胞局灶性D2-40阳性(免疫组化染色,×20)
脾脏囊状LA:镜下见淋巴管腔呈囊状扩张,个别管腔内可见淡红粉染液体,未见衬覆上皮,管壁被覆的平滑肌不均一,内有单层扁平内皮细胞排列,充满厚的嗜酸性物质,无异型性。免疫组化染色显示:囊壁细胞CD31(弥漫+)、CD34(灶+),D2-40 (灶+) ,Ki67增殖指数低,PAS染色(-),见图3。
三、文献检索结果
检索到23篇文献、29例SLA患儿[4-25],加上本组7例,总计36例SLA患儿,其中男性19例、女性17例,男女比例为1∶0.89;发病年龄3~16岁,中位年龄12岁。体检发现脾脏占位病变者15例,有腹痛、呕吐等临床表现者21例。术前B超、CT检查或正电子发射计算机断层显像-CT(PET-CT)检查脾脏有占位性病变:脾囊肿1例,脾大3例,脾(或多发)囊性占位性病灶26例,脾脏实质性肿瘤3例,另有3例影像学考虑恶性肿瘤,术后病理为SLA。肿瘤病灶长径为(9.75±6.25) cm,以囊性占位性病灶多见。所有患儿接受手术治疗,较早期病例以全脾脏切除手术方式为主(18例),到开腹脾脏切除+大网膜自体脾片移植术,再到腹腔镜下脾脏(段或部分)切除术及腹腔镜下二级脾蒂离断脾切除术。大体病理标本分为囊性、实性和蜂窝状,病理组织学可分为毛细LA、海绵状LA、囊状LA。其中脾毛细LA 3例(8.33%)、脾囊状LA 13例(36.11%)、脾海绵状LA 10例(27.78%),1例脾多发结节状LA,1例脾实性LA(有学者认为应将结节状或实性LA归入脾海绵状LA),另有8例SLA未作病理分类,需待完善和制定分类标准。其中33例患儿获随访,随访率91.7%(33/36),预后均良好,全组围手术期无死亡病例,术后无复发病例。
讨 论
临床上原发性脾脏良性肿瘤少见[26],而SLA仅占所有脾肿瘤的0.007%,文献中报道SLA多见于儿童[1,3],也有文献指出在2岁以下儿童中较年长儿多见[3-4]。SLA常在体检中被发现,其病因不明,目前有学者认为是淋巴管先天异常发育所致,也有学者认为是脾内淋巴系统出血或炎症引起淋巴管梗阻和扩张所致[27-28],另有报道认为SLA可能是Klippel-Trenaunay综合征的一个临床表现[29]。
LA常可累及多个器官,以颈部和腋窝软组织为主[1],发生在脾脏的病例极为少见[2-3]。在组织学上,LA有毛细LA、海绵状LA、囊状LA三种类型,以囊状LA最为常见[21]。有学者[30]认为这3种病理类型是LA疾病过程的不同阶段。SLA患儿临床症状亦不典型,常在体检时发现,本研究中同样有多数病例在体检(或偶然)发现脾脏占位病变,而有症状者常表现为腹痛、呕吐等,并通过影像学检查发现脾脏病变,实验室检查阴性,无脾功能亢进表现,但如伴有脾大,须与脾囊肿、肝硬化引起的脾大等鉴别。诊断主要依靠影像学检查,B超、CT检查评估应用最为广泛,如考虑脾脏恶性肿瘤,进一步完善骨髓穿刺或PET-CT检查,确定有无远处转移。此外,SLA的病理类型不同,其CT强化方式也有所不同,最终仍应结合组织病理学诊断[25,31]。
SLA一般为良性肿瘤,有学者提出超声引导下囊内注射药物治疗(如平阳霉素、聚桂醇等),这样创伤更小且易保留脾脏。但通过分析本中心病例及文献病例,发现手术是治疗的首选[32]。结合文献及本中心经验,笔者认为SLA的手术指征是:(1)出现临床症状或直径>5 cm,有感染、破裂和出血风险者;(2)直径>4 cm,存在引发血液功能障碍、自发性或继发性破裂倾向者;(3)伴临床症状且良恶性未明确者,须及时手术切除,术中需行快速病理冰冻切片检查。全脾脏切除手术治疗较大的或有临床症状的SLA,虽能够预防复发、感染及出血等风险,但术后各种感染风险增加,甚至发生OPSI,还有文献报道全脾脏切除术后总体罹患癌风险增加[33]。随着外科手术技术的提高以及对脾脏免疫功能的深入探索,脾脏外科手术逐渐走向科学理性,手术方式明显发生改变。从“一刀切”、“随意切”的手术模式到非选择性保脾阶段,再到选择性保脾、大网膜自体脾片移植阶段,以及在腹腔镜微创脾切除手术、脾部分以及二级脾蒂离断脾切除等阶段,以最大限度地保留脾脏及其免疫功能,避免了“无辜性脾切除”的发生[34]。大网膜自体脾片移植对脾脏功能的补救已被临床所认同[35-36],这不仅有利于脾脏切除术后病人免疫功能的恢复,而且能有效降低术后病人血栓形成和减少OPSI风险,在脾脏良性肿瘤(手术无法保留脾脏病人)以及Ⅲ~Ⅳ级脾破裂的病人中应用较多。1991年Delaitre等首次开展了腹腔镜下脾切除术(laparoscopic splenectomy, LS),此后,手助腹腔镜下脾切除术、单孔腹腔镜下脾切除术、腹腔镜下二级脾蒂离断脾切除术、机器人手术等相继开展。虽然腹腔镜技术学习曲线长,治疗费用有所增加,但却越来越被医生青睐和被病人所接受[37]。LS与开腹脾切除术比较,其创伤小,住院时间短,效果美观,恢复快,更符合目前加速术后康复理念[38]。尹强等[39]认为腹腔镜下脾脏手术时处理脾蒂一般采用先游离再离断的方法,先处理动脉再处理静脉,关键在于精细分离二级脾蒂血管,避免过度游离脾周韧带,注意观察保留脾血供情况,以防止术后缺血性脾梗死。
总之,儿童SLA发病率低,临床表现无特异性,B超、CT是首选诊断方法,早诊断早治疗是关键,大多数预后良好。脾脏是重要的免疫器官,在儿童时期显得尤为重要,发挥着无可替代的作用。外科手术方式的选择应兼顾这一重要观点,对可行部分脾切术的患儿,应积极选择脾段或脾脏部分切除的手术方式,大网膜自体脾片移植等手术方式,尽量避免“无辜性脾切除”。在“能保则保,该切则切”原则指导下,提高技术、理性保脾应是当代脾脏外科发展的方向所在,选择合适的干预时机和手术方式,能取得较好的治疗效果及远期预后。
——淋巴管系统

