4-辛基衣康酸对大鼠短暂性脑缺血再灌注模型的保护作用及机制探究
樊丽超,左秀美,周立春
脑缺血再灌注神经损伤因具有高致残性和高病死率被临床医生及学者广泛研究[1],病理生理学研究证实,该病是多种途径共同作用的结果,如氧化应激、炎症反应和血脑屏障破坏等[2-4]。因此,降低氧化应激水平和(或)抑制神经炎症是潜在治疗脑缺血再灌注损伤的有效手段。
核因子E2相关因子2(Nrf2)是抗氧化应激防御系统中的重要转录因子[5]。4-辛基衣康酸(4-OI)是衣康酸的主要衍生物之一,具有细胞渗透性,可通过烷基化kelch样ECH关联蛋白1(Keap1)的半胱氨酸残基激活Nrf2信号[6-7]。体外研究发现,4-OI能够激活Nrf2信号级联反应,导致Keap1-Nrf2分离、Nrf2胞浆积累和核易位,从而促进Nrf2依赖基因[血红素氧合酶-1(HO-1)、醌氧化还原酶1和谷氨酸-半胱氨酸连接酶催化亚基]的表达;4-OI预处理可显著抑制过氧化氢(H2O2)诱导的氧化应激,降低活性氧产生,从而抑制成骨细胞凋亡[5]。此外,4-OI还可减轻H2O2诱导的脂质过氧化效应、DNA结构损伤及神经细胞凋亡,shRNA或CRISPR/Cas9介导的Nrf2基因敲除消除4-OI的神经细胞保护作用[7]。衣康酸二甲酯(DMI)是另一种衣康酸衍生物[8]。在心肌缺血再灌注模型和缺血性脑卒中模型中,DMI可降低梗死面积,具有显著保护作用。既往研究表明,DMI促进Nrf2表达,降低氧化应激水平及白细胞介素-1β(IL-1β)含量[9-10]。4-OI是优于DMI的衣康酸衍生物,但目前4-OI在大脑中动脉栓塞(tMCAO)模型中的研究较少。因此本研究拟探讨4-OI在tMCAO模型大鼠中的保护作用及可能的病理机制。
1 材料与方法
1.1材料
1.1.1实验试剂:4-OI(MedChemExpress)、2,3,5三苯基四氮唑氯化钠(TTC,Sigma-Aldrich)、戊巴比妥钠(隆盛化工)、生理盐水(辰欣药业)、磷酸盐缓冲液(PBS,美仑生物)、丙二醛(MDA)和超氧化物歧化酶(SOD)分析试剂盒(Sigma-Aldrich)、IL-1β的ELISA定量检测试剂盒(Abcam)、BCA蛋白定量试剂盒(ThermoFisher)、兔抗Nrf2(Abcam)、兔抗HO-1(Abcam)、兔抗硫氧还蛋白互作蛋白(TXNIP) (Proteintech)、兔抗核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)(Abcam)、兔抗β-actin(Abcam)、辣根过氧化物酶(HPR)-山羊抗兔二抗(Santa Cruz)、ECL显色液(Amersham Bioscience)。
1.1.2实验仪器:摇床(点成生物)、酶标仪(ThermoFisher)、电泳系统(Invitrogen)、凝胶成像系统(Invitrogen)、冰冻切片机(ThermoFisher)。
1.1.3实验动物:雄性清洁级SD大鼠36只购于首都医科大学。实验动物许可证号:AEE1-2020-090。本实验经首都医科大学伦理委员会审批通过。
1.2方法
1.2.1实验动物分组及造模:将SD大鼠采用随机数字表法分为对照组、模型组和治疗组。对照组和模型组腹腔注射生理盐水,治疗组腹腔注射4-OI,注射剂量按100 mg/kg计算[9]。参照Longa等[11]报道的“线栓法”构建tMCAO大鼠模型:清洁级SD大鼠禁食12 h,腹腔注射4%戊巴比妥钠溶液(50 ml/kg)麻醉大鼠;脱掉颈部毛发,75%乙醇消毒,于颈中线造2 cm切口,钝性分离颈前肌和右侧胸锁乳突肌,暴露右侧颈总动脉(CCA)、颈外动脉(ECA)和颈内动脉(ICA);ECA近心端处采用手术线结扎,ICA和CCA用血管夹暂时夹闭,在距离CCA分叉约6 mm处造“V”型切口,置入直径约0.18 mm的线栓,分别经CCA和ICA分叉处进入ICA颅骨分支;线栓固定1 h后取出,恢复血流完成造模。术后动物置于恒温控制(37.0±0.5)℃的红外线灯下至其苏醒。对照组大鼠处理同模型组,其区别在于对照组不插入线栓。
1.2.2神经功能评分:采用Longa脑损伤评分表[11]评估大鼠脑损伤程度。纳入评分为2~3分大鼠,剔除评分较高或较低大鼠,每组12只。随后在造模后24 h评估各组大鼠神经功能,具体评分标准:0分为无神经功能损伤,1分为不能伸张结扎对侧前爪,2分为向结扎对侧转圈,3分为向结扎对侧倾斜,4分为无法自主行走,5分为基本无意识。
1.2.3脑梗死评估:tMCAO造模24 h后,每组大鼠随机选取6只,腹腔注射4%戊巴比妥钠50 mg/kg麻醉;灌注预冷PBS液,分离大鼠脑组织,经冷冻切片,将脑组织切成为2 mm厚的冠状切面,随后脑切片在37℃,2%TTC避光孵育30 min,染色结束后放入4%可溶性聚四氟乙烯中4℃固定过夜。次日,拍照。白色区域为脑组织梗死区,红色区域为脑组织非梗死区。用IPP 6.0计算切片的梗死面积,脑梗死面积百分比=梗死面积/脑组织总面积×100%。
1.2.4MDA、SOD和IL-1β含量检测:再灌注24 h后麻醉大鼠,心脏灌注后取缺血侧新鲜的大脑皮质组织,将其表面的附属物去除,生理盐水充分清洗,制作浓度为10%的脑匀浆。MDA、SOD和IL-1β含量检测参照各试剂盒说明书。
1.2.5蛋白检测:分离梗死区脑半球组织,RIPA液裂解后,BCA蛋白定量检测蛋白含量;取25 μg蛋白上样电泳,以β-actin作为内参,检测Nrf2、HO-1、NXNIP和NLRP3蛋白相对表达量。一抗孵育液浓度分别为Nrf2(1∶1000)、HO-1 (1∶1000)、TXNIP(1∶500)、NLRP3(1∶500)、β-actin抗体(1∶2500),于4℃缓慢水平摇动孵育过夜;充分清洗3次,按比例加入二抗(1∶3000),室温孵育1 h。按照ECL plus化学发光试剂盒使用者手册操作步骤进行显色,凝胶成像系统扫描并拍照。目标蛋白相对表达量为目标蛋白条带灰度值/β-actin条带灰度值。
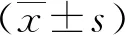
2 结果
2.1大鼠神经功能损伤比较 3组大鼠的神经功能评分分别为对照组(0.50±0.20)分、模型组(4.40±0.50)分、治疗组(3.20±0.40)分。与对照组比较,模型组神经功能评分增高,差异有统计学意义(P<0.01)。与模型组比较,治疗组神经功能评分降低,差异有统计学意义(P<0.01)。见图1。

图1 3组大鼠神经功能损伤比较
2.2大鼠脑梗死面积百分比比较 3组大鼠脑梗死面积百分比分别为对照组(1.26±0.13)%、模型组(18.93±3.46)%、治疗组(11.82±1.87)%。与对照组比较,模型组脑梗死面积百分比显著增高,差异有统计学意义(P<0.01);与模型组比较,治疗组脑梗死面积百分比降低,差异有统计学意义(P<0.01)。见图2。
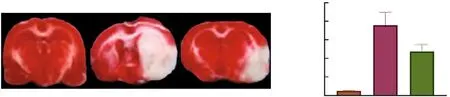
图2 3组大鼠脑梗死面积比较
2.3大鼠脑组织中MDA和SOD含量比较 3组大鼠脑组织中MDA含量分别为对照组(1.02±0.16 )nmol/mg、模型组(7.56±0.43)nmol/mg、治疗组(4.79±0.48)nmol/mg。3组大鼠脑组织中SOD含量分别为对照组(16.63±2.22 )U/mg、模型组(5.82±1.45)U/mg、治疗组(10.57±1.81)U/mg。与对照组比较,模型组MDA含量显著升高,SOD含量显著降低,差异有统计意义(P<0.01)。与模型组比较,治疗组MDA含量显著降低,SOD含量显著增高,差异均有统计学意义(P<0.01)。见图3。

图3 3组大鼠脑组织中MDA和SOD含量比较
2.4大鼠脑组织中IL-1β含量比较 3组大鼠脑组织中IL-1β含量分别为对照组(157.81±26.24)nmol/mg、模型组(298.54±38.29)nmol/mg、治疗组为(226.76±25.35)nmol/mg。与对照组比较,模型组IL-1β含量显著升高,差异有统计学意义(P<0.01)。与模型组比较,治疗组IL-1β含量降低,差异有统计学意义(P<0.01)。见图4。
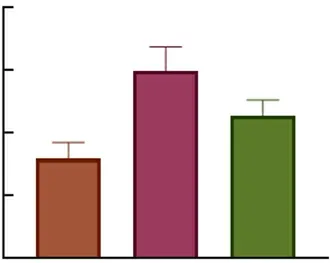
图4 3组大鼠脑组织中IL-1β水平比较
2.54-OI对Nrf2/HO-1和TXNIP/NLRP3信号通路的影响 与对照组比较,模型组和治疗组Nrf2、HO-1蛋白表达量显著增高,且治疗组高于模型组,差异有统计学意义(P<0.01)。与对照组比较,模型组和治疗组TXNIP、NLRP3蛋白表达量显著增高,但治疗组低于模型组,差异有统计学意义(P<0.01)。见图5、6。
图5 3组大鼠脑组织Nrf2/HO-1/TXNIP信号通路相关蛋白免疫印迹图
3 讨论
越来越多研究表明,氧化应激水平升高是脑缺血再灌注导致神经损伤的重要因素之一[12-13]。髓过氧化物酶是中性粒细胞活化过程中分泌的一种蛋白,是反映炎症程度的指标之一;而SOD是机体中一种重要的抗氧化酶[14]。研究证实在脑缺血再灌注引起的脑组织损伤中氧化终产物MDA含量升高,而具有抗氧化作用的SOD含量降低[15-16],提示氧化应激水平异常改变与脑缺血再灌注损伤密切相关。本研究结果显示,与模型组比较,治疗组MDA含量降低,SOD水平升高。因此,4-OI对脑缺血再灌注模型大鼠脑组织损伤起保护作用,可能与其能够降低氧化应激水平有关。
NLRP3炎性小体在缺血再灌注脑损伤过程中起重要作用[17-18],其可通过Caspase-1促进炎性细胞因子如IL-1β的合成与释放[19]。本研究结果显示,与对照组比较,模型组大鼠脑组织中NLRP3蛋白表达量升高。提示4-OI预处理可降低NLRP3蛋白水平,抑制tMCAO诱导的IL-1β含量,从而发挥抗炎作用。此外,NLRP3与TXNIP之间具有强烈的相互作用[17]。在急性肾损伤和糖尿病的研究中均证实,TXNIP与NLRP3结合并可协同激活炎性小体[20-21]。在脑缺血再灌注损伤模型中,TXNIP和NLRP3表达具有相同趋势[22-23]。本研究结果显示,模型组TXNIP表达量显著升高,治疗组TXNIP表达水平显著降低。与前期研究结果一致,提示通过抑制NLRP3炎性小体可降低炎性因子IL-1β的合成与释放。此外,有研究表明,在急性脑缺血损伤模型中,Nrf2的激活减弱了TXNIP和NLRP3炎性小体的表达[17];本研究结果与既往研究结果一致。在脑缺血再灌注模型中,由于异常氧化应激的产生,导致Nrf2及其下游HO-1蛋白表达升高,机体启动“自我保护”程序。在此基础上,预防性给予4-OI可进一步提高Nrf2和HO-1蛋白表达量,从而抑制TXNIP/NLRP3的激活,降低IL-1β炎性因子释放和炎症反应,可发挥保护脑组织的作用。

图6 4-OI对Nrf2/HO-1/TXNIP信号通路相关蛋白表达的影响
本研究首次验证了4-OI在脑缺血再灌注模型大鼠脑组织损伤中的保护作用及病理和分子机制,为以4-OI为基础的药物开发和临床应用奠定理论基础。但研究也存在一定的不足之处,临床中缺血性脑卒中类型多样,tMCAO再灌注模型并不能完全模拟临床脑缺血再灌注发病情况。此外,机体抗氧化通路和炎症通路多样,4-OI或许亦可通过其他通路发挥作用,有待进一步深入探究。
综上所述,4-OI可减小脑组织梗死区域,改善神经功能,因此在脑缺血再灌注损伤中起保护作用,其机制与Nrf2/HO-1抗氧化通路增强和TXNIP/NLRP3炎症信号通路抑制有关,提示4-OI具有开发预防tMCAO药物的潜质。

