c-FLIP不同单体沉默对重症急性胰腺炎大鼠中性粒细胞凋亡的影响研究
李 鹏,夏春辉,冯 凯,李志强
急性胰腺炎(acute pancreatitis, AP)是常见的急性腹部疾病,可分为轻度急性胰腺炎、中度重症急性胰腺炎和重症急性胰腺炎(SAP)[1-2]。SAP病死率约为38.4%,常导致全身炎症反应综合征(SIRS),进而引起早期多器官功能不全综合征(MODS)[3-4]。由于胰腺坏死和脓毒症均可发展为晚期MODS;因此抑制SIRS,在SAP早期治疗中至关重要。中性粒细胞是炎症过程中的重要效应细胞,SIRS患者外周血中性粒细胞凋亡延迟,寿命延长并过度激活;可释放大量炎性介质损伤正常组织和细胞,继而加重SIRS病情,最终导致SAP发展成为了MODS[5-6]。
细胞型Fas相关死亡域样白细胞介素-1β转换酶抑制蛋白(c-FLIP)可通过竞争性结合受体相互作用蛋白1(RIP1)和半胱氨酸天冬氨酸蛋白酶-8(Caspase-8)阻断信号传导形成和Caspase-8的活化,从而阻断Fas介导的凋亡信号传导,起到抑制凋亡的作用[7-8]。c-FLIP主要包括两种单体型,即长c-FLIP(c-FLIPL)和短c-FLIP(c-FLIPS),二者均能抑制死亡受体介导的细胞凋亡,但它们具有不同的生物学功能[6]。最新研究发现,c-FLIP与RIP1、Caspase-8、Fas相关死亡结构域蛋白(FADD)形成复合体,随后可能产生三种不同的生物学效应,高表达c-FLIPS通过抑制Caspase-8的表达,加速释放RIP1后激活坏死性凋亡通路[9-10]。目前尚无关于c-FLIP与SAP发病机制关系的报道,因此本研究拟探讨c-FLIP不同单体沉默对SAP大鼠血液中性粒细胞凋亡的影响,为SAP的治疗提供理论基础。
1 材料与方法
1.1实验动物 清洁级SD雄性大鼠60只,8周龄,体质量(230±10)g,购自山东大学实验动物中心,动物生产许可证号:SCXK(鲁)2019-0002,动物使用许可证号:SYXK(鲁)2019-0013,动物质量合格证号:HG5300176,动物饲养环境:温度22~25℃,湿度50%~60%。
1.2主要试剂及仪器 RPMI 1640培养液(德国默克公司,批号:QW12014);热灭活新生牛血清(新西兰Gibco公司,批号:26010-092);青霉素、链霉素(美国sigma公司,批号CX1264、WS2547);磷酸盐缓冲液(PBS)、RIPA裂解缓冲液、BCA蛋白定量试剂盒、增强的ECL化学发光试剂均购于上海碧云天公司(批号:JH12745、SD21458、C503021、SF10036);膜联蛋白V-异硫氰酸荧光素/碘化丙啶(Annexin V-FITC/PI)凋亡检测试剂盒、Trizol试剂盒(杭州联科生物技术股份有限公司,批号:EK206S、EK106);逆转录试剂盒、聚偏二氟乙烯膜购自上海桥星贸易有限公司(批号:A4100、A6211);SYBR Premix Ex TagTM Ⅱ荧光定量PCR试剂盒(日本Takara公司,批号:XS620147);c-FLIPS、c-FLIPL、RIP1、Caspase-8、β-actin一抗、辣根过氧化物酶(HRP)耦联的二抗均购自美国BD Biosciences公司(批号:B65487、B25416、B20126、B63544、B10018)。HF-240型全自动生化分析仪(泰安市康宇医疗器械有限公司);CX23型显微镜(奥林巴斯公司);FACSCalibur型流式细胞仪(美国BD Biosciences公司);NanoDrop 8000型分光光度计(美国赛默飞世尔科技公司);7300型荧光定量PCR仪(美国ABI公司);ChemiDocXRS+型凝胶成像仪(美国BIO-RAD公司)。
1.3siRNA制备 参照c-FLIP的RefSeq序列及siRNA的设计原理,设计格式为AA19NTT、长度为21 bp的siRNA。由美国Ambion公司分别设计3条靶向于c-FLIPL及c-FLIPS单体基因不同位点的siRNA序列,即为:c-FLIP siRNA-NC、c-FLIPS siRNA、c-FLIPL siRNA。
1.4动物造模、分组及给药
1.4.1动物造模:选取50只大鼠给予3%戊巴比妥钠(30 mg/kg)腹腔注射麻醉并固定,于剑突下约3 cm处腹壁正中分层剪开皮毛、腹肌,循胃、十二指肠球及降部,暴露胰腺区域,找到主胰管,以24 G静脉套管针于主胰管对侧肠蹙刺入肠腔,稍退出针芯,循乳头将软套管穿入主胰胆管约0.5 cm,动脉夹固定,另于主胰胆管上游近肝门处动脉夹钳夹。3%牛磺胆酸钠溶液30 mg/kg,以12 ml/h速度微量泵注入,注射后拔除套管针。为保证模型制作稳定,将牛磺胆酸钠溶液中加入美兰溶液1滴,注射成功时可清晰显示胰管走行,并且蓝色溶液未漏入肠腔[11]。
1.4.2动物分组及给药:本次造模大鼠共死亡7只,造模成功率为86.00%(43/50),随机处死3只大鼠,并将剩余40只大鼠按随机数字表法分为对照组、c-FLIP siRNA-NC组、c-FLIPS siRNA组、c-FLIPL siRNA组,每组10只。检测4组大鼠血清淀粉酶、丙氨酸氨基转移酶、血肌酐水平,获取胰腺病理组织以确定SAP造模是否成功。另取10只大鼠为假手术组,假手术组大鼠将3%牛磺胆酸钠溶液替换为生理盐水,其余手术步骤同造模大鼠一致。假手术组无大鼠死亡,成功率100.00%。c-FLIP siRNA-NC组、c-FLIPS siRNA组、c-FLIPL siRNA组大鼠一次性尾静脉注射对应siRNA溶液1 nmol/ml[前期预实验得出c-FLIPS siRNA、c-FLIPL siRNA对SAP大鼠的半数有效量(ED50)为2 nmol/ml,以1/2 ED 50为本实验作用剂量],注射体积为10 ml/kg;假手术组、对照组尾静脉注射等量生理盐水,转染后72 h进行后续的各项指标检测。
1.5大鼠腹水量、血清淀粉酶测定及胰腺组织病理 3%戊巴比妥钠腹腔注射(30 mg/kg)麻醉各组大鼠,开腹,记录腹水量,获取其胰腺组织和血液。3000×g离心分离血清后,采用全自动生化分析仪测定血清淀粉酶水平。并将胰腺组织固定于4%甲醛中,石蜡包埋,4 μm连续切片,苏木素-伊红(HE)染色后,用显微镜观察并拍照。
1.6大鼠中性粒细胞分离、培养及凋亡水平测定 取各组大鼠下腔静脉血液3 ml肝素抗凝,注入含有30 g/L葡聚糖的离心管中,混匀,于37℃恒温水浴箱中静置45 min,进行红细胞自然沉降;取上层液至另一离心管,3000×g离心10 min,去上清;将沉淀重悬于含3%小牛血清的PBS中,再轻轻地铺在等体积的淋巴细胞分离液上,水平离心机2000×g离心20 min,去上清加入1 ml无菌冰水30 s,溶解红细胞;立即加入20 g/L 氯化钠溶液1 ml充分混匀,恢复等渗,2000×g离心10 min,去上清;将沉淀以RPMI 1640培养液2000×g离心10 min洗2次;以含10%热灭活新生牛血清、青霉素100 U/ml、链霉素100 U/ml的RPMI 1640培养液悬浮细胞,调整细胞浓度为5×106/ml,培养24 h。培养结束后,收集细胞并用冰PBS洗涤,然后将细胞重悬于PBS,加入5 μl Annexin V-FITC和5 μl PI,黑暗中孵育10 min后,采用流式细胞仪检测细胞凋亡。凋亡率=凋亡细胞数/(凋亡细胞数+正常细胞数)×100%。
1.7大鼠中性粒细胞中c-FLIPS、c-FLIPL、RIP1、Caspase-8 mRNA水平测定 使用Trizol试剂从大鼠中性粒细胞中分离总RNA,并保存在80℃环境下,使用分光光度计测量RNA浓度和纯度,所有样品的OD 260/280为1.8~2.0,使用反转录试剂盒将总RNA合成cDNA。PCR反应在实时荧光定量PCR仪中进行,引物由杭州联科生物技术股份有限公司合成。引物序列分别为c-FLIPS:正向5'-CCCTGGTCAAATTGCTTAACCT-3',反向5'-TTATTCGTCCCTCTGTTTTATG-3';c-FLIPL:正向5'-CAGTGTGACTAAATTGTTGTGACTGTGA-3',反向5'-CTGTGACTGATGGTCCCTCTGTCTGTGT-3';RIP1:正向5'-CTCGTGCTGACTGTGCTGATCGTATTGTCGTCGATG-CTAGCAA-3',反向5'-CGGGTCGTGCGGCTAGTGGTCCCTCTGCCGTGTAAATGCTTG-3';Caspase-8:正向5'-CTCATCGTAGTGCTAGCTAGTCTCCCGTAGTAC-3',反向5'-CCGTAGTAGTCGATCCCTCTGTTCGCGCGTAGC-3;GAPDH:正向5'-CCACATCGCTCAGACACCAT-3',反向5'-ACCAGGCGCCCAATACGTGA-3'。将循环程序设定为在95℃初始保持10 min,然后在95℃变性,持续15 s,共40个循环,在50℃退火和延伸30 s,在72℃延伸15 s。使用2-ΔΔCt方法分析c-FLIPS、c-FLIPL、RIP1、Caspase-8 mRNA的相对表达,标准化为GAPDH。
1.8大鼠中性粒细胞中c-FLIPS、c-FLIPL、RIP1、Caspase-8 蛋白水平测定 在RIPA裂解缓冲液中裂解中性粒细胞,并在4℃下以3000×g离心10 min,提取蛋白质上清液,BCA试剂盒测定蛋白质浓度。使用聚丙烯酰胺凝胶电泳将总蛋白分级分离并转移至聚偏二氟乙烯膜上,将膜在含有TBST缓冲液的3%新生牛血清白蛋白中封闭1 h,然后在4℃下与c-FLIPS、c-FLIPL、RIP1、Caspase-8、β-actin一抗(稀释比均为1∶1000)孵育过夜,然后加入HRP耦联的二抗(1∶5000稀释)在室温下孵育2 h,使用增强的ECL化学发光试剂检测生成的蛋白质,并将其暴露在暗室中。使用ChemiDocXRS+系统扫描条带,蛋白质水平的定量分析被标准化为β-actin水平。
2 结果
2.1大鼠腹水量、血清淀粉酶水平比较 与假手术组比较,对照组、c-FLIP siRNA-NC组腹水量、血清淀粉酶水平升高,差异有统计学意义(P<0.05);但对照组与c-FLIP siRNA-NC组腹水量、血清淀粉酶水平比较差异无统计学意义(P>0.05)。与对照组和c-FLIP siRNA-NC组比较,c-FLIPS siRNA组、c-FLIPL siRNA组腹水量、血清淀粉酶水平降低,差异有统计学意义(P<0.05);但c-FLIPS siRNA组与c-FLIPL siRNA组腹水量、血清淀粉酶水平比较差异无统计学意义(P>0.05)。见表1。
表1 5组大鼠腹水量、血清淀粉酶水平比较
2.2大鼠胰腺组织病理比较 假手术组胰腺组织结构正常;对照组、c-FLIP siRNA-NC组胰腺组织坏死严重、崩解,胰腺细胞排列紊乱,可见大量炎性细胞浸润;c-FLIPS siRNA组、c-FLIPL siRNA组坏死胰腺细胞减少,炎性细胞浸润减少,但胰腺组织疏松紊乱。见图1。

图1 5组大鼠胰腺组织病理图(HE×400)
2.3大鼠中性粒细胞凋亡率比较 5组大鼠的中性粒细胞凋亡率分别为假手术组(12.36±0.65)%、对照组(6.63±0.52)%、c-FLIP siRNA-NC组(6.78±0.45)%、c-FLIPS siRNA组(10.21±0.36)%、c-FLIPL siRNA组(10.45±0.45)%。与假手术组比较,对照组和c-FLIP siRNA-NC组中性粒细胞凋亡率降低,差异有统计学意义(P<0.05);但对照组与c-FLIP siRNA-NC组中性粒细胞凋亡率比较差异无统计学意义(P>0.05)。与对照组和c-FLIP siRNA-NC组比较,c-FLIPS siRNA组、c-FLIPL siRNA组中性粒细胞凋亡率升高,差异有统计学意义(P<0.05);但c-FLIPS siRNA组与c-FLIPL siRNA组中性粒细胞凋亡率比较差异无统计学意义(P>0.05)。
2.4大鼠中性粒细胞c-FLIPS、c-FLIPL、RIP1、Caspase-8 mRNA表达水平比较 与假手术组比较,对照组和c-FLIP siRNA-NC组中性粒细胞c-FLIPS、c-FLIPL mRNA表达水平升高,RIP1、Caspase-8 mRNA表达水平降低,差异有统计学意义(P<0.05);但对照组与c-FLIP siRNA-NC组上述指标比较差异无统计学意义(P>0.05)。与对照组和c-FLIP siRNA-NC组比较,c-FLIPS siRNA组、c-FLIPL siRNA组中性粒细胞c-FLIPS、c-FLIPL mRNA表达水平降低,RIP1、Caspase-8 mRNA表达水平升高,差异有统计学意义(P<0.05)。但c-FLIPS siRNA组与c-FLIPL siRNA组上述指标比较差异无统计学意义(P>0.05)。见表2。
表2 5组大鼠中性粒细胞c-FLIPS、c-FLIPL、RIP1、Caspase-8 mRNA表达水平比较
2.5大鼠中性粒细胞c-FLIPS、c-FLIPL、RIP1、Caspase-8蛋白表达水平比较 与假手术组比较,对照组和c-FLIP siRNA-NC组中性粒细胞c-FLIPS、c-FLIPL蛋白表达水平升高,RIP1、Caspase-8蛋白表达水平降低,差异有统计学意义(P<0.05);但对照组与c-FLIP siRNA-NC组上述指标比较差异无统计学意义(P>0.05)。与对照组和c-FLIP siRNA-NC组比较,c-FLIPS siRNA组和c-FLIPL siRNA组中性粒细胞c-FLIPS、c-FLIPL蛋白表达水平降低,RIP1、Caspase-8蛋白表达水平升高,差异有统计学意义(P<0.05)。但c-FLIPS siRNA组与c-FLIPL siRNA组上述指标比较差异无统计学意义(P>0.05)。见表3、图2。
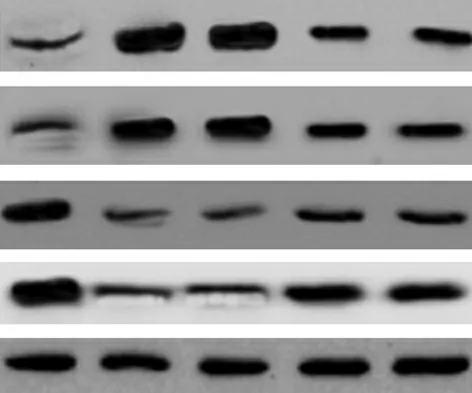
图2 5组大鼠中性粒细胞c-FLIPS、c-FLIPL、RIP1、Caspase-8蛋白免疫印迹图
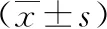
表3 5组大鼠中性粒细胞c-FLIPS、c-FLIPL、RIP1、Caspase-8蛋白表达水平比较
3 讨论
机体内中性粒细胞凋亡为坏死性凋亡,是细胞坏死的一种可调控类型,在实验性AP的发生发展中起着重要作用。本研究结果显示,与对照组和c-FLIP siRNA-NC组比较,c-FLIPS siRNA组、c-FLIPL siRNA组腹水量、血清淀粉酶降低,中性粒细胞凋亡率升高;这提示沉默c-FLIP的两种单体c-FLIPS、c-FLIPL可明显促进SAP大鼠血液中性粒细胞凋亡,进而对大鼠SAP具有明显缓解作用。文献报道,相同剂量的雨蛙素诱导大鼠AP模型,为急性水肿型胰腺炎,腺泡细胞以凋亡为主;并发现大鼠AP模型中存在c-FLIP的明显激活,进一步用c-FLIP抑制剂作用于AP大鼠,发现腺泡细胞凋亡较少,临床症状减轻,提示c-FLIP抑制剂对雨蛙素诱导的大鼠AP模型起到明显的保护作用[12]。雨蛙素诱导的c-FLIP基因敲除大鼠AP模型中腺泡细胞坏死明显减少,大剂量的胆囊收缩素可导致大鼠发生水肿型胰腺炎,并从中观察到c-FLIP的激活,当特异性抑制c-FLIP时,大鼠胰腺中坏死的腺泡细胞明显减少,AP炎症反应减轻;提示坏死性凋亡c-FLIP激活可能是SAP加重的重要原因[13]。本研究结果显示,假手术组胰腺组织结构正常;对照组和c-FLIP siRNA-NC组胰腺组织坏死严重、崩解,胰腺细胞排列紊乱,可见大量炎性细胞浸润;c-FLIPS siRNA组和c-FLIPL siRNA组坏死胰腺细胞减少,炎性细胞浸润减少,但胰腺组织疏松紊乱。也说明沉默c-FLIP的两种单体c-FLIPS、c-FLIPL对大鼠的SAP具有保护作用。
坏死性凋亡是一种肿瘤坏死因子-α(TNF-α)诱导的RIP1调控的非Caspase依赖性细胞凋亡方式[14-15]。TNF-α与其受体肿瘤坏死因子受体-1结合后,诱导复合物I合成[16-17];该复合物可抑制RIP1去泛素化,从而导致胞浆内FADD、RIP1和Caspase-8形成复合物;Caspase-8的存在阻止了RIP1与受体相互作用蛋白3结合,此时复合物诱导细胞发生经典形式的凋亡[18]。
在Caspase-8被抑制或不能有效激活时,有活性的RIP1与RIP3结合形成复合物,将导致细胞发生坏死性凋亡[19]。c-FLIP在结构上与Caspase-8相似,但无Caspase-8所具有的蛋白水解酶活性;传统认为c-FLIP通过竞争性结合FADD和Caspase-8阻断信号传导形成和Caspase-8的活化,从而阻断Fas介导的凋亡信号转导,起到抑制凋亡的作用[20]。最新研究发现,高表达c-FLIPS通过抑制Caspase-8的表达,加速释放RIP1后激活坏死性凋亡通路;高表达c-FLIPL可促进降解RIP1,四聚体解聚、凋亡与坏死性凋亡通路均被阻断,细胞维持生存状态[21]。c-FLIP低表达时,Caspase-8被激活,诱导细胞发生经典细胞凋亡[22]。目前为止,不同单体型c-FLIP对Caspase-8的调控机制还不完全清楚;但c-FLIP不同单体型对细胞凋亡、坏死等不同细胞状态的转化起重要作用。c-FLIP可能通过不同单体型对Caspase-8进行多重调控,在细胞经典凋亡与坏死性凋亡间的相互转化发挥重要作用[23]。本研究结果显示,与对照组和c-FLIP siRNA-NC组比较,c-FLIPS siRNA组、c-FLIPL siRNA组大鼠中性粒细胞c-FLIPS、c-FLIPL mRNA和蛋白表达水平降低,RIP1 mRNA和蛋白、Caspase-8 mRNA和蛋白表达水平升高。说明了沉默c-FLIP的两种单体c-FLIPS、c-FLIPL能明显抑制SAP大鼠血液中性粒细胞c-FLIPS、c-FLIPL mRNA和蛋白水平的表达,促进RIP1、Caspase-8 mRNA和蛋白水平的表达,进而激活坏死性凋亡途径,这也与上述讨论一致。
综上所述,沉默c-FLIP的两种单体c-FLIPS、c-FLIPL可明显促进SAP大鼠血液中性粒细胞凋亡并对SAP具有明显缓解作用;其机制与沉默c-FLIP的两种单体c-FLIPS、c-FLIPL能明显抑制SAP大鼠血液中性粒细胞c-FLIPS mRNA和蛋白、c-FLIPL mRNA和蛋白水平的表达,促进RIP1 mRNA和蛋白、Caspase-8 mRNA和蛋白水平的表达,进而激活坏死性凋亡途径有关。

