UHPLC-MS/MS法同时测定啤酒中4种嘌呤
林钦恒,李圣男,邓远强,郑家概
广东省科学院测试分析研究所(中国广州分析测试中心),广东省化学危害应急检测技术重点实验室,广东省保健食品功效成分检测与风险物质快速筛查工程技术研究中心(广州 510070)
嘌呤是一类由一个嘧啶环和一个咪唑环稠和而成的生物碱类物质,主要包括腺嘌呤、鸟嘌呤、次黄嘌呤、黄嘌呤及其衍生物[1],是生物体内核酸的重要组成部分,在代谢调节、能量供应、组成辅酶等方面起着重要作用[2]。嘌呤在体内经代谢变化后的产物为尿酸,嘌呤代谢异常或尿酸排泄受阻时会导致血液中尿酸含量过高,从而引发高尿酸血症,并可发展为痛风、高血压、糖尿病等多种代谢慢性疾病[3-4]。
嘌呤广泛存在于食品中,食物摄入是人体外源获取嘌呤的主要途径[5]。研究发现,长期大量摄入高嘌呤食物可明显影响人体血液尿酸水平,增加高尿酸血症和痛风等疾病的发病率[6],限制高嘌呤食物的摄入,并改善饮食结构是缓解相关疾病的重要方式。高嘌呤食物主要集中在消费量较大的畜禽肉类、鱼虾贝类、大豆及蔬菜类等制品[7]。随着经济水平的发展,啤酒等饮料也成为饮食中重要组成部分,研究显示市售啤酒中的嘌呤物质含量较高,约40~136 mg/L[8],相关研究也表明,长期饮用啤酒是高尿酸血症发作的重要诱因[9],啤酒与痛风之间存在着较高的依存关系[8]。因而充分了解啤酒中嘌呤含量的数据具有重要意义,能为啤酒爱好者和高尿酸血症患者的科学膳食提供一定指导。
国内外尚未建立啤酒中腺嘌呤、鸟嘌呤、次黄嘌呤和黄嘌呤含量的准确统一的测定方法,而食品中的嘌呤含量的检测方法主要有高效液相色谱法、液相色谱串联质谱法[10]、气相色谱法和毛细管电泳法[5]等,也有报道将嘌呤转化为尿酸的间接测定法[11-12]。其中,高效液相色谱法最常应用于啤酒等酒类中4种嘌呤的检测[1,13-14],具有操作简便、灵敏度高、成本较低的优点,但由于4种嘌呤均属于弱碱性物质,在C18色谱柱上的保留度较差,而采用紫外检测器仅依靠保留时间定性,因此该法往往具有分离度差、效率较低、假阳性率高、准确度低的问题。
试验在相关研究基础上,应用超高效液相色谱串联三重四极杆质谱技术,建立同时测定啤酒中4种嘌呤含量的方法,可应用于实际样品的检测,为膳食结构中饮用啤酒饮料的合理安排提供理论依据和参考。
1 材料与方法
1.1 仪器与试剂
Agilent 1290 6460A超高效液相色谱串联三重四极杆质谱仪(美国Agilent公司);BSA224S电子分析天平(精度0.000 1 g,赛多利斯科学仪器公司);KQ-2200超声波清洗器(昆山市超声仪器有限公司);WBK-4B电热恒温水浴锅(上海浦东荣丰科学仪器公司);Milli-Q超纯水机(美国Millipore公司)。
腺嘌呤、鸟嘌呤、次黄嘌呤、黄嘌呤标准品(纯度>98.0%,中国药品生物制品检定所);甲醇(色谱纯,美国Honeywell公司);甲酸(色谱纯,纯度>98.0%,阿拉丁试剂(上海)有限公司);三氟乙酸(色谱纯,纯度>98.0%,阿拉丁试剂(上海)有限公司);试验用水为超纯水;其余试剂(均为分析纯,购自广州化学试剂厂);啤酒样品(市售)。
1.2 标准溶液的配制
准确称取适量腺嘌呤、鸟嘌呤、次黄嘌呤、黄嘌呤标准品,分别置于25 mL容量瓶中,加入水超声溶解(嘌呤不易溶解于水可加入NaOH或HCl助溶),分别配制成质量浓度约500 mg/L的标准储备溶液,于4 ℃保存。分别取适量的4种标准储备溶液,用水稀释配制成质量浓度约10 mg/L的混合标准储备液,再进一步稀释成合适的梯度浓度,制作标准工作曲线。
1.3 样品前处理
将啤酒样品超声脱气,过滤,取1.0 mL于10 mL具塞试管中,加入0.2 mL三氟乙酸和0.2 mL甲酸,摇匀,置于沸水浴100 ℃下水解1 h,取出,冷却至室温,用NaOH溶液调节pH至中性,加水定容至10 mL,经0.22 μm滤膜过滤,以备分析。若含量太高可依需要用水进行稀释。
1.4 分析条件
1.4.1 色谱条件
色谱柱:Agilent Poroshell 120 EC-C18(3.0 mm×150 mm,2.7 μm);流动相:甲醇(A)-水(B),梯度洗脱(0.0~5.5 min,0%~6% A;5.5~7.5 min,100% A;7.5~11.0 min,0% A);流速0.4 mL/min;柱温35 ℃;进样量2 μL。
1.4.2 质谱条件
离子源:带鞘气流的电喷雾离子源(AJS ESI)。扫描模式:正离子模式。检测模式:多反应监测(MRM)。离子源参数:干燥气温度350 ℃;干燥气流速6.0 L/min;鞘气温度350 ℃;鞘气流速11.0 L/min;雾化气压力40 psi;毛细管电压4 000 V。
2 结果与讨论
2.1 水解条件的选择
尤玉如等[15]的研究显示,使用三氟乙酸-甲酸(1∶1)混合液100 ℃水解1 h,啤酒中嘌呤的提取效果最好;陆春梅等[13]研究表明,三氟乙酸-甲酸-啤酒比例0.2∶0.2∶1时,测得的嘌呤总含量最高。因此,在上述研究基础上,采用三氟乙酸-甲酸-啤酒比例0.2∶0.2∶1,在沸水浴中水解1 h,作为样品前处理酸水解的条件。
将4种嘌呤质量浓度约1 mg/L的混合标准溶液按上述条件进行水解,重复6次,并通过与未水解的混合标准溶液比对计算平均回收率,考察嘌呤在该水解条件下的损失率。结果显示,腺嘌呤、鸟嘌呤、次黄嘌呤和黄嘌呤平均回收率分别为95.1%,93.7%,92.5%和94.0%,说明在该水解条件下,游离嘌呤被分解和破坏的程度较小,损失较少,效果良好。
2.2 色谱条件的优化
提高4种嘌呤组分在色谱柱上的分离度有利于数据结果的准确度。试验比较3种实验室常用的Agilent色谱柱Poroshell 120 EC-C18(3.0 mm×150 mm,2.7 μm)、Poroshell 120 EC-C18(4.6 mm×50 mm,2.7 μm)和SB-C18(2.1 mm×50 mm,1.8 μm),结果显示采用Poroshell 120 EC-C18(3.0 mm×150 mm,2.7 μm)时,4种嘌呤的分离度相对最优。在该色谱柱上,考察3种流动相体系:甲醇-含0.1%甲酸和0.5 mmol/L酸铵水溶液、甲醇-0.5 mmol/L乙酸铵水溶液、甲醇-水。结果显示,采用含0.1%甲酸和0.5 mmol/L乙酸铵水溶液时,腺嘌呤和鸟嘌呤的保留时间均为3.5 min,不能有效分离;采用0.5 mmol/L乙酸铵水溶液时,鸟嘌呤和次黄嘌呤保留时间接近,均为3.7 min;采用甲醇-水作为流动相时,4种嘌呤组分的分离效果相对达到最佳(见图1)。因此,选择Poroshell 120 EC-C18(3.0 mm×150 mm,2.7 μm)为色谱柱,甲醇-水作为流动相体系。

图1 4种嘌呤标准品的TIC色谱图
2.3 质谱条件优化
分别将4种嘌呤质量浓度约1 mg/L的标准溶液在正离子检测模式下进行电离和一级质谱扫描,得到稳定的[M+H]+准分子离子峰后,对其进行二级质谱分析,得到子离子的质量数,并将在MRM模式下继续优化子离子的碰撞能量等参数,使得其响应达到最优。最终得到4种嘌呤的最佳质谱参数,结果见表1,采集得到的MRM色谱图见图2。

表1 优化的质谱条件参数
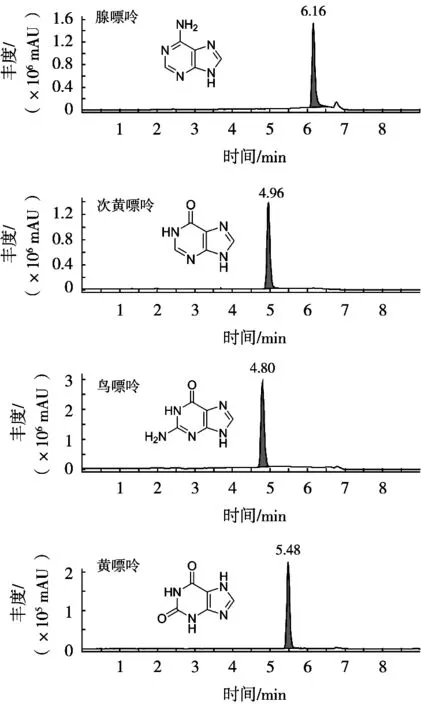
图2 4种嘌呤标准品的MRM色谱图
2.4 线性关系、检出限及定量限
将1.2配制的标准工作溶液进样分析,分别以4种嘌呤标准品的质量浓度(X,mg/L)为横坐标,定量离子的峰面积(Y)为纵坐标,进行线性回归分析,得到回归方程,并按照各组分的信噪比S/N=3对应的质量浓度计算检出限,以S/N=10对应的质量浓度计算定量限。结果表明(见表2),4种嘌呤组分在各自的质量浓度范围内和峰面积线性关系良好,相关系数(r2)均大于0.999,检出限(LOD)为6.0~12 μg/L,定量限(LOQ)为20~40 μg/L,相比于目前常用的高效液相色谱法,检测灵敏度得到了提高(文献[1]检出限为0.02~0.17 mg/L)。

表2 4种的嘌呤标准曲线、相关系数、检出限与定量限
2.5 加标回收率与精密度
选择合适的啤酒样品进行嘌呤含量的加标回收试验。先按试验条件处理分析测得本底值(n=4),以相对于本底值约50%,100%和150%的3个浓度水平添加嘌呤含量,每个加标水平平行测定6次,并通过校正样品本底值的方式计算平均回收率,同时计算相对标准偏差(δRSD)。结果如表3所示,加标样品的平均回收率为80.5%~98.2%,δRSD(n=6)为1.3%~4.2%,说明该方法的准确度符合一般检测的要求。
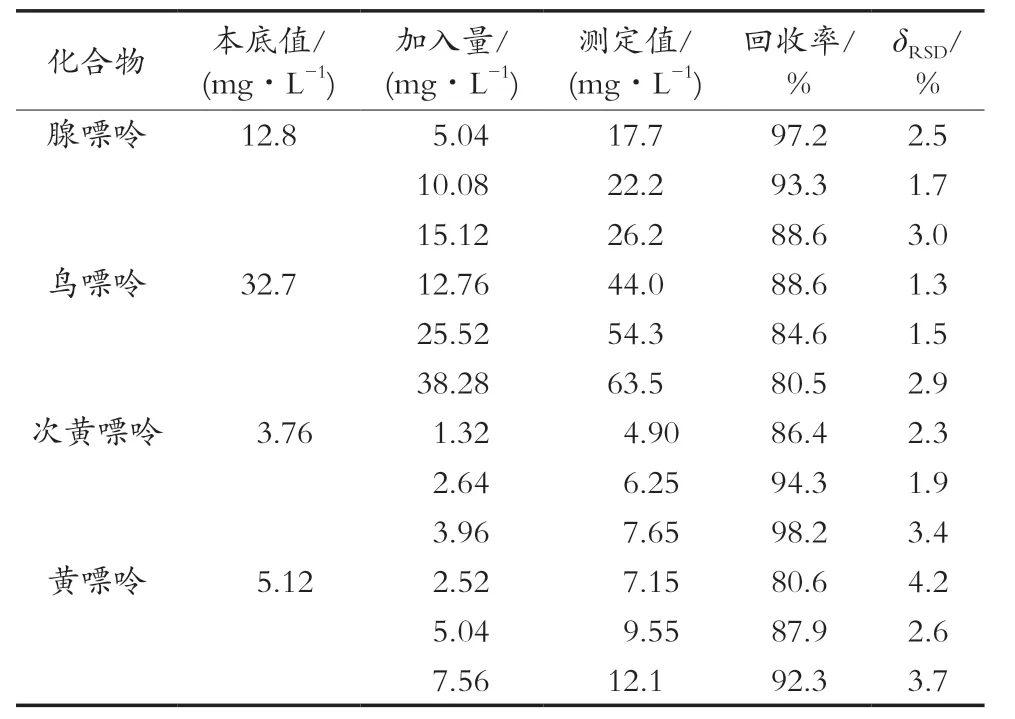
表3 加标回收率与相对标准偏差
2.6 实际样品的测定
采用该方法对购自超市的10种啤酒饮料进行4种嘌呤含量的测定,并通过加和计算总嘌呤含量,检测结果见表4。其中,10号样品为菠萝啤,其原料及工艺和啤酒不同,故嘌呤含量比较低。由表4可知,啤酒(1~9号)中鸟嘌呤的含量最高,占总嘌呤含量的51.9%~65.7%,总嘌呤含量为36.4~60.4 mg/L,说明啤酒属于高嘌呤食品,饮食中应予以限制。
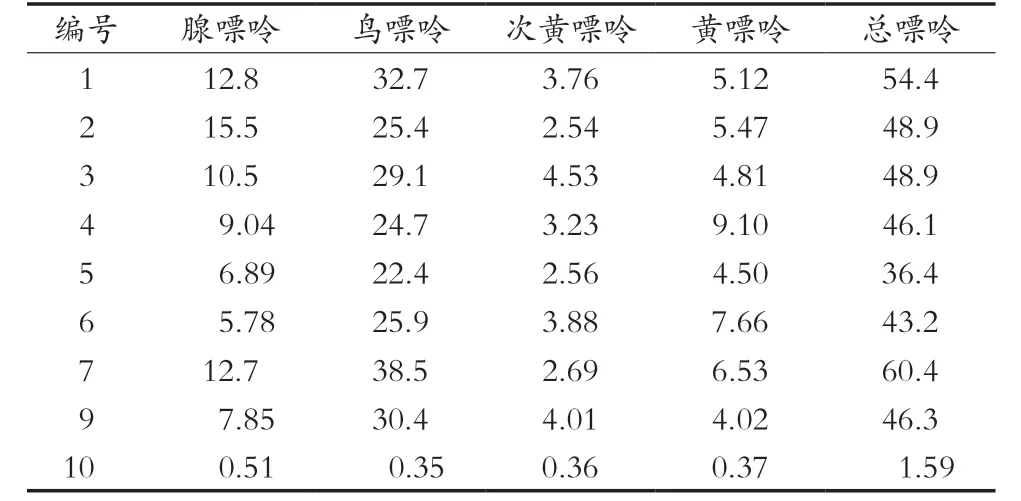
表4 啤酒中嘌呤含量 单位:mg/L
试验同时还测定上述10种啤酒饮料未经水解时游离态嘌呤含量(前处理不加强酸水解,其余同1.3),检测结果见表5。由表5可知,啤酒(1~9号)的总游离态嘌呤含量为8.14~13.5 mg/L,其中黄嘌呤含量最高,占总游离态嘌呤量的51.6%~83.1%。啤酒水解前后,腺嘌呤、鸟嘌呤和次黄嘌呤含量均有不同程度的增加,说明在啤酒中这3种嘌呤主要以结合态存在,而黄嘌呤的含量水解后却略有减少,说明啤酒中黄嘌呤几乎没有结合态,含量降低推测系高温酸水解造成部分损失所致。

表5 啤酒中游离态嘌呤含量 单位:mg/L
3 结论
建立同时测定啤酒中腺嘌呤、鸟嘌呤、次黄嘌呤、黄嘌呤4种嘌呤含量的分析方法。该方法样品前处理简单快速、准确性高、精密度良好,采用UPLCMS/MS分析技术,兼具分析时间短、效率高、选择性强、灵敏度高的优点,结果可靠,实现对啤酒中4种嘌呤组分进行高效准确的分析,适合于实际样品的检测,也为研究测定啤酒中的嘌呤组分及其类似物提供可靠的检测手段和参考依据。

