转Cry1Ia基因抗虫大豆对鳞翅目靶标害虫的抗性分析
单大鹏,王晓云,洪志鹏,王子叶,冯广慧,孟凡立
(东北农业大学农学院,哈尔滨 150030)
大豆因富含蛋白质和油脂等营养成分,在世界范围内被广泛应用于食品加工、动物饲料及工业原料等行业[1]。近年来,随着人们对生活品质和保健等方面意识增强,大豆市场需求逐渐增加。然而,我国自产大豆无法满足生产生活需求,仍需大量进口。提高大豆产量、减少大豆因虫害、病害带来的经济损失已成为世界关注热点。
鳞翅目害虫引起玉米、大豆、油菜、棉花等作物减产,对我国乃至全球农业发展造成巨大损失[2]。苏云金芽胞杆菌(Bacillus thuringiensis,Bt)在生长过程中产生由cry和cyt基因编码的杀虫晶体蛋白(Insecticidal crystal proteins,ICPs)[3],其对鳞翅目、鞘翅目、双翅目、半翅目、直翅目、膜翅目害虫具有特异活性[4]。2010~2012年,巴西和阿根廷先后开始商业化种植Bt大豆。2017年巴西研发一个表达Cry1Ac、Cry1F和膦丝菌素乙酰转移酶(PAT)蛋白的Bt大豆品种DAS814192(ConkestaTM技术),该品种对鳞翅目昆虫具有较高抗性[5]。过表达Cry1A蛋白转基因大豆显著降低鳞翅目昆虫种群密度,尤其是大豆夜蛾、大豆尺蠖夜蛾和长须夜蛾[6]。Bernardi等发现Bt大豆(表达Cry1Ac蛋白的MON 87701×MON 87788)在实验室对鳞翅目昆虫大豆尺蠖夜蛾(夜蛾科)和大豆夜蛾(鳞翅目:直立目)具有抗性[7]。
Ruizde Escudero等研究已表明,Cry1Ia39蛋白对红腹溞幼虫毒性作用不显著,但产生一定体重抑制作用[8]。Quemada等将Cry1Ia基因转入马铃薯中,成功减弱马铃薯麦蛾危害[9]。Silva等将Cry1Ia基因转入棉花,提高转基因棉花对鳞翅目害虫棉铃虫和黏虫抗性,且产生与受体植株同样表型花和种子[10]。Boncheva等在生物测定中发现苹果蠹蛾对Cry1Ia1敏感性[11]。Cry1Ia7、Cry1Ia10、Cry1Ia12和Cry1Ia13对草地贪夜蛾有毒性[12]。因此,开发具有Cry1Ia蛋白转基因植物对控制鳞翅目害虫具有重要应用前景。本研究对转Cry1Ia基因大豆株系KE1分析鳞翅目害虫抗性,为培育抗鳞翅目靶标害虫大豆新品系提供基础性材料。
1 材料与方法
1.1 供试植物材料
转Cry1Ia基因大豆,转基因大豆KE1表达Cry1Ia抗虫蛋白,同时以Bar基因为筛选标记,供试用转基因大豆材料由东北农业大学大豆生物学教育部重点实验室保存。非转基因亲本对照种子垦农18由黑龙江省八一农垦大学朱洪德教授提供。
1.2 供试昆虫
本试验中室内和大田所用昆虫为大豆靶标害虫。黏虫卵、斜纹夜蛾卵、甜菜夜蛾卵从河南省济源白云实业有限公司购买并在实验室孵化为一龄幼虫;大豆食心虫幼虫2019年8月15日采集于东北农业大学。
1.3 转Cry1Ia基因大豆KE1遗传稳定性分析
1.3.1 植物基因组DNA提取
将转基因株系KE1的T3~T5代种子同时在温室中种植,选取长势较好再生植株幼嫩叶片,选用康为世纪生物科技有限公司DNA提取试剂盒提取叶片总DNA,用于PCR检测阳性植株。
1.3.2 利用Primer 5.0设计引物
利用Primer 5.0设计目的基因Cry1Ia引物序列如下,Cry1Ia-F:GGCATCTGTGACTTGTCTAGAA TTCGG,Cry1Ia-R:TCAAGGAGACTTGTACCATC CCCATG,扩增产物长度约为200 bp。利用Primer 5.0设计筛选标记基因Bar引物序列如下,Bar-F:GCGGTACCGGCAGGCTGAAG,Bar-R:CCGCAGG AACCGCAGGAGTG,扩增产物长度约为238 bp。
1.3.3 转Cry1Ia基因大豆KE1的PCR检测
提取大豆叶片总DNA后,分别用Cry1Ia和Bar基因特异引物在Eppendorf PCR仪上扩增。模板为植物基因组总DNA,阳性对照为pCAMBIA3301-Cry1Ia质粒,阴性对照为未转入Cry1Ia基因植株DNA。以ddH2O为空白对照。两个基因扩增反应体系相同。反应体系如下,Cry1Ia基因PCR扩增条件:94℃预变性5 min;35个循环;94℃变性30 min,50℃退火30 s,72℃延伸30 s;72℃终延伸10 min;4℃终止反应。Bar基因PCR扩增条件:94℃预变性5 min;35个循环;94℃变性30 min,58℃退火30 s,72℃延伸30 s;72℃终延伸10 min;4℃终止反应。PCR产物检测:取5μL扩增产物,加1μL 6×loading Buffer混匀,2.0%琼脂糖凝胶电泳检测,紫外分析仪观察并拍照。
1.3.4 转Cry1Ia基因大豆KE1的Western blot检测
从田间选取转基因阳性植物和对照植株新鲜未成熟叶片、花、籽粒和荚皮组织,提取总蛋白。12%SDS-PAGE上分离转基因植株总蛋白(约40μg)。分离后蛋白使用转膜设备转移至聚偏二氟乙烯(PVDF膜)上。然后利用脱脂牛奶对PVDF膜上的非特异性位点作封闭。一抗为鼠抗Cry1Ia蛋白抗血清,稀释浓度为1∶100;另一个为鼠抗Bar-PAT蛋白单克隆抗体,稀释浓度为1∶10 000。二抗为辣根过氧化物酶标记兔抗鼠抗体,稀释浓度随一抗的稀释浓度成倍递增或递减。经蛋白杂交和洗膜后,使用化学发光蛋白质印迹试剂盒中A、B液(1∶1)在膜上直接显色,1 min后利用化学发光成像系统照相。
1.3.5 转Cry1Ia基因大豆KE1的ELISA检测
在大豆生长结荚期,从田间采集转基因阳性植株和对照植株新鲜叶片、花、子粒和荚皮部位组织,用锡纸包裹后立即放入液氮,用研钵将样品充分研磨,离心并适当稀释上清液后,按照厂商说明书作双抗体夹心酶联免疫吸附测定(ELISA法),分析外源蛋白Cry1Ia和Bar在转基因阳性植株不同组织中表达水平。通过绘制标准曲线计算样品中Cry1Ia和Bar蛋白浓度。
1.4 甜菜夜蛾、斜纹夜蛾、黏虫室内抗虫性鉴定
当室内种植转基因材料KE1的T3和T4代以及受体材料垦农18第4个三出复叶完全展开时,取大豆植株顶部展开第3个三出复叶置于培养皿湿滤纸上,叶柄一端用湿棉花包裹,外包封口膜防止叶片失水,每个材料重复测定4次。幼虫培养方式、光照周期等处理参考徐晓丽等[13]。在接虫后3 d利用叶面积仪测定幼虫取食大豆品种叶面积,计算叶面积损失率,同时记录幼虫死亡率和体重。取食3 d时,对转基因材料KE1和受体品种叶面积损失率和抗性作分级,分级标准见表1。

表1 叶片损害鉴定分级标准Table1 Classification criteria for bladedamageidentification
食用转基因品种KE1和垦农18幼虫平均校正死亡率、平均体重抑制百分率计算参考文献[14]。采用方差分析法比较转基因抗虫大豆品种KE1和对应非转基因大豆品种垦农18幼虫平均校正死亡率和平均体重抑制百分率差异。
1.5 大豆食心虫田间抗虫性鉴定
2019年5 月上旬将KE1 T3代和T4代转基因材料和非转基因对照材料垦农18播种于抗虫网室内。大豆食心虫田间抗虫性鉴定方法和单株虫食率计算参考钱雪艳等方法[15]。

表2 大豆食心虫田间抗性鉴定标准Table2 L.glycinivorella Matsumura resistancein thefield evaluation criteria
1.6 数据整理与分析
运用Microsoft Excel 2016和SPSS 22.0统计软件分析试验结果。
2 结果与分析
2.1 转Cry1Ia基因大豆KE1遗传稳定性分析
2.1.1 转Cry1Ia基因大豆KE1的PCR检测
分别利用Cry1Ia和Bar基因引物对转基因株系KE1的T3~T5代植株作PCR检测,在转基因株系KE1的T3~T5代植株中均检测到200 bpCry1Ia目的条带和238 bpBar目的条带(见图1),表明转基因株系KE1中目的基因Cry1Ia和筛选基因Bar在T3~T5代中连续稳定遗传。
2.1.2 转Cry1Ia基因大豆KE1的Western blot检测
为分析转录的Cry1Ia和Bar是否翻译成蛋白质以及在叶片、花、未成熟籽粒和荚皮等不同组织中蛋白质表达是否存在差异,利用武汉上成公司制备的Cry1Ia和Bar蛋白多克隆抗体对T4代开花结荚期根、茎、叶、花和荚皮不同组织中目的基因及标记基因表达蛋白作Western blot杂交分析。Western blot杂交表明,外源蛋白Cry1Ia在转基因大豆中获得表达,Cry1Ia蛋白约为81.05 ku,与预期一致。在KE1的T4代根、茎、叶片和荚皮中均检测到81 ku蛋白条带,与预期Cry1Ia蛋白一致,而受体垦农18未检测到81 ku蛋白条带(见图2),说明整合到垦农18大豆基因组上的Cry1Ia在根、茎、叶片和荚皮中均翻译成蛋白。
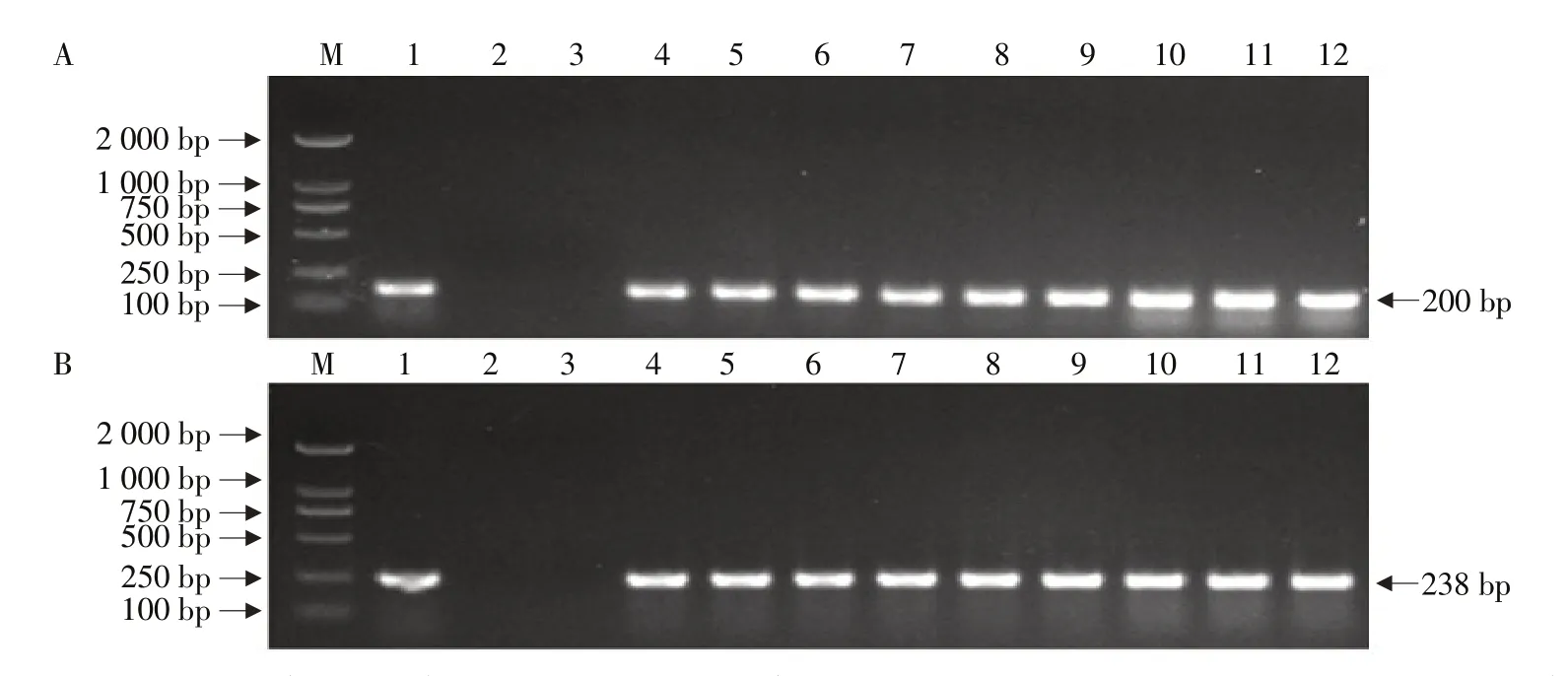
图1 转基因大豆PCR检测Fig.1 PCR detection of genetically modified soybeans
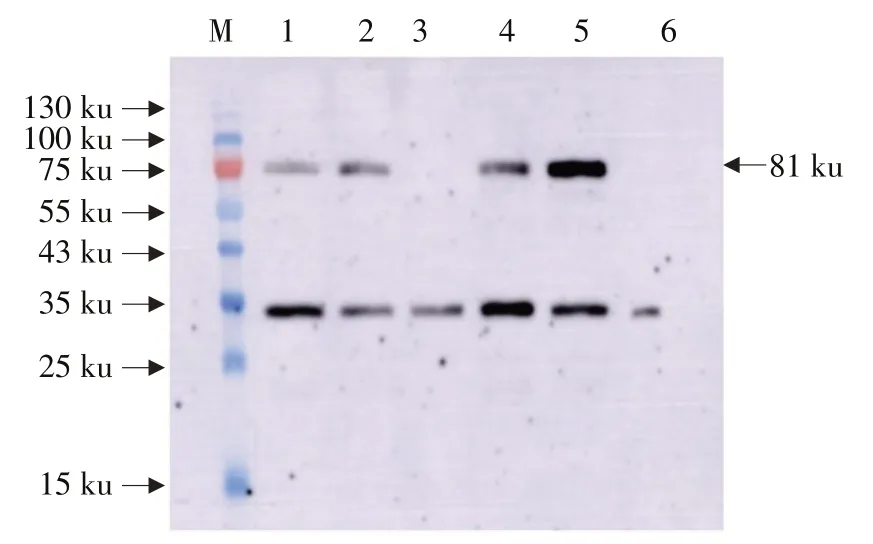
图2 转基因大豆Cry1Ia蛋白Western blot检测Fig.2 Detection of Cry1Ia protein in transgenic soybean by Western blot
Western blot杂交表明,外源蛋白Bar在转基因大豆中获得表达,Bar蛋白约为21 ku,与预期一致。在KE1的T4代根、茎、叶片、花、荚皮中均检测到21 ku蛋白条带,与预期Bar蛋白一致,而受体垦农18未检测到21 ku蛋白条带(见图3),说明整合到垦农18大豆基因组上的Bar在根、茎、叶片、花、荚皮中均翻译成蛋白。
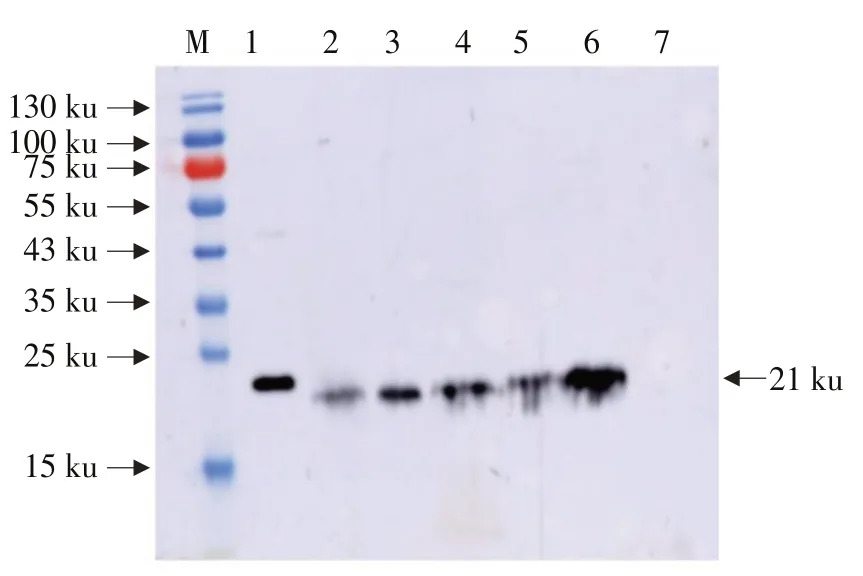
图3 转基因大豆Bar蛋白Western blot检测Fig.3 Detection of Bar protein in transgenic soybean by Western blot
2.1.3 转Cry1Ia基因大豆KE1的ELISA检测
利用ELISA试剂盒对转Cry1Ia基因大豆KE1中Cry1Ia蛋白定量分析,标准曲线为y=0.2416x+0.2437(R2=0.9958)。结果表明,Cry1Ia蛋白在转基因大豆KE1生长不同时期及不同组织部位均表达(见表3)。T3代Cry1Ia蛋白在苗期(V3)根、茎和叶片中表达含量分别为0.105±0.000、1.350±0.001和1.967±0.067μg·g-1。Cry1Ia蛋白在开花结荚期(R2)根、茎、叶片、花和荚皮中分别为0.242±0.008、0.873±0.052和0.632±0.035、0.221±0.040和0.157±0.020μg·g-1。在鼓粒期(R6)根、茎、叶片和籽粒中分别为0.081±0.024、1.240±0.195、2.630±0.089和2.020±0.031μg·g-1。在成熟期(R8)根、茎、叶片和籽粒中分别为0.146±0.024、2.287±0.189、5.308±0.280和6.020±0.634μg·g-1。分析T3和T4连续2代4个时期不同组织中Cry1Ia蛋白含量,结果表明Cry1Ia蛋白在转基因大豆器官样品中均可检测到,不同器官中目的蛋白含量具有一定变化,总体说,大豆籽粒Cry1Ia蛋白含量相对最高,根中含量相对较低。

表3 Cry1Ia蛋白在转基因株系KE1 T 3~T 4代4个时期不同组织表达量分析Table3 Analysis of Cry1Ia protein expression in different tissuesof transgenic line KE1 T 3-T 4 in four periods
利用ELISA分析标记蛋白Bar(PAT)表达水平表明,标准曲线为y=0.1888x+0.033(R2=0.9947)。Bar在转基因大豆KE1生长不同时期及不同组织部位均表达(见表4)。T3代Bar蛋白在苗期(V3)根、茎和叶片中表达含量分别为0.537±0.001、0.698±0.035和0.882±0.045μg·g-1。Bar蛋白在开花结荚期(R2)根、茎、叶片、花和荚皮中分别为2.350±0.021、2.690±0.032、2.970±0.102、1.120±0.078和3.153±0.315μg·g-1。在鼓粒期(R6)根、茎、叶片和籽粒中别为1.450±0.001、2.530±0.002、2.460±0.005和3.470±0.003μg·g-1。在成熟期(R8)根、茎、叶片、花和籽粒中分别为3.450±0.357、4.950±0.561、4.490±0.256、4.050±0.376和4.160±0.236μg·g-1。分析T3和T4连续2代4个时期不同组织中Bar蛋白含量,结果表明Bar蛋白在转基因大豆器官样品中均可检测到,不同器官中目的蛋白含量有一定时空变化。
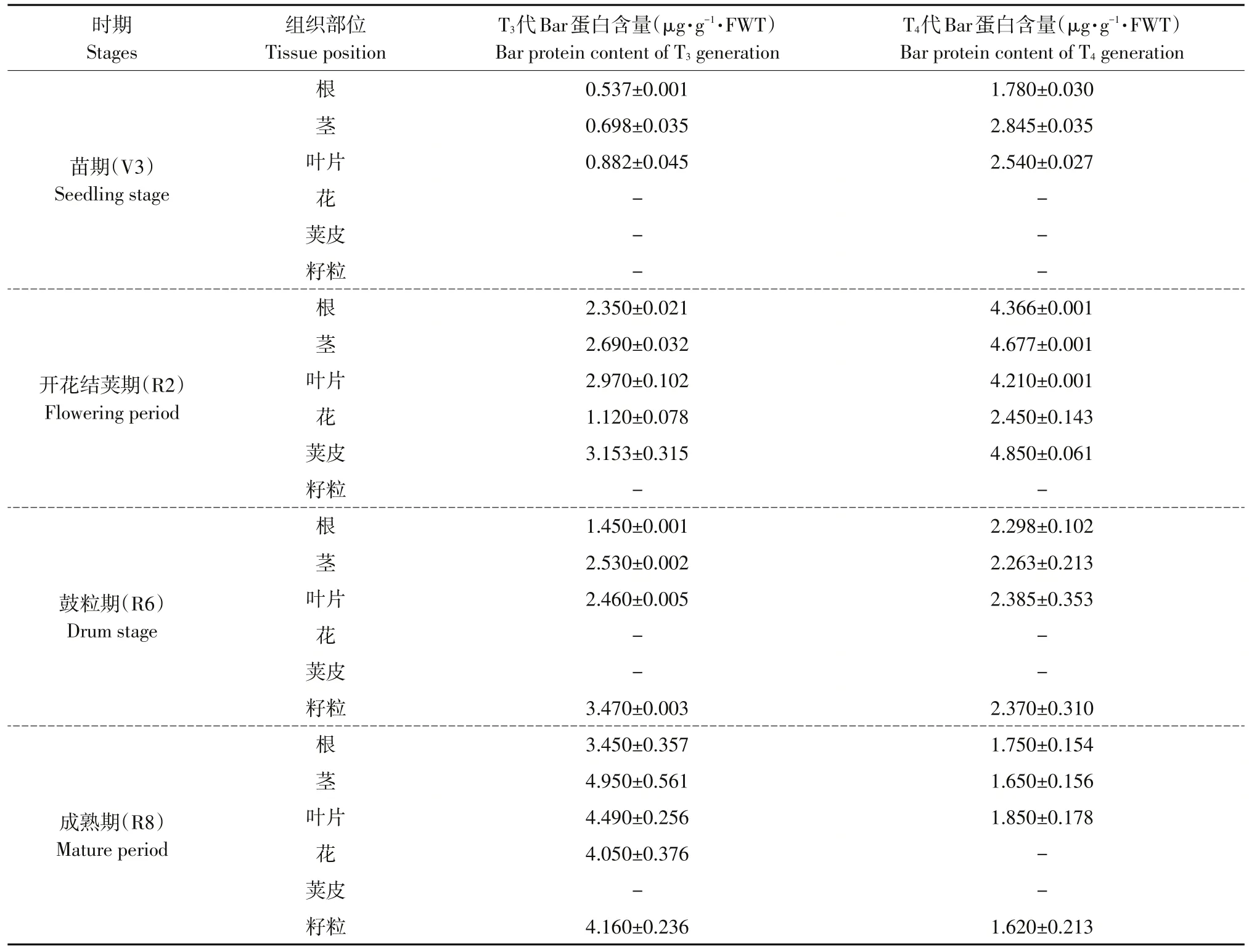
表4 Bar蛋白在转基因株系KE1 T 3~T4代4个时期不同组织表达量分析Table 4 Analysis of Bar protein expression in different tissues of T 3-T 4 generation of transgenic line KE1 in four periods
2.2 甜菜夜蛾抗性分析
本试验利用KE1 T5代阳性植株R1期离体叶片与受体垦农18叶片分别喂食一龄甜菜夜蛾幼虫,作甜菜夜蛾室内生测,鉴定结果表明,甜菜夜蛾一龄幼虫取食KE1叶片3 d后,T5代转基因大豆KE1叶片损失率为9.76%±2.49%,表现为高抗性,而对照叶片损失率为81.29%±12.54%,表现为感性(见图4)。KE1 T5代校正死亡率为85.57%±8.08%。同时KE1 T5代平均体重抑制百分率为26.21%±7.74%。因此,转基因大豆KE1叶片对甜菜夜蛾幼虫抗性显著高于受体垦农18,对甜菜夜蛾幼虫表现较高抗性。
2.3 斜纹夜蛾抗性分析
本试验利用KE1 T5代阳性植株R1期离体叶片与受体垦农18叶片分别喂食一龄斜纹夜蛾幼虫,作斜纹夜蛾室内生测,鉴定结果表明,斜纹夜蛾一龄幼虫取食KE1叶片3 d后,T5代转基因大豆KE1叶片损失率分别为6.11%±4.56%,表现为高抗性,而对照叶片损失率为85.12%±14.08%,表现为感性(见图5)。KE1 T5代校正死亡率为83.78%±12.18%。同时KE1 T5代平均体重抑制百分率为57.15%±19.51%。因此,转基因大豆KE1叶片对斜纹夜蛾幼虫表现较高抗性。
2.4 黏虫抗性分析
本试验室利用KE1 T5代阳性植株R1期离体叶片与受体垦农18叶片分别喂食一龄黏虫,作黏虫室内生测,鉴定结果表明,黏虫幼虫取食KE1叶片3 d后,T5代转基因大豆KE1叶片损失率为6.48%±3.49%,表现高抗性,而对照叶片损失率为74.08%±11.08%,表现为感性(见图6)。KE1 T5代校正死亡率为80.51%±8.99%。同时KE1 T5代平均体重抑制百分率为35.73%±16.27%。因此,转基因大豆KE1叶片对黏虫幼虫表现较高抗性。
2.5 大豆食心虫田间抗性分析
在抗虫网室内种植KE1 T2~T3代阳性植株和受体垦农18,8月初放入大豆食心虫成虫,转基因阳性植株成熟后,分析KE1株系和受体垦农18抗虫性状,鉴定表明,KE1虫食率为0.3%~2.7%,显著低于对照受体品种(21.6%~35.6%)。表明KE1对大豆食心虫抗性表现为高抗,且抗虫水平显著高于受体品种(见表5)。连续两代抗虫性鉴定结果表明,转基因大豆KE1对大豆食心虫田间抗性稳定遗传。
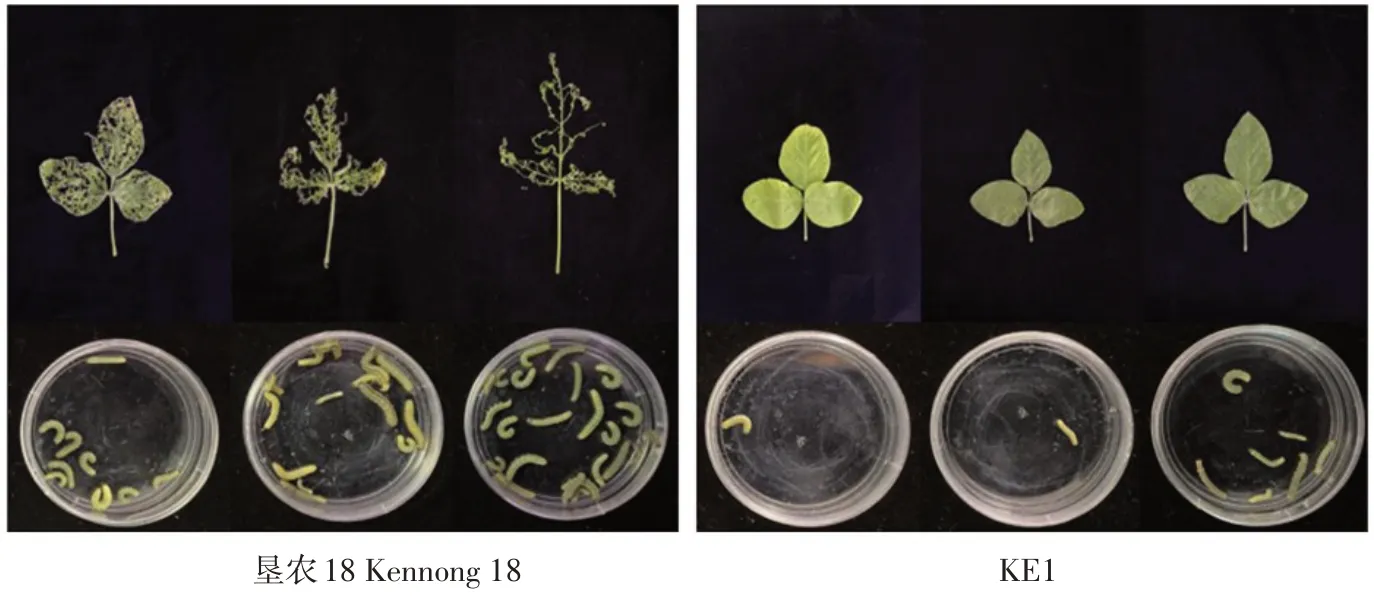
图4 甜菜夜蛾幼虫取食T 5代转基因大豆KE1和垦农18叶片情况Fig.4 Feeding statusof S.exigua larvae on theleaves of T 5 generation of transgenic line KE1 and Kennong 18

图5 斜纹夜蛾幼虫取食T 5代转基因大豆KE1和垦农18叶片情况Fig.5 Feeding status of S.litura larvae on theleaves of T 5 generation of transgenic line KE1 and Kennong 18

图6 黏虫幼虫取食T 5代转基因大豆KE1和垦农18叶片情况Fig.6 Feeding status of Mythimna separata W.larvaeon the leaves of T 5 generation of transgenic line KE1 and Kennong 18
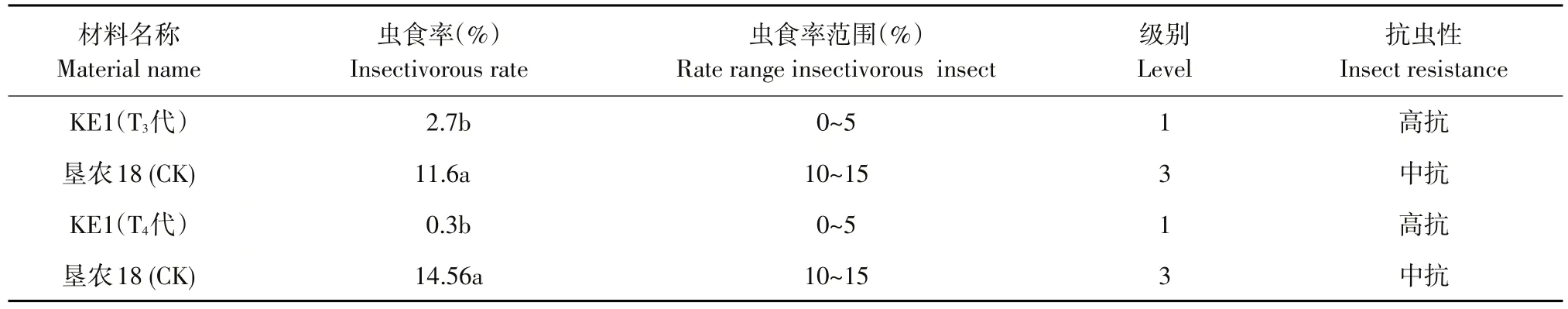
表5 转基因大豆KE1田间大豆食心虫抗性分析Table 5 Analysis of L.glycinivorella Matsumura resistance in the field
3 讨论与结论
随着基因工程技术进步,转基因农作物种类和耕种面积迅速增长,研究转基因农作物安全性至关重要。转基因作物安全性评价主要分为食品安全性和环境安全性两个层次[16]。转基因植物环境安全性评价主要包括对靶标害虫和非靶标害虫的影响,其中对靶标害虫的影响是环境安全评价主要内容。
本研究对转基因大豆KE1作ELISA检测,发现转基因大豆在生长不同时期及不同组织部位均表达,且不同器官中目的蛋白含量存在一定时空变化,与邵宇鹏等研究结果一致[17]。本文选取东北地区常见鳞翅目靶标害虫检测生物活性,分别统计叶面积损失率、平均体重抑制百分率和虫食率等重要参数,试验方法与宋苗等采用方法一致[18]。
本研究所用转Cry1Ia基因大豆KE1株系中目的基因Cry1Ia和标记基因Bar在T3~T5代中连续三代稳定遗传。Cry1Ia基因在叶片、花、未成熟籽粒和荚皮中均翻译成相应蛋白。大豆籽粒Cry1Ia蛋白含量相对最高,根中含量相对较低。选用T5代转基因与对照植株垦农18叶片分析鳞翅目害虫幼虫抗性,证明转基因大豆KE1供试鳞翅目害虫幼虫具有较高抗性。因此,转基因KE1株系显著提高受体大豆垦农18对鳞翅目靶标害虫抗性,可用于培育抗鳞翅目靶标害虫大豆新品系。后续试验可通过对非靶标昆虫的安全性评价,通过生物素标记结合方法以及Ligand blot配给杂交方法,探究靶标昆虫中肠BBMV蛋白是否存在Cry1Ia蛋白特异性受体,为解释转Cry1Ia基因大豆杀虫机制奠定基础。

