马铃薯疮痂病菌分离鉴定与抗病诱导剂对马铃薯疮痂病防治效果研究
张铉哲,陈 梅,赵 雪,任雪琦,徐浩然,陈苏慧
(东北农业大学农学院,哈尔滨 150030)
链霉菌是土壤腐生菌,具有产生生物活性次级代谢物能力,特别是抗生素以及一些细胞外水解酶和其他化合物。仅有少数链霉菌具有植物致病性,引起马铃薯、萝卜、胡萝卜、甜菜和甘薯等多种作物根部病害[1-2]。
马铃薯疮痂病(Potato common scab,PCS)是由多种植物致病性链霉菌引起的一种全球性重要病害。在马铃薯生产中除马铃薯晚疫病外,PCS降低块茎品质,导致薯皮粗糙,影响种薯生产、鲜薯销售和加工[2-3]。Streptomycesscabies、S.acidiscabies和S.turgiscabies被认为是引起马铃薯疮痂病最普遍病原菌[4]。块茎细胞未木栓化幼嫩皮孔易受感染,所以致病链霉菌在马铃薯块茎快速膨大期间易侵入[5]。PCS为土传病害,由于土壤环境复杂性以及土壤颗粒机械保护作用,为该病害防治增加难度。现阶段防治疮痂病最有效管理策略为种植健康无病抗病品种,并结合化学杀菌剂防治。然而,目前无有效防治疮痂病化学杀菌剂。由此可见,马铃薯疮痂病防治成为生产和育种过程中亟待解决问题。
抗病诱导剂可诱发植物自身免疫系统,最终使植物获得抵御病害能力,保护植物免受病原物侵害,也减少化学农药使用[6]。目前有多种抗病诱导剂用于防治马铃薯疮痂病,龚秀会等研究表明,使用诱抗剂BTH抗病诱导剂对马铃薯疮痂病具有较好防治效果,最佳防效达63.59%[7]。目前水杨酸(Salicylic acid,SA)在马铃薯疮痂病防治上报道较多,汤晓莉等研究表明,施用外源SA增强植株对疮痂病系统抗性,显著降低种薯感病率[8]。王宏虬等在结暑期至成熟期定期用SA叶面喷施,结果表明,可有效提高植株对疮痂病抗性[9]。草酸(Oxalic acid,OA)、β-氨基丁酸(β-aminobutyric acid,BABA)和茉莉酸甲酯(Methyl jasmonate,MJ)分别在诱导植株对黄瓜霜霉病[10]、马铃薯晚疫病[11]和辣椒青枯病[12]等病害上应用广泛,但在马铃薯疮痂病防治上未见报道。为选出对马铃薯疮痂病具有良好诱抗效果抗病诱导剂,本研究采用5种抗病诱导剂对马铃薯植株叶面喷雾,诱导马铃薯对疮痂病抗病性,并测定各抗病诱导剂对马铃薯产量影响以及对马铃薯疮痂病防治效果,以期为马铃薯疮痂病防治提供新防治依据。
1 材料与方法
1.1 试验材料
高氏1号培养基:可溶性淀粉20 g,NaCl 0.5 g,K2HPO40.5 g,KNO31.0 g,MgSO4·7H2O 0.5 g,Fe⁃SO4·7H2O 0.01 g,琼脂粉20 g,蒸馏水1 000 mL,pH 7.2~7.4。用于菌株产孢培养物。
ISP2培养基:酵母提取物4 g,麦芽糖提取物10 g,葡萄糖4 g,琼脂粉20 g,蒸馏水1 000 mL,pH 7.2~7.4。用于菌株分离和常规培养。
供试诱抗剂:草酸、水杨酸(SA)、茉莉酸甲酯(MJ)、3-氨基丁酸(BABA)、2,1,3-苯并噻二唑(BTH)(化学纯),均由上海阿拉丁生化科技股份有限公司提供,12%中生菌素可湿性粉剂由福建凯立生物制品有限公司提供。
供试马铃薯品种:大西洋。
1.2 病样采集与菌株分离
病原菌采集与分离:2020年马铃薯收获期间,于黑龙江省哈尔滨市采集患疮痂病薯块。采用稀释分离法分离病原菌。首先用清水冲洗病薯并晾干,无菌刀切取病健交界处置于75%酒精内消毒,无菌水漂洗3次。漂洗完毕后,分别置于无菌研钵中加入少量蒸馏水研磨成匀浆,静置0.5 h使病原菌充分释放至溶液中。4层无菌纱布过滤,并对滤液稀释为10-1、10-2、10-3,分别吸取稀释液30μL涂布于ISP2培养基平板上。涂板之前将均质样品55℃热处理3 min以抑制增长迅速细菌。7 d后,选择白色粉状单菌落,采用划线法纯化3次,将纯化后菌株编号,于4℃冰箱保存备用。
1.3 菌株鉴定
1.3.1 菌株致病性鉴定
参照Loria等方法[13],链霉菌属用马铃薯块茎切片法评价疮痂病感病品种大西洋致病性。块茎用0.5%NaOCl消毒后切成块茎盘(直径1.5 cm,厚度3 mm),置于培养皿中润湿无菌滤纸。在28℃条件下,将菌株在高氏1号培养基上培养7 d。将产孢菌落打成7 mm菌饼,将菌饼含菌一侧紧贴于块茎盘上。每个处理3次重复,接种未接菌琼脂块为空白对照。28℃条件下黑暗培养7 d后,检测所有块茎切片,观察并统计马铃薯切片是否变褐,若变褐则该菌即具有致病性。
1.3.2 致病菌形态观察和生物学特性测定
菌株形态观察:在ISP2培养基上观察菌落形态特征和色素颜色。用盖玻片轻压长满孢子链霉菌菌落,并用光学显微镜观察菌丝及孢子链形态,根据病原菌形态特征,鉴定病原菌。鉴定标准参照《伯杰细菌鉴定手册(第八版)》[14]。
生物学特性测定:菌株碳源、氮源、H2S、纤维素分解、黑色素产生等生物学特性测定参照《伯杰细菌鉴定手册(第八版)》[14]。
1.3.3 致病菌分子鉴定
基因组DNA提取:采用刘炳辉等方法中优化SDS法提取DNA[15]。
序列PCR扩增及同源性分析:链霉菌16SrD⁃NA通用引物序列为:PrimerA:5'CATTCACGGAG AGTTTGATCC 3',PrimerB:5'AGAAAGGAGGTG ATCCAGCC 3'。扩增条件为:94℃预变性3 min,94℃变性30 s,57℃退火30 s,72℃延伸90 s,运行30个循环,最后72℃延伸5 min。PCR产物通过1%琼脂糖凝胶电泳检测,并将PCR产物送至上海生工测序。对所得序列于NCBI作Blast比对,利用MEGA 7.0软件作多序列比对,并构建系统发育进化树。
1.4 抗病诱导剂对马铃薯疮痂病防治效果
1.4.1 抗病诱导剂对病原菌离体作用
将菌株于高氏1号培养基上避光培养7d,用少量无菌水洗下病菌孢子,分装至离心管中5000r·min-1离心10 min,弃去上清液,加入无菌水将孢子浓度调节至108CFU·mL-1,4℃保存备用。
用无菌水将草酸、BABA、BTH、SA和MJ分别配制成5、10、20、50和100μg·mL-15个浓度,以清水处理为空白对照。采用纸碟法,将配置好菌悬液取100μL均匀涂布于琼脂平板上,将圆形滤纸片(d=0.6 cm)分别用上述浓度诱导剂浸湿,置于琼脂平板中央,每个浓度重复3次,28℃条件下暗培养7 d,观察是否形成抑菌圈。
1.4.2 抗病诱导剂田间试验
试验于2019年在东北农业大学校内实验站开展,播种地前茬作物为马铃薯,且马铃薯疮痂病发生严重。试验采用随机区组设计,共设计7个处理,每小区面积为18 m(23 m×6 m),各处理3次重复。采用垄作方法种植,各小区常规除草、中耕和施肥。精选健康无病且均匀一致马铃薯种薯,0.5%NaClO浸泡3 min表面消毒后,无菌水清洗晾干,再用10 mg·L-1赤霉素溶液浸泡30 min,将块茎置于室内保温催芽。出芽后然后将块茎切成含2~3个芽眼薯块,置于室内通风处2 d后播种。
5种抗病诱导剂施用浓度为50μg·mL-1,以杀菌剂12%中生菌素400μg·mL-1为药剂对照,以施用清水为空白对照。田间马铃薯出苗25 d后开始使用药剂,将抗病诱导剂均匀喷施到马铃薯植株叶面上,喷施程度为叶片无液滴滴落为止。中生菌素模拟灌溉处理,每株200 mL,每隔7 d施用1次,共施用4次。最后1次施用药剂间隔7 d后,各小区采用5点取样法,每个采样点选取4株马铃薯,每小区共采集20株。调查测定各处理马铃薯产量,包括大中薯质量(大中薯≥50 g)、小薯质量(<50 g),计算发病率、病情指数和防治效果。
薯块疮痂病分级标准:0级:薯皮健康,无病斑;Ⅰ级:薯皮基本健康,所占面积未超薯皮表面积1/4;Ⅱ级:所占面积为薯皮表面积1/4~1/3;Ⅲ级:所占面积占薯皮面积1/3~1/2;Ⅳ级:严重感病,病斑面积超过薯皮表面积1/2。
发病率(%)=每小区发病种薯粒数/每小区收获种薯粒数×100;
病情指数(%)=∑(各级病薯数×该病级代表值)(/调查总薯块数×最高级值)×100;
相对防治效果(%)=(对照病情指数-处理病情指数)/对照病情指数×100。
1.4.3 数据统计分析
采用DPS7.05软件,应用Duncan氏新复极差法,分析试验数据差异显著性。
2 结果与分析
2.1 马铃薯疮痂病症状及病原菌分离鉴定
2.1.1 马铃薯疮痂病症状
从马铃薯田采集患病薯块症状表现为:马铃薯块茎表皮形成疮痂病斑,发病部位为木栓化褐色病斑,病斑产生裂痕,病斑形状不规则,呈点状或连片分布,使块茎表面变得粗糙且凹凸不平,块茎发病症状如图1A所示。
2.1.2 菌株致病性测定
将测试菌株菌饼接种至小薯片上,7 d后观察测试菌株在小薯片上生长情况,且小薯片表面均产生褐色坏死,对照未产生褐变现象。经测定,14株链霉菌中共获得致病菌株9株,致病菌占比为64.3%,各菌株接种小薯片发病率均为100%,菌株致病症状如图1B、C所示。
2.1.3 菌株分离和形态观察
观察致病菌株形态得出,各致病菌株在ISP2培养基平板上宏观和显微形态相同,均为菌落灰色,表面粗糙,边缘不规则,菌落上方形成褶状隆起,孢子灰色,孢子链直链状(见图2)。
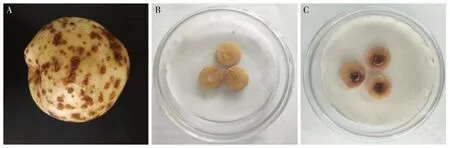
图1 马铃薯疮痂病症状图及链霉菌致病症状Fig.1 Symptom of potato common scab and pathogenicity of isolates of Streptomyces spp.

图2 链霉菌形态观察Fig.2 Morphological observation of Streptomyces
2.1.4 马铃薯疮痂病菌生物学特性测定
挑选代表性菌株HRB-20-9测定生物学特性,结果表明,该菌株以组氨酸、酪氨酸和甲硫氨酸、羟脯氨酸为单一氮源,以甘露醇、蔗糖、葡萄糖、果糖、木糖、鼠李糖、阿拉伯糖、棉子糖、肌醇为单一碳源,对20μg·mL-1链霉素、0.1%苯酚、0.5μg·mL-1结晶紫敏感,对10 IU·mL-1青霉素不敏感,在特定培养基中产生黑色素和H2S,产生淀粉酶使淀粉水解,符合S.scabies生理生化特征(见表1)。
2.1.5 致病菌株分子鉴定
采用16SrDNA引物作PCR扩增测序,在NCBI中作Blast比对,选取与测试菌株相似性较高序列和链霉菌典型菌株,利用MEGA 7.0作序列比对和构建系统发育树,结果表明,HRB-20-9与S.scabies同源性较高(见图3)。结合生物学特性将该菌株鉴定为S.scabies。
2.2 抗病诱导剂对致病链霉菌离体作用
通过纸碟法测定5、10、20、50、100μg·mL-1诱导剂对马铃薯疮痂病菌HRB-20-9离体作用,结果表明,不同浓度抗病诱导剂对致病链霉菌均未出现抑菌圈(见图4),说明抗病诱导剂对病原菌无直接杀灭作用。
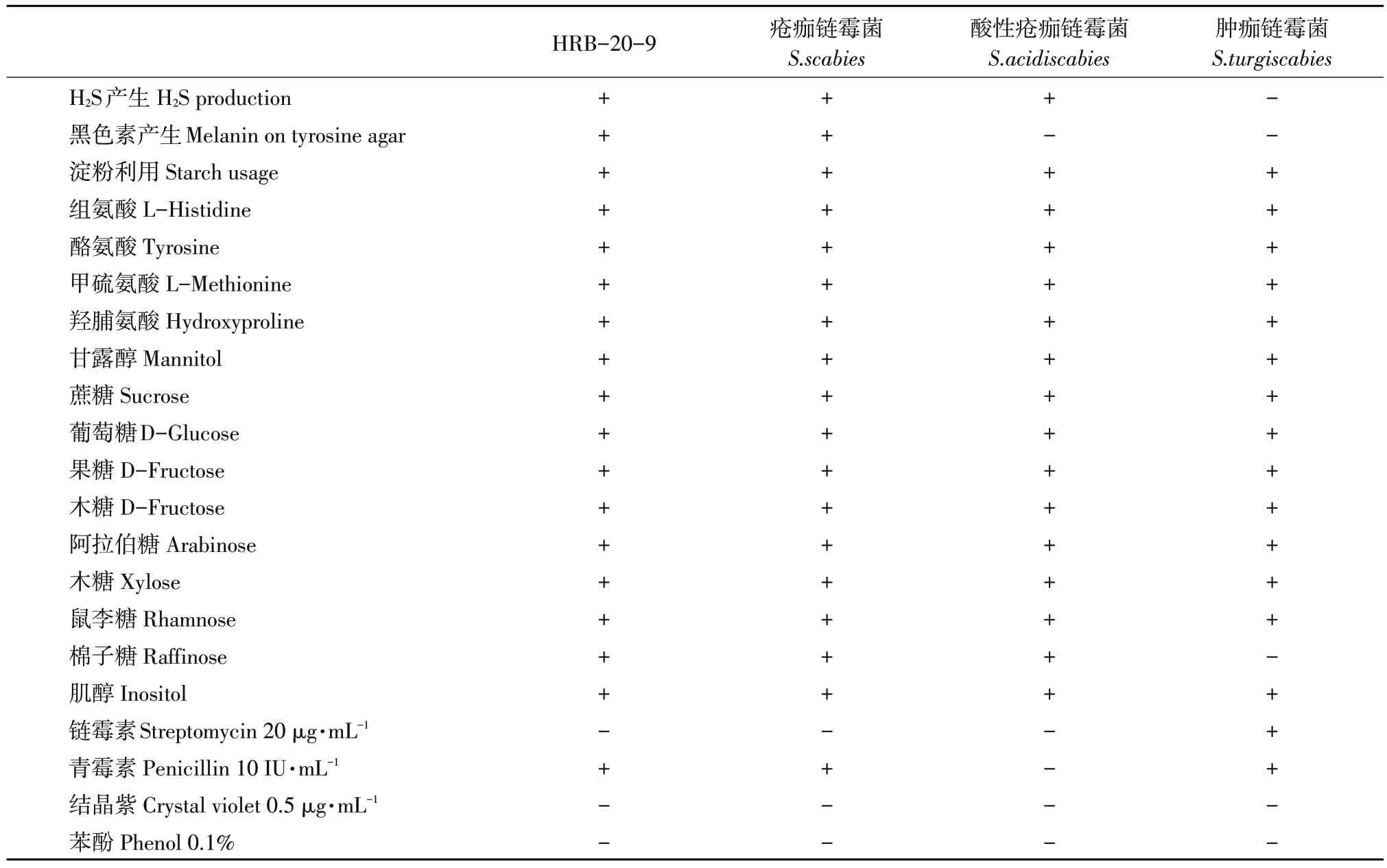
表1 马铃薯疮痂病菌生物学特性Table 1 Characteristics of potato common scab strains

图3 HRB-20-9菌株16Sr DNA序列系统发育树Fig.3 16Sr DNA sequencephylogenetic tree of HRB-20-9 strain
2.3 抗病诱导剂对马铃薯产量的影响
田间对各抗病诱导剂和杀菌剂对马铃薯产量影响结果测定结果表明(见表2),产量为38 220~39 975 kg·hm-2内波动,各处理间无显著差异,说明5种诱导剂均对铃薯产量无影响。
2.4 抗病诱导剂对马铃薯疮痂病防治效果
抗病诱导剂和杀菌剂对马铃薯疮痂病防治效果调查结果表明,各抗病诱导剂及中生菌素对马铃薯疮痂病均有一定防治效果(见表3),可减少疮痂病发病率,其中MJ处理发病率最低,为82.4%,与清水对照相比降低17.6%。与使用杀菌剂中生菌素相比,SA和MJ防治效果菌显著高于中生菌素,其中MJ防治效果最佳,防效达43.6%。其次是SA,防效为38.1%,而草酸和BABA防效相对较差,显著低于中生菌素,防效仅为23.7%和20.6%。
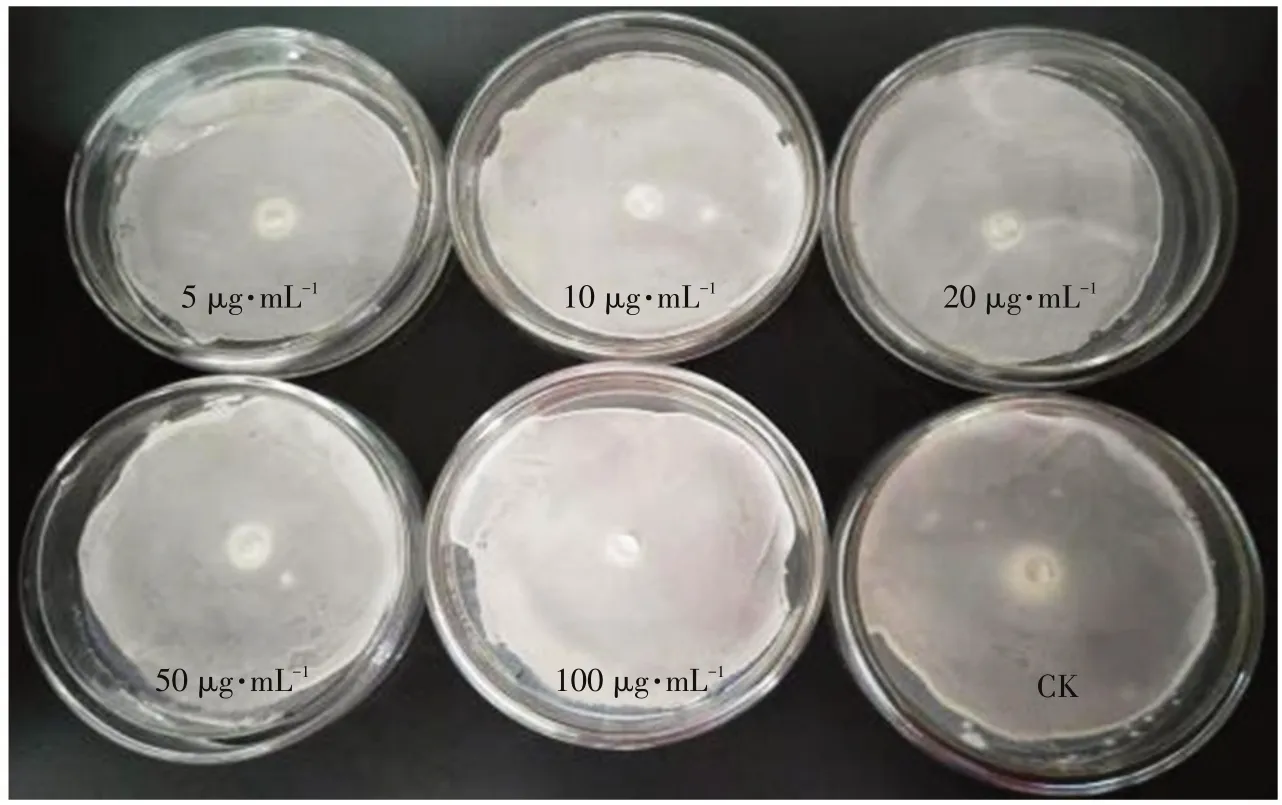
图4 抗病诱导剂对HRB-20-9离体抑制作用Fig.4 Effects of different concentrations of disease resistant inducers on HRB-20-9 in vitro
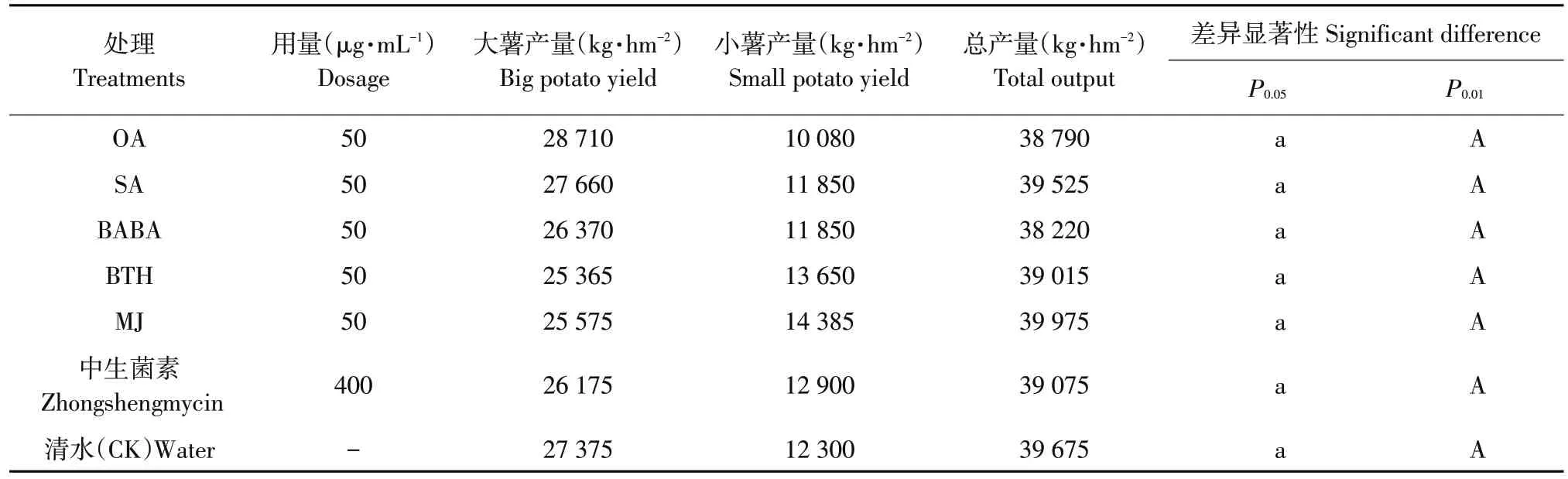
表2 喷施不同诱导剂对马铃薯产量的影响Table 2 Effect of different inducers on potato yield
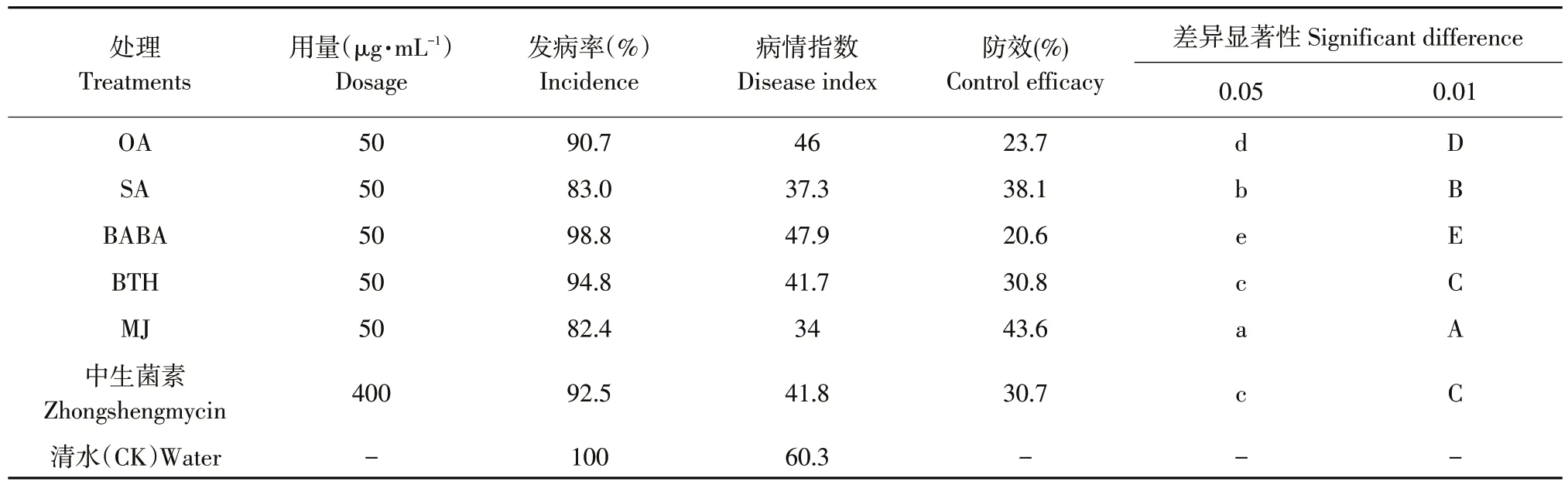
表3 喷施不同抗病诱导剂对马铃薯疮痂病防治效果Table3 Control effect of spraying different diseaseresistanceinducerson potato common scab
3 讨论与结论
马铃薯疮痂病是一种严重土传病害,致病菌由多种链霉菌组成,且不同地区致病菌分布存在差异。目前甘肃报道的病原菌有疮痂链霉菌(S.scabies)、灰色链霉菌(S.griseus)、鲍比氏链霉菌(S.bobili)和加利利链霉菌(S.galilaeus)[16-17],河北地区致病菌有疮痂链霉菌(S.scabies)、欧洲疮痂链霉菌(S.europaeiscabiei)和淀粉酶产色链霉菌(S.diastatochromogenes)[18],黑龙江哈尔滨市目前报道病原菌种有酸性疮痂链霉菌(S.acidiscabies)和肿痂链霉菌(S.turgidiscabies)[19]。但未见S.scabies菌株报道。本研究从哈尔滨市采集具有典型疮痂病症状马铃薯病斑上分离得到14株链霉菌,通过小薯片法测定发现9株(64.3%)具有致病性。根据16S rDNA序列构建系统发育树并结合形态学观察、生物学特性测定将致病菌株鉴定为S.scabies,说明哈尔滨地区马铃薯疮痂病致病菌有S.scabies。
采用纸碟法分别检测草酸、SA、BABA、BTH、MJ对致病链霉菌生长影响。离体条件下不同浓度抗病诱导剂对病原菌未形成抑菌圈,说明诱抗剂对马铃薯致病链霉菌无毒杀作用,对马铃薯疮痂病产生防治效果是其诱导马铃薯植株产生抗病性结果。田间试验中,使用5种抗病诱导剂对马铃薯植株叶面喷施,研究表明不同诱导剂处理对马铃薯产量无显著影响,疮痂病菌仅侵染马铃薯表皮层,并未造成马铃薯产量下降,也有研究表明,在疮痂病发病严重时,引起马铃薯产量降低[20]。诱导剂使用均降低马铃薯疮痂病发病率,并取得一定防治效果,其中MJ防治效果最佳,发病率与清水对照相比降低17.6%,防效高于中生菌素对照药剂,达43.6%。说明抗病诱导剂诱导马铃薯植株对疮痂病抗性,从而产生抵抗病原菌能力,降低发病率,提高马铃薯品质。目前,OA、MJ和BABA在马铃薯疮痂病防治研究中未见报道。已有报道用于防治马铃薯疮痂病抗病诱导剂有SA和BTH。杨鑫等使用不同抗病诱导剂对马铃薯液面喷雾,结果表明不同诱导剂均降低疮痂病发病率,其中SA防治效果达到43.98%[21]。汤晓莉等研究表明使用外源SA防治马铃薯疮痂病,使马铃薯植株矮化,增强植株抗性,有效降低种薯感病率[8]。施用不同浓度诱抗剂BTH处理马铃薯植株,降低马铃薯疮痂病发病率和病情指数,浓度为1.00 mmol·L-1时,对疮痂病相对防效高达63.59%[7]。而本研究中BTH防效较低,因此推断其可能是由于使用剂量较低导致,其他使用剂量有待进一步测定。王宏虬等开展马铃薯疮痂病最适诱导剂筛选试验,最适抗病诱导剂为SA,其防效显著高于BTH,这一趋势与本研究结果一致[9]。
抗病诱导剂诱导植物自身对外来病原物产生免疫反应,这类物质在较低浓度下即被植物识别,诱导植物产生抗性,从而抵御外来病原物侵染[22]。使用抗病诱导剂防治植物病害具有使用方便、有效、安全,对环境无副作用等特点[23]。因此抗病诱导剂可作为一种植物生长调节剂和诱抗剂应用于农业生产,有利于农作物生长发育,降低植物病害发生率,减少化学农药使用量,提升农产品产量和品质。本研究所选用5种抗病诱导剂中,MJ喷施马铃薯叶片防治效果最佳,可作为马铃薯疮痂病最适诱抗剂,但本研究仅使用一个浓度,MJ使用最佳浓度还有待进一步研究。目前抗病诱导剂在马铃薯疮痂病防治上的应用较少,在后续研究中可将诱导剂与化学杀菌剂混合使用,并结合使用抗性品种,以期为马铃薯疮痂病防治提供更有效防治措施。

