新型calix[4]biscrown超分子识别材料制备及其吸附铷和铯性能研究
侯林怡,王一宁,张安运,苏佳天
(浙江大学化学工程与生物工程学院,浙江杭州310027)
引 言
柴达木盆地是青海省乃至我国最主要的盐湖矿产富集区,富含碱金属及碱土金属等重要资源[1-5]。据测算,含有的各种无机盐储量高达3780亿吨,潜在经济价值不低于17万亿元。虽然有部分提取分离技术尚未有效解决[6-9],但已取得了许多重要研究成果。例如,建立的察尔汗盐湖提钾工艺流程已成为我国盐湖资源中钾工业发端的标志[10-11],以卤水镁资源为源头,研制的各种镁产品形成了镁产业链[12-15],锂和硼提取分离研究也取得了重要进展[16-17]。
稀有金属铷和铯是重要战略资源,广泛应用于材料、催化、冶金、汽车、核能和航天等领域[18-22],在5G、卫星和量子技术领域亦发挥着重要作用。经估算察尔汗盐湖水中铷和铯氧化物储量达62.55万吨和6.7万吨之多。与含有d或f电子的过渡元素相比,铷和铯与传统有机配体难以通过配位键形成稳定配合物[23],该结构特点使得盐湖卤水中铷铯分离极具挑战性。目前,研究较多的有溶剂萃取法和吸附法等[24-25],但尚未取得突破性进展。
calix[4]crown是第三代超分子主体,其上缘和下缘分别为亲水性冠醚环或烷氧基,中间的杯[4]芳烃与上下缘之间以聚醚链酚氧基键合,形成的空腔为连接官能团的分子骨架,它能够通过p-基酚腔与酚氧原子或有机分子以CH-p或p-p-堆积相互作用[26-28],该特性使得calix[4]crown能够通过主-客体分子识别选择性与某些碱金属离子形成稳定配合物[29-31],这为Cs和Rb有效分离提供了理论依据。Riddle等[32-33]基于BOBCalixC6提出了从酸性介质中萃取分离铯和锶的FPEX流程,Walker等[34-35]亦基于BOBCalixC6提出了萃取分离铯的CSSX流程,Dozol等[36-39]则通过单冠calix[4]crown6衍生物提出了萃取分离Cs的CCCEX流程,Cs萃取率均超过90%,同族元素Rb因与Cs相似的化学性质同时被萃取。其主要不足是calix[4]crown6衍生物在碳氢稀释剂中溶解度很低,必须使用硝基苯、四丙基氢和硝基苯基辛基醚等一些特殊强毒性稀释剂,即便如此,其饱和浓度也仅有0.001~0.1 mol/L,同时为抑制乳化现象和第三相,还必须加入大量添加剂如Cs-7SB、Cs-3和Cs-4等,对流程安全性造成隐患。为此氯仿或辛醇中单双冠calix[4]crown衍生物对碱金属、碱土金属萃取研究引起了关注[40-43],Cs和Rb萃取率分别达99.5%和98.0%以上。与溶剂萃取相比,萃取色谱技术兼有溶剂萃取的高选择性及柱分离的简洁、高效和多级等特点。基于此Zhang等[44-45]依据固相calix[4]crown6材料,分别提出了有效分离Cs的SPEC及GPSC技术流程,Cs吸附率超过99%,解吸率大于98%,Rb因与Cs相似的化学性质被同时吸附分离,这为高效分离Cs和Rb提供了依据[46-51]。目前固相calix[4]crown5和calix[4]crown6超分子识别材料对Cs、Rb吸附分离研究仅限于酸性介质,对于多组分碱性盐湖卤水体系中Cs、Rb的吸附分离研究尚未见报道。
为考察新型超分子识别材料在盐湖卤水体系中吸附分离Cs和Rb技术可行性,本文合成与表征了双冠calix[4]biscrown衍生物杯[4]双冠-6(BC6)和杯[4]双冠-5(BC5),以XAD-7为载体,基于固定化与真空活化灌注技术制备了新型超分子识别材料BC6/XAD-7和BC5/XAD-7,在确定其组成与结构基础上,考察了BC6/XAD-7和BC5/XAD-7对Cs、Rb及典型共存金属离子吸附行为,研究了水相pH、接触时间和温度等因素变化对吸附性能的影响,明确了超分子识别材料吸附分离Cs、Rb技术可行性,为应用新型超分子识别材料从提取钾后的余液中吸附分离稀有元素Cs、Rb提供理论与实验依据。
1 实验材料和方法
1.1 试剂与溶液
甲醛(36%)、二苯醚、氢氧化钠、无水三氯化铝、甲苯、苯酚、四氢呋喃(THF)、二对甲苯磺酰氯(TsCl)、五甘醇(TECH)、碳酸钾、碳酸铯、乙腈、乙酸乙酯、二氯甲烷、无水硫酸镁、五氧化二磷、分子筛(4A型)、甲醇、硝酸锂、硝酸钠、碳酸钾、硝酸铷、硝酸铯、硝酸钙和硝酸镁,均为分析纯,国药集团;4-叔丁基苯酚(98%)和四甘醇,阿拉丁;石油醚,邦易化工有限公司;XAD-7,SIGMA公司;金属离子标准溶液(1000 mg/L),国家有色金属及电子材料分析测试中心。
1.2 测试仪器
C、H含量采用元素分析仪(Vario Micro,德国Elenemtar)测定;分子量以单极四极杆质谱仪(MSIMS,CMS-L Expression,美国Advion)分析;形态形貌通过冷场发射扫描电子显微镜(SEM,SU8010,日本HITACHI)扫描;结构采用变温X射线衍射仪(XRD,Empyrean 200895,荷兰PANalytical B.V)记录;结构参数采用比表面积和介孔测定仪(TriStarⅡ,美国Micromeritics)测定;在傅里叶红外光谱仪(FT-IR,Vector22,德国BRUKER)上记录红外光谱;金属离子浓度采用电感耦合等离子体发射光谱仪(700-ES ICP-OES,美国Varian)和原子吸收分光光度计(AA 240 FS,美国Varian)分析测试。
1.3 BC6和BC5制备
通过成环低聚、叔丁基消去、五甘醇酯化和上下缘环化等多步反应路线合成了calix[4]biscrown衍生物BC6和BC5[51],其合成技术路线见图1。NaOH对丁基苯酚的低聚反应有催化作用,及时除去水分和控制其用量是缩聚反应成功的重要因素。叔丁基-杯[4]芳烃脱去叔丁基生成杯[4]芳烃衍生物,无水三氯化铝用量控制及保持其催化活性是关键。四(五)甘醇二对甲苯磺酸酯的制备中,需要严格控温低于-5℃。碳酸铯为弱碱性催化剂,通过上、下缘环化反应生成BC6和BC5时,预先除去水分。实验中,采用分离与纯化乙腈溶剂、四(五)甘醇二对甲苯磺酸酯和杯[4]芳烃在60℃时真空干燥4~6 h,碳酸铯在200℃条件下干燥5~7 h。

图1 BC6和BC5合成技术路线Fig.1 Synthetic technical route of BC6 and BC5
合成所得BC6产物4.41 g,产率53.13%,元素分析理论值:C 69.38%,H 7.52%;实验值:C 69.12%,H 7.23%。ESI-MS分析:[BC6+Na]+=852.4;[BC6+K]+=868.0;[BC6+MeCN]=869.7。1H NMR(500 MHz,CDCl3,TMS),δ=7.092~7.111,d,ArH meta,8H;δ=6.852~6.889,t,ArH para,4H;δ=3.819,s,ArCH2Ar,8H;δ=3.709,s,OCH2,8H;δ=3.642~3.664,t,OCH2,8H,δ=3.583~3.614,t,OCH2,8H;δ=3.480~3.501,t,OCH2,8H;δ=3.313~3.343,t,OCH2,8H;化学位移和特征氢原子比例指认结果均与如图2(a)所示结构信息相符,说明所得产物是目标化合物BC6。
合成所得BC5产物2.58 g,产率49.81%,元素分析理论值:C 71.14%,H 7.33%;实验值:C 69.95%,H 6.99%。ESI-MS分析:[BC5+Na]+=763.4。1H NMR分析(400 MHz,CDCl3,TMS),δ=7.089~7.107,d,ArH meta,8H;δ=6.879~6.916,t,ArH para,4H;δ=3.878,s,ArCH2Ar,8H;δ=3.553~3.574,s,OCH2,16H;δ=3.417~3.450,t,OCH2,8H,δ=3.080~3.113,t,OCH2,8H;化学位移和特征氢原子比例指认结果均与如图2(b)所示结构信息相符,说明所得产物是目标化合物BC5。
图2 calix[4]biscrown衍生物的分子结构Fig.2 Molecular structure of calix[4]biscrown derivative
1.4 超分子识别材料制备
将一定量的大孔载体XAD-7置于250 ml锥形瓶中,分别以一定量的甲醇及丙酮在控制温度下进行真空活化处理,该过程重复2~3次。分别将一定量的BC6或BC5置于250 ml圆底烧瓶中,以二氯甲烷溶解,加入一定量的载体材料XAD-7,室温条件下搅拌90~120 min。转移至水浴加热器中于一定温度下旋转搅拌120 min,蒸发至近干,形成均匀泥状。于真空干燥箱中在控制温度下分散、干燥,得颗粒均匀的高分子基超分子识别材料BC6/XAD-7和BC5/XAD-7。
1.5 吸附实验
将一定量超分子识别材料置于50 ml锥形瓶中,与 一 定 量 含 有Li(Ⅰ)、Na(Ⅰ)、Rb(Ⅰ)、Cs(Ⅰ)、Mg(Ⅱ)和Ca(Ⅱ)六种金属离子的溶液混合后,在MM-10型恒温水浴振荡仪中进行振荡。经过一定接触时间,达到吸附平衡后,静置,过滤,分离。水相pH变化范围为3~9,由缓冲溶液维持其不变,实验中的相比为50 mg/ml。以AA 240 FS型原子吸收光谱仪分析测试吸附前后碱金属离子浓度,以700-ES型ICP-OES分析测试吸附前后其他金属离子浓度,以吸附分配系数(Kd,cm3/g)评价BC6/XAD-7或BC5/XAD-7对金属离子的吸附能力,计算公式如式(1)所示:
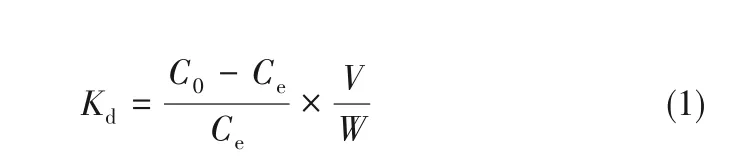
式中,C0为吸附前水相中金属离子的初始浓度,mmol/L;Ce为吸附达到平衡后水相中金属离子的浓度,mmol/L;V为水相体积,cm3;W为吸附材料的质量,g。
2 实验结果与讨论
2.1 组成与结构表征
2.1.1 SEM 在环境温度下calix[4]crown衍生物BC6和BC5、被活化载体XAD-7及其超分子识别材料BC6/XAD-7和BC5/XAD-7的SEM示于图3。结果表明:BC6和BC5表面光滑,呈现规则的晶体形态。载体XAD-7表面粗糙,具有丰富、清晰的孔道。高分子基识别材料BC6/XAD-7和BC5/XAD-7内部和外部结构均充满了大量孔洞,其多孔结构为金属离子的扩散和吸附提供了巨大空间。超分子衍生物和载体XAD-7复合前后,其形态、形貌差异明显,说明BC6或BC5成功浸入并固定化在XAD-7的孔道中,形成了复合多孔功能吸附材料。

图3 BC6、BC5、XAD-7、BC6/XAD-7和BC5/XAD-7的SEM图Fig.3 SEM images of BC6,BC5,XAD-7,BC6/XAD-7 and BC5/XAD-7
2.1.2 结构表征 室温及衍射角2θ变化范围5°~50°条件下,记录了BC6、BC5、载体XAD-7及其超分子识别材料BC6/XAD-7和BC5/XAD-7的X射线粉末衍射峰,其XRD谱图示于图4。由图4可知,BC6和BC5均具有高强度的尖锐晶体峰,说明其具有优异的结晶度。XAD-7结晶度较差,除了在30°和45°附近分别出现两个较小强度的晶体峰外,没有出现其他衍射峰,说明XAD-7是无定形载体。复合材料BC6/XAD-7和BC5/XAD-7的衍射峰均表现为无定形峰形,与XAD-7基本相同,没有出现BC6和BC5的晶体峰。这可能是在吸附材料制备过程中,振荡、溶解、加热蒸发和真空加热干燥等物理操作过程,导致BC6和BC5结晶形态被破坏。同时也说明,超分子吸附材料的制备过程中,BC6、BC5和XAD-7之间没有发生化学反应,其复合过程为基于分子间相互作用力的物理作用。
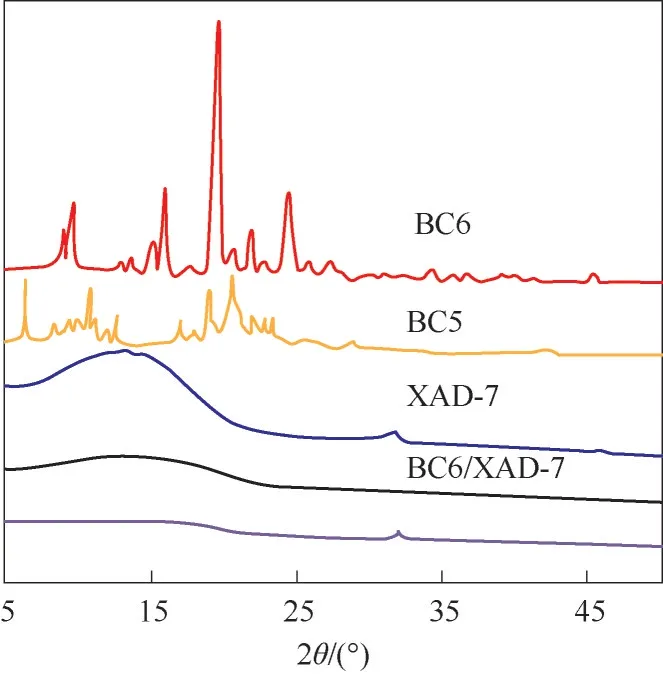
图4 BC6、BC5、XAD-7、BC6/XAD-7和BC5/XAD-7的XRD谱图Fig.4 XRDpatterns of BC6,BC5,XAD-7,BC6/XAD-7 and BC5/XAD-7
图5(a)是BC6/XAD-7和BC5/XAD-7的N2吸附-脱附等温线。结果表明:在高压侧(P/P0>0.9)范围内,随着相对压力的增加,N2的吸附能力随之提高,其形态属于Ⅳ型等温线。经Brunauer-Emmett-Teller方程计算,其总孔体积、比表面积和孔径分布等参数示于表1。
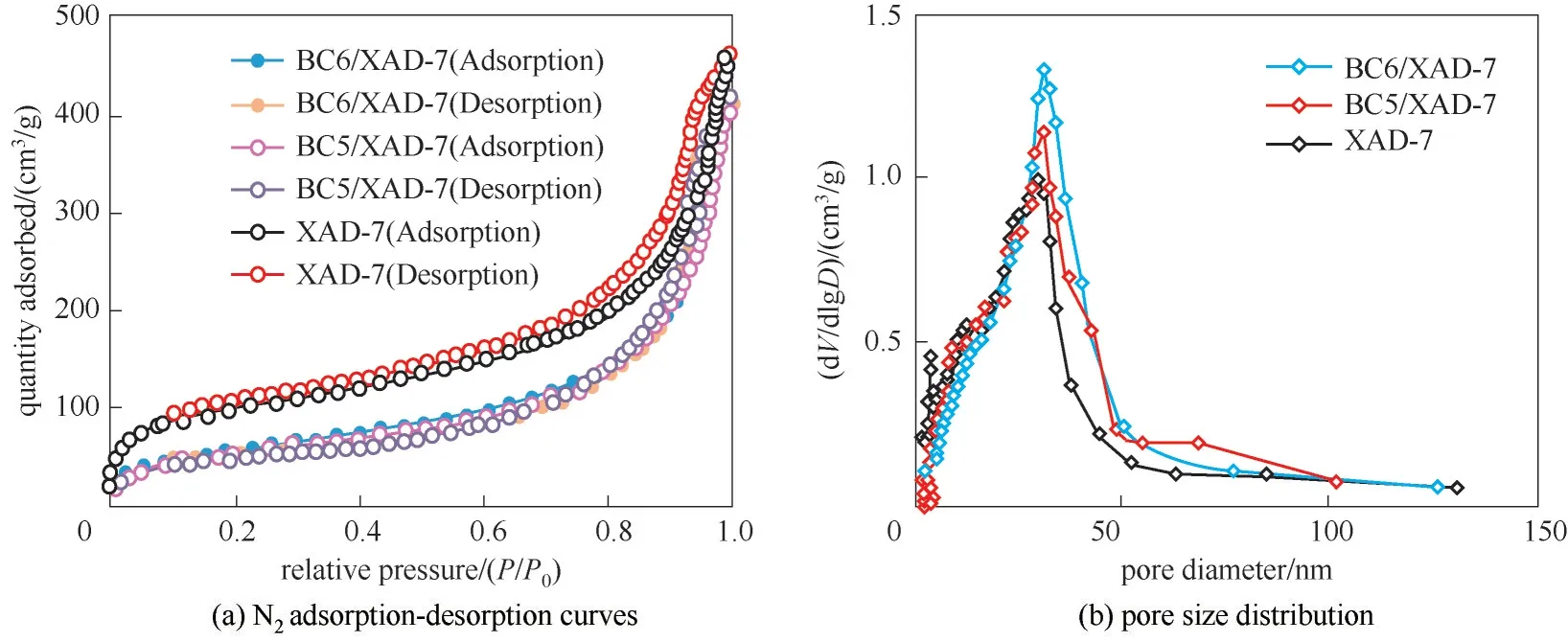
图5 BC6/XAD-7、BC5/XAD-7和XAD-7于77 K条件下的N2吸附-脱附曲线和孔径分布Fig.5 N2 adsorption-desorption curves and pore size distribution of BC6/XAD-7,BC5/XAD-7 and XAD-7 at 77 K
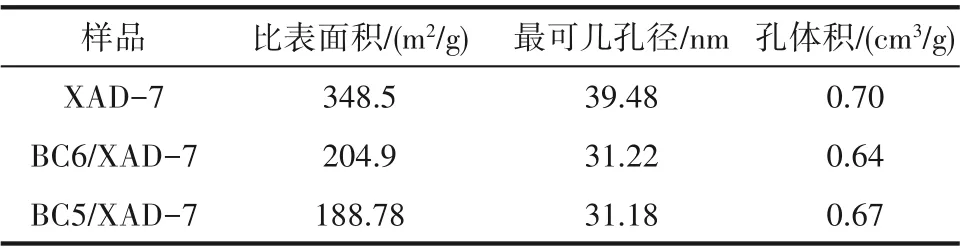
表1 XAD-7、BC6/XAD-7和BC5/XAD-7的比表面积、孔径及孔体积Table 1 Specific surface area,pore size and pore volume of XAD-7,BC6/XAD-7 and BC5/XAD-7
结果表明:在吸附N2前后,XAD-7载体的比表面积有一定程度的降低,最可几孔径和孔体积亦略有减小,这说明2种双冠calix[4]crown衍生物BC6和BC5确实复合进了XAD-7的孔道和结构中,形成了固体复合材料,这为通过主-客体分子识别吸附Cs和Rb提供了条件。
为进一步明确复合材料制备机理,以KBr压片法于4000~400 cm-1范围内,研究了BC6及其高分子基识别材料BC6/XAD-7的FT-IR光谱,其结果示于图6。图6表明,BC6在3677 cm-1处的吸收峰可指认为—OH的振动吸收峰,2966 cm-1指认为饱和C—H基团的伸缩振动吸收峰,1513 cm-1指认为—CH3的C—H弯曲振动吸收峰,1461 cm-1和1389 cm-1可分别指认为C O和C—O—C的伸缩振动吸收峰,1256 cm-1和979 cm-1指认为芳香族不饱和C—H振动吸收峰,XAD-7和BC6/XAD-7官能团特征吸收峰基本相似,但与BC6差异明显。说明二者复合之后,BC6分子结构中各种官能团的吸收峰基本消失,XAD-7仍保留了原有结构,这与XRD谱图指认结果一致,可能是大部分BC6吸收峰被XAD-7覆盖所致。同时,BC6/XAD-7的FT-IR谱图中没有发现新的吸收峰,进一步说明该复合机理是物理过程,没有新化学键的形成。
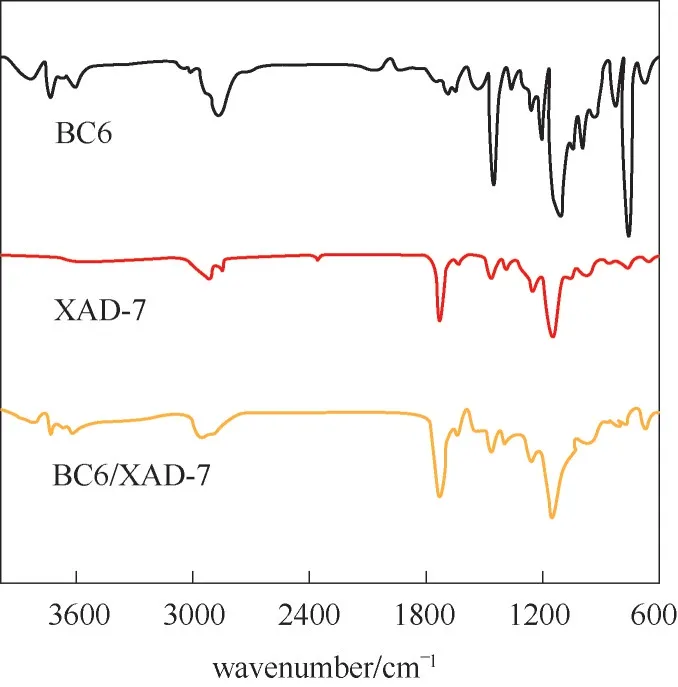
图6 BC6、XAD-7和BC6/XAD-7的FT-IR谱图Fig.6 FT-IR spectra of BC6,XAD-7 and BC6/XAD-7
2.2 吸附性能研究
2.2.1 接触时间对吸附性能的影响 在温度298 K、固液比50 mg/ml及pH 9.02条件下,研究了接触时间变化对BC6/XAD-7和BC5/XAD-7吸附Cs(Ⅰ)、Rb(Ⅰ)及典型金属离子性能的影响,其结果如图7所示。随着接触时间的增加,BC6/XAD-7对Cs(Ⅰ)和Rb(Ⅰ)的吸附能力明显提高,10 min后达到吸附平衡,说明BC6/XAD-7对Cs(Ⅰ)和Rb(Ⅰ)具有优异的吸附动力学,其余4种共存元素Li(Ⅰ)、Na(Ⅰ)、Ca(Ⅱ)和Mg(Ⅱ)的吸附分配系数Kd相对较小,BC6/XAD-7对其表现为弱吸附或不吸附,Cs(Ⅰ)对Li(Ⅰ)、Na(Ⅰ)、Ca(Ⅱ)和Mg(Ⅱ)的吸附分离系数分别为1199、138.9、1128和706,Rb(Ⅰ)对Li(Ⅰ)、Na(Ⅰ)、Ca(Ⅱ)和Mg(Ⅱ)的吸附分离系数分别为290.2、336.4、273.2和170.9,这为从提取K(Ⅰ)后的溶液中同时吸附分离Cs(Ⅰ)和Rb(Ⅰ)提供了实验依据。BC5/XAD-7对Cs(Ⅰ)和Rb(Ⅰ)的吸附能力亦随着接触时间的增加而提高,约30 min后达到吸附平衡,亦说明BC5/XAD-7吸附Cs(Ⅰ)和Rb(Ⅰ)动力学性能较好。与BC6/XAD-7不同的是,BC5/XAD-7对Rb(Ⅰ)具有更为出色的吸附性能,同时对其他金属离子吸附较弱或者不吸附。经计算,在此实验条件下Rb(Ⅰ)对Li(Ⅰ)、Na(Ⅰ)、Ca(Ⅱ)和Mg(Ⅱ)的吸附分离系数分别为326.7、4952、7123和4960,Cs(Ⅰ)对Li(Ⅰ)、Na(Ⅰ)、Ca(Ⅱ)和Mg(Ⅱ)的吸附分离系数分别为26.76、405.5、583.4和406.2,这说明超分子识别可有效吸附分离Cs(Ⅰ)和Rb(Ⅰ),为其技术可行性提供了依据。

图7 接触时间对超分子识别材料吸附性能的影响Fig.7 The influence of contact time on the adsorption performance of supramolecular recognition materials
2.2.2 pH对吸附性能的影响 在298 K温度条件下,在水相pH3~9范围内,研究了pH变化对BC6/XAD-7和BC5/XAD-7吸附Cs(Ⅰ)、Rb(Ⅰ)及其他金属离子性能的影响,其结果见图8。为保证吸附过程充分达到平衡,维持接触时间为60 min。结果表明,pH变化对BC6/XAD-7和BC5/XAD-7吸附性能有显著影响。其中,BC6/XAD-7在所实验pH范围内对Cs(Ⅰ)和Rb(Ⅰ)有明显吸附,至pH 9.02时,吸附分配系数Kd最大,对其他金属离子则表现为弱吸附,Li(Ⅰ)、Na(Ⅰ)、Mg(Ⅱ)和Ca(Ⅱ)的Kd值均低于0.3 cm3/g。众所周知,盐湖卤水为偏碱性水溶液体系,这为BC6/XAD-7于碱性溶液中吸附分离Cs(Ⅰ)和Rb(Ⅰ)提供了依据,经计算,Cs(Ⅰ)对Li(Ⅰ)、Na(Ⅰ)、Ca(Ⅱ)和Mg(Ⅱ)的吸附分离系数为7258、3567、1986和527.1,Rb(Ⅰ)对Li(Ⅰ)、Na(Ⅰ)、Ca(Ⅱ)和Mg(Ⅱ)的吸附分离系数为2331、1146、638.1和169.3。BC5/XAD-7对Rb(Ⅰ)和Cs(Ⅰ)也表现出了明显的吸附行为。随着pH增加,其Kd值先逐渐减小而后增大,这是由于弱酸性环境中BC5与H2O间以氢键方式缔合影响了其空腔尺寸,至pH 9.02时其Kd达到最大,且BC5/XAD-7对Rb(Ⅰ)的吸附能力明显高于Cs(Ⅰ),对其他金属离子亦表现为弱吸附或不吸附。测量结果表明,大环杯[4]双冠6空腔尺寸半径为0.162 nm,碱金属和碱土金属离子Li(Ⅰ)、Na(Ⅰ)、Rb(Ⅰ)、Cs(Ⅰ)、Mg(Ⅱ)和Ca(Ⅱ)的离子半径为0.076、0.102、0.152、0.167、0.065和0.099 nm,依据主-客体分子识别机制中的尺寸匹配原则,杯[4]双冠6空腔尺寸半径与Cs(Ⅰ)离子半径比较匹配,二者能够通过非共价键相互作用形成稳定配合物。大环杯[4]双冠5空腔尺寸半径为0.156 nm,与Rb(Ⅰ)离子半径较为匹配。因此,杯[4]双冠6对Cs(Ⅰ)及杯[4]双冠5对Rb(Ⅰ)具有优异的主客体识别性能,这与BC6/XAD-7对Cs(Ⅰ)及BC5/XAD-7对Rb(Ⅰ)具有出色吸附能力的实验结果Kd一致。该实验条件下Rb(Ⅰ)对Li(Ⅰ)、Na(Ⅰ)、Ca(Ⅱ)和Mg(Ⅱ)的吸附分离系数为7739、3804、2117和562.2,Cs(Ⅰ)对Li(Ⅰ)、Na(Ⅰ)、Ca(Ⅱ)和Mg(Ⅱ)的吸附分离系数为521.2、256.2、142.6和37.85。这些数据为超分子识别材料BC6/XAD-7和BC5/XAD-7吸附Cs(Ⅰ)和Rb(Ⅰ)提供了技术支撑,也说明同时高选择性吸附分离Cs(Ⅰ)和Rb(Ⅰ)在技术上是可行的。

图8 pH变化对超分子识别材料吸附性能的影响Fig.8 The influence of pH on the adsorption performance of supramolecular recognition materials
2.2.3 温度对吸附性能影响 在水相pH 9.02和操作温度298~323 K条件下,研究了温度变化对超分子识别材料BC6/XAD-7和BC5/XAD-7吸附Cs(Ⅰ)、Rb(Ⅰ)及水相中其他金属离子性能的影响,其吸附结果见图9。随着操作温度的升高,BC6/XAD-7对Cs(Ⅰ)和Rb(Ⅰ)的吸附分配系数Kd均逐渐减小,这说明BC6/XAD-7对Cs(Ⅰ)和Rb(Ⅰ)吸附均为放热反应,升高温度不利于Cs(Ⅰ)和Rb(Ⅰ)的吸附过程的进行,其吸附反应的焓变分别为47.63和43.55 kJ/mol。与BC6/XAD-7相似,BC5/XAD-7对Cs(Ⅰ)和Rb(Ⅰ)亦表现出了良好的吸附性能,并随着吸附温度的升高,Cs(Ⅰ)和Rb(Ⅰ)的吸附分配系数Kd明显降低,说明BC5/XAD-7对Cs(Ⅰ)和Rb(Ⅰ)的吸附过程为放热反应,提高操作温度不利于BC5/XAD-7对Cs(Ⅰ)和Rb(Ⅰ)的吸附。因BC5的空腔尺寸与Rb(Ⅰ)离子尺寸比较匹配,故BC5/XAD-7对Rb(Ⅰ)的吸附能力明显高于BC6/XAD-7对Rb(Ⅰ)的吸附能力,Rb(Ⅰ)和Cs(Ⅰ)吸附反应的焓变分别为49.11和41.32 kJ/mol。故选择室温或298 K条件对BC6/XAD-7和BC5/XAD-7吸附分离Cs(Ⅰ)和Rb(Ⅰ)是有利的。

图9 温度变化对超分子识别材料吸附性能的影响Fig.9 The influence of temperature on the adsorption of supramolecular recognition materials
2.2.4 吸附性能比较 在维持温度298 K、水相pH 9.02及接触时间10或30 min实验条件下,考察了两种超分子识别材料BC6/XAD-7和BC5/XAD-7对水相中包括K(Ⅰ)在内的所有碱金属和碱土金属离子的吸附行为,比较分析与评价了各金属离子的吸附效率,其结果示于图10。结果表明,BC6/XAD-7对所有碱金属和碱土金属离子的吸附能力为Cs(Ⅰ)>Rb(Ⅰ)>K(Ⅰ)>Sr(Ⅱ)>Ba(Ⅱ)>Mg(Ⅱ)≈Li(Ⅰ)≈Na(Ⅰ)≈Ca(Ⅱ),此时Cs(Ⅰ)的吸附率为92.65%;BC5/XAD-7对K(Ⅰ)及所有金属离子的吸附能力为K(Ⅰ)>Rb(Ⅰ)>Sr(Ⅱ)>Cs(Ⅰ)>Ba(Ⅱ)>Mg(Ⅱ)≈Li(Ⅰ)≈Na(Ⅰ)≈Ca(Ⅱ),在此条件下K(Ⅰ)吸附率为93.94%,Rb(Ⅰ)吸附率为93.23%,这说明在所有碱金属和碱土金属离子存在情况下,BC6/XAD-7和BC5/XAD-7对K(Ⅰ)、Cs(Ⅰ)、Rb(Ⅰ)、Sr(Ⅱ)和Ba(Ⅱ)等均有一定程度的吸附作用,尤其是对K(Ⅰ)的吸附,这对有效吸附分离Cs(Ⅰ)和Rb(Ⅰ)是不利的。考虑到盐湖卤水在提取分离K(Ⅰ)后的余液中,K(Ⅰ)含量已大幅降低,对进一步吸附分离Cs(Ⅰ)和Rb(Ⅰ)的影响相对较小,故应用BC6/XAD-7或BC5/XAD-7于提取钾后余液中同时吸附分离Cs(Ⅰ)和Rb(Ⅰ)具有明显的技术可行性和应用前景。
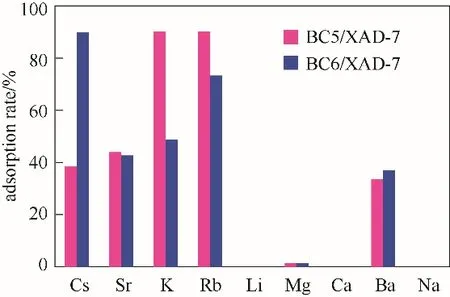
图10 BC6/XAD-7和BC5/XAD-7吸附性能比较Fig.10 Comparison of the adsorption of BC6/XAD-7 and BC5/XAD-7
2.2.5 吸附分离流程 依据实验所得结果及新型超分子识别材料BC6/XAD-7和BC5/XAD-7在碱性介质中吸附Cs(Ⅰ)和Rb(Ⅰ)性能和技术可行性,提出了从提钾余液中有效吸附分离Cs(Ⅰ)和Rb(Ⅰ)的
CREC(cesium and rubidium separation by extraction chromatography by BC6/XAD-7 or BC5/XAD-7)技术流程,其流程示意见图11。单次吸附分离循环中Cs(Ⅰ)和Rb(Ⅰ)回收率分别为99.8%和99.6%。该流程具有以下特点:(1)超分子识别材料BC6/XAD-7和BC5/XAD-7对铷和铯识别能力好,选择性高;(2)吸附-脱附过程不需要采用有机溶剂进行溶解、洗涤或反萃取等技术环节,既克服了溶剂萃取法的不足,又保留了其萃取效率较高等特点;(3)分离过程简洁、高效,设备简单、紧凑;(4)与溶剂萃取法相比,吸附分离过程产生的各种废液量大幅度降低,有利于设施周边环境改善与保护。
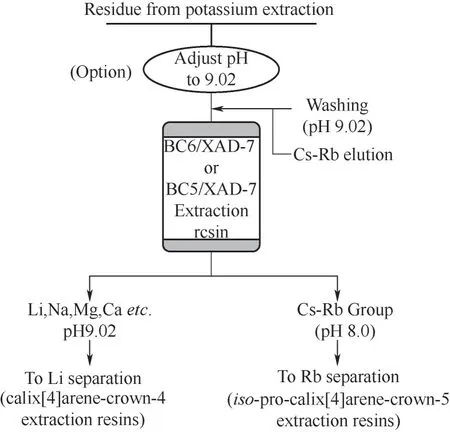
图11 超分子识别材料BC6/XAD-7或BC5/XAD-7吸附分离铯和铷的CREC流程Fig.11 An advanced CRECprocess for cesiumand rubidium separation by extraction chromatography by BC6/XAD-7 or BC5/XAD-7
3 结 论
基于calix[4]crown结构特点及其与Rb(Ⅰ)和Cs(Ⅰ)主客体分子识别特性,在满足空腔尺寸和离子半径“匹配原则”情况下,BC6/XAD-7和BC5/XAD-7对Cs(Ⅰ)和Rb(Ⅰ)具有较强吸附能力和高选择性,在温度298 K及水相pH 9.02条件下,Cs(Ⅰ)和Rb(Ⅰ)对其他金属离子的分离系数均分别大于142和562,其吸附率分别为92.65%和93.23%,单次吸附分离循环中Cs(Ⅰ)和Rb(Ⅰ)回收率分别为99.8%和99.6%,显示出了良好的分离技术前景,提出了从提钾余液中吸附分离Cs(Ⅰ)和Rb(Ⅰ)的CREC技术流程。

