四元体系(Li+,Mg2+//Cl-,borate-H 2O)308.15 K相平衡与相图研究
李栋婵,王嘉宇,王士强,2
(1河北工业大学化工学院,天津310029;2天津科技大学海洋与环境学院,天津300457)
引 言
锂及其化合物广泛应用于电池、半导体、陶瓷、医药、催化剂、航空航天等领域,尤其是锂电池在电动汽车、计算机、通讯、消费电子产品作为主要的电力储存装置,被誉为“21世纪的能源金属”[1-2]。而我国拥有丰富的液体矿床资源如盐湖卤水、地下卤水及油气田卤水。位于青藏高原上的柴达木盆地是我国主要的液体矿产资源富集区,锂资源保有储量(按LiCl计)高达1500多万吨,占全国总储量的83%,晶间卤水Li+平均含量0.642 g·L-1,比工业开采品味高出40~50倍,是富含锂、钾、硼、镁的综合性大型矿床,构成我国特色的优势矿产资源,工业经济价值巨大[3-4]。随着锂辉石等固体矿产资源日益减少,锂盐开发成本越来越高,而盐湖提锂是以水盐体系相图为指导,以太阳能、风能、冷冻等为能源的盐田绿色工艺技术,从卤水中生产的锂产品已占锂产品总量的85%以上,卤水提锂已成为开发生产锂盐的主要途径[5-10]。盐湖卤水资源作为我国的战略性资源,其有效开发利用离不开水盐体系相图的理论指导。
柴达木盆地的盐湖卤水多属于硫酸镁亚型,镁含量高,卤水中镁锂比值高达500~800,由于镁锂是周期表对角线元素,化学性质相近,提锂工艺复杂[11-12]。卤水在蒸发浓缩后期,硼、锂高度富集,主要组成是Li+、Mg2+、Cl-、SO42-、硼酸盐、H2O等,该复杂含锂镁硼卤水体系涉及的子体系相平衡与相图的研究已有相关报道,Fu等[13-14]研究了三元体系Li2B4O7—MgB4O7—H2O固液相平衡关系,镁硼酸盐的存在形态为章氏硼镁石(MgB4O7·9H2O);郭智忠等[15-19]报道了四元体系Li+,Mg2+//Cl-,SO42-—H2O在298.15~323.15 K时的相图,体系中硫酸镁存在多种结晶水合物MgSO4·nH2O(s)(n=7,6,5,4,1.25,1);桑世华等[20-23]研究了四元体系Li+,K+(Na+),Mg2+//borate-H2O固液相平衡关系,确定了硼酸盐矿物的存在形态;宋彭生等[24-25]报道了四元体系Li+,Mg2+//S,borate-H2O在298.15和308.15 K时的相图,体系固液平衡中章氏硼镁石能与硫酸镁稳定共存。

1 实验材料和方法
1.1 材料
LiCl·H2O、Li2B4O7·3H2O、MgCl2·6H2O等试剂均为分析纯,购自国药集团化学试剂有限公司;MgB4O7·9H2O,用硼酸和氧化镁在实验室合成[28],经化学组成分析和X射线粉晶衍射鉴定,纯度≥99.0%;实验用水均为去离子水,pH≈6.60,电导率<1.0×10-4S/m。
1.2 仪器设备
恒温磁力搅拌水浴(北京惠城,HXG–500–8 A),控温精度±0.01℃;密度计(安东帕,DMA4500),精度±0.05 mg·cm-3;折射率仪(安东帕,Abbemat 550),精度±0.0002;pH计(WTW,PH7310),精度±0.002;纯水机(重庆颐洋,Aquapro),X射线粉晶衍射仪(北京普析,MSALXD–3)。
1.3 相平衡实验方法
卤水体系固液相平衡实验采用等温溶解平衡法[29-31],具体实验过程为:从边界三元子体系饱和点梯度加入第三种盐,例如,从三元体系LiCl-Li2B4O7-H2O的共饱点E2梯度加入硼酸镁配制一系列复体点。将配好的溶液放置于恒温磁力搅拌水浴中,温度控制为(35±0.01)℃,搅拌速率为150 r·min-1。采用4#砂芯过滤头定期取液相进行组分分析,至液相组分浓度不变达到固液平衡。平衡后,分别取液相和固相进行组分分析和盐类鉴定。测定平衡溶液的液相组分、密度、折射率和pH等物化性质,并采用X射线粉晶衍射法对盐类矿物进行鉴定。
1.4 分析方法
液相组分中Cl-采用莫尔法测定,硼酸根采用甘露醇存在下的碱式滴定法[32],Mg2+采用EDTA络合滴定法,需用正丁醇-无水乙醇的混合醇为掩蔽剂消除Li+的干扰[33];Li+采用ICP–OES法。容量滴定法测定相对误差≤±0.3%,仪器分析相对误差≤±0.5%。
2 实验结果与讨论
2.1 稳定相平衡溶解度及相图
盐湖老卤四元体系Li+,Mg2+//Cl-,borate–H2O固液相平衡在308.15 K时的液相组成实验测定结果见表1,组分含量为质量百分数(w/%)和Jänecke指数(J/[mol/100 mol(2Li++Mg2+)])。交互四元体系中,Jänecke指数计算按照等摩尔效价原则,参加反应的物质量相等,以100 mol总干盐为基准,采用Jänecke指数绘图能更清楚表达各组分间关系,具体计算公式如式(1)~式(3):

表1 卤水体系Li+,Mg2+//Cl-,borate–H 2O在308.15 K的固液相平衡数据Table 1 Solid-liquid phase equilibria of brine system(Li+,Mg2+//Cl-,borate–H 2O)at 308.15 K
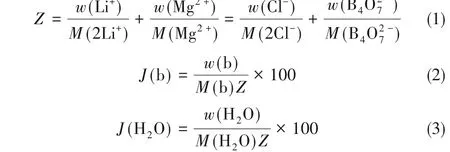
式中,b代表组分。
根据表1中体系液相组分的Jänecke指数,绘制了该体系308.15 K等温相图(图1)和水含量图(图2)。由相图1可知,该四元体系包含4个三元子体系,分别是:①Li2B4O7—MgB4O7—H2O三元共饱点E1平衡固相为Li2B4O7·3H2O+Mg2B6O11·15H2O;②Li2B4O7—LiCl—H2O三元共饱点E2平衡固相为Li2B4O7·3H2O+LiCl·H2O;③LiCl—MgCl2—H2O三元共饱点E3平衡固相为LiCl·H2O+LiCl·MgCl2·7H2O,共饱点E4平衡固相为MgCl2·6H2O+LiCl·MgCl2·7H2O;④MgCl2—MgB4O7—H2O三元共饱点E5平衡固相为MgCl2·6H2O+Mg2B6O11·15H2O。
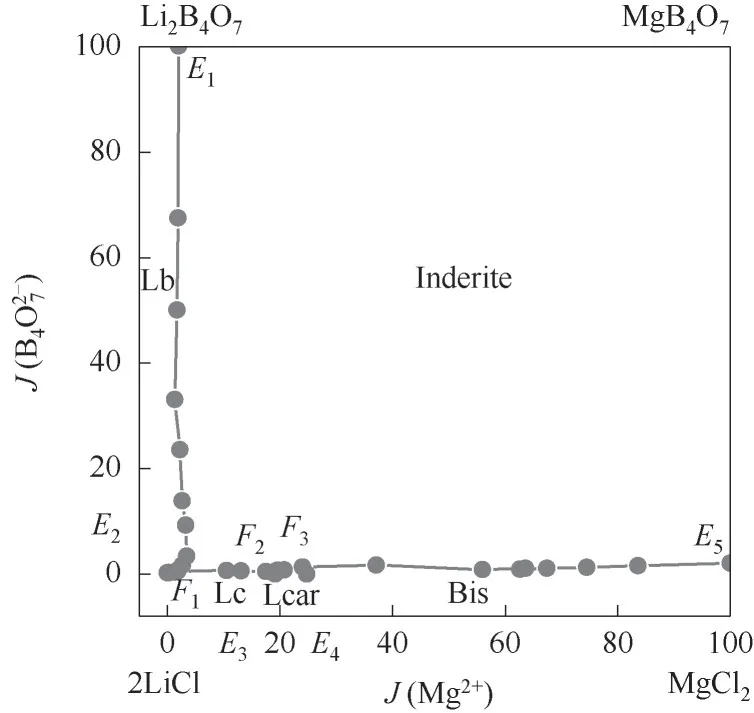
图1 卤水体系(Li+,Mg2+//Cl-,borate–H2O)308.15 K相图Fig.1 Phase diagramof brine system(Li+,Mg2+//Cl-,borate–H2O)at 308.15 K

图2 卤水体系(Li+,Mg2+//Cl-,borate–H2O)308.15 K水含量图Fig.2 Water-phase diagramof brine system(Li+,Mg2+//Cl-,borate–H2O)at 308.15 K


图3 体系中部分盐类矿物的XRD谱图Fig.3 XRDpatternsof minerals in brine system
该四元体系相图中有7条溶解度曲线,其中曲线E1F1是Li2B4O7·3H2O和Mg2B6O11·15H2O共饱和时的溶解度曲线,曲线E2F1是Li2B4O7·3H2O和LiCl·H2O共饱和时的溶解度曲线,曲线F1F2是Mg2B6O11·15H2O和LiCl·H2O共饱和时的溶解度曲线,曲线E3F2是LiCl·H2O和LiCl·MgCl2·7H2O共饱和时的溶解 度 曲 线,曲 线F2F3是LiCl·MgCl2·7H2O和Mg2B6O11·15H2O共饱和时的溶解度曲线,曲线E4F3是LiCl·MgCl2·7H2O和MgCl2·6H2O共饱和时的溶解度曲线,曲线E5F3是Mg2B6O11·15H2O和MgCl2·6H2O共饱和时的溶解度曲线。该体系有3个四元共饱点。
四元共饱点F1,存在的平衡固相为Li2B4O7·3H2O+Mg2B6O11·15H2O+LiCl·H2O,液 相 组 成 为w(Li+)=3.44%,w(Mg2+)=0.11%,w(Cl-)=17.76%,w(B4)=0.21%,w(H2O)=78.48%。
四元共饱点F2,存在的平衡固相为LiCl·MgCl2·7H2O+Mg2B6O11·15H2O+LiCl·H2O,液 相 组 成 为w(Li+)=5.58%,w(Mg2+)=2.37%,w(Cl-)=35.19%,w(B4)=0.56%,w(H2O)=56.30%。
四元共饱点F3,存在的平衡固相为LiCl·MgCl2·7H2O+Mg2B6O11·15H2O+MgCl2·6H2O,液 相 组 成 为w(Li+)=4.85%,w(Mg2+)=2.68%,w(Cl-)=32.14%,w(B4)=0.96%,w(H2O)=59.37%。
由表1和图2可见,该四元体系中水含量J(H2O)在E1点最大,在E1F1溶解度曲线上,水含量变化最大,水含量从E1点急剧减小,在共饱点F2处达到最小值,其原因是溶液中LiCl含量持续增大,Li+含量从0.28%(E1)增加到5.58%(F2)。由于Li+离子是水的结构促成剂,水化性较强,LiCl饱和时溶液的水活度很小,因而水含量极低。在E2F1、F3E5溶解度曲线上,随J(Mg2+)含量增加,水含量J(H2O)逐步增加,而在F1F2、F2F3溶解度曲线上水含量变化较小,可见体系水含量变化主要受溶液中LiCl浓度的影响最大。结合等温相图和水含量图可以完整地表达系统中复体点的相态。
2.2 溶液物化性质
测定四元体系Li+,Mg2+//Cl-,borate-H2O在308.15 K时的溶液密度、折射率和pH等物化性质,结果见表2。根据测定的物化性质数据绘制了该四元体系溶液密度(ρ)、折射率(nD)和pH图,见图4。
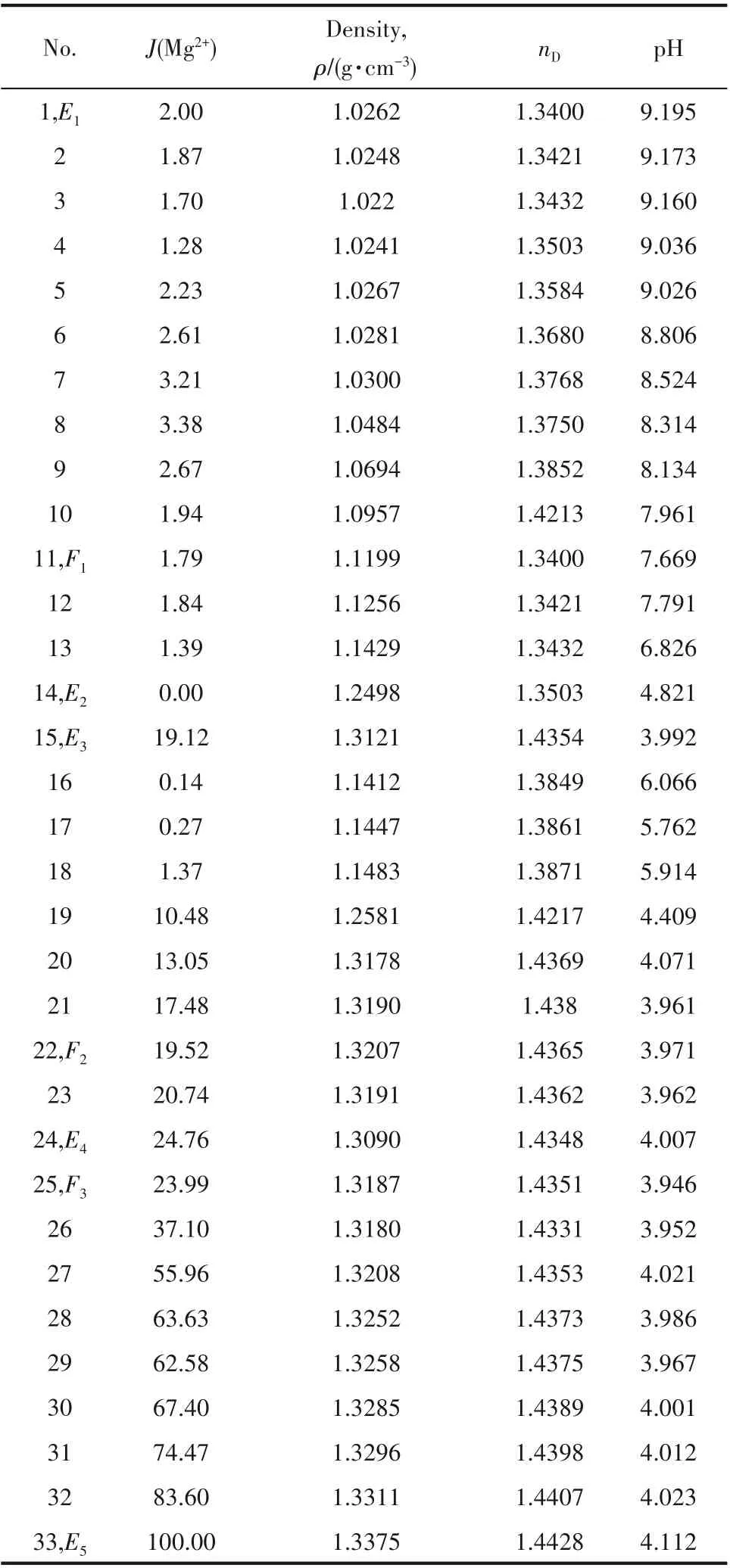
表2 四元体系Li+,Mg2+//Cl-,borate–H 2O在308.15 K的物化性质Table 2 Physiochemical property of the quaternary system(Li+,Mg2+//Cl-,borate–H 2O)at 308.15 K
图4(a)是溶液密度变化规律图,随着溶液中J(Mg2+)增加,密度整体呈增大趋势。在E1F1、F1F2曲线上,溶液密度随MgCl2含量增加快速增大,由1.0262 g·cm-3增大到1.3207 g·cm-3,而在F2F3、F3E5曲线上,溶液密度逐步增大,在E5点有最大值1.3375 g·cm-3。图4(b)是溶液折射率变化规律图,其变化规律与密度基本一致。随着溶液中J(Mg2+)增加,折射率整体呈增大趋势。在E1F1、F1F2曲线上,溶液折射率随MgCl2含量增加快速增大,由1.3400增大到1.3503,而在F2F3、F3E5曲线上,溶液折射率逐步增大,在E5点有最大值1.4428。图4(c)是溶液pH变化规律图,其变化规律与密度、折射率相反。随着溶液中J(Mg2+)增加,pH整体呈减小趋势。在E1F1、F1F2曲线上,溶液pH随MgCl2含量增加快速减小,由9.195减小到4.821,在F3点有最小值3.946,而在F2F3、F3E5曲线上,溶液pH趋于稳定。

图4 四元体系(Li+,Mg2+//Cl-,borate–H2O)308.15 K溶液物化性质Fig.4 Physiochemical property diagramof the quaternary system(Li+,Mg2+//Cl-,borate–H2O)at 308.15 K
2.3 热力学模型预测
Pitzer理论是以统计热力学为基础半经验的离子相互作用模型,该理论把Debye-Hückel理论引申到高浓度的酸、碱、盐溶液,并且该理论以简洁和紧凑的形式描述电解质溶液的热力学性质,广泛应用于天然水体、海水和盐湖卤水体系的地球化学过程、海相盐矿床沉积特征、盐湖盐类矿物结晶沉积顺序的模拟预测[34-35]。
按照化学平衡原理,恒温恒压下,某种盐(或称电解质)在溶液中达到溶解平衡时,其溶解平衡常数K是常数。盐类溶解平衡的判据是溶液中盐的离子活度积等于盐的溶解平衡常数。对于Li+,Mg2+//Cl-,borate–H2O体系308.15 K相图上任意一个共饱线上的相点,都可以利用与之平衡的固相溶解平衡常数,通过联立方程组求出平衡液相组成。以F1点为例,它是Li2B4O7·3H2O、Mg2B6O11·15H2O和LiCl·H2O三种固体与液相达到溶解平衡的相点:
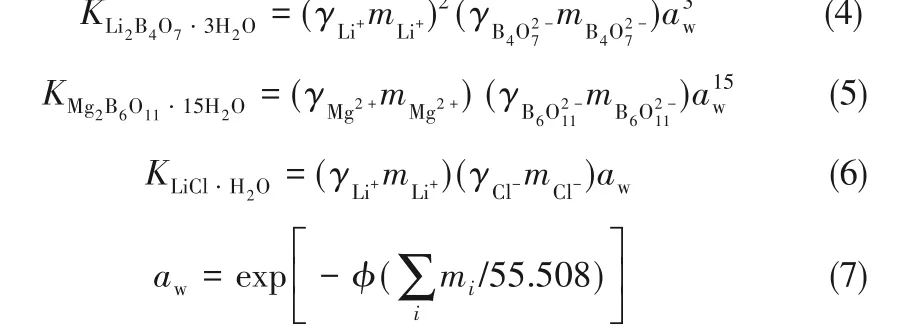
Pitzer电解质溶液理论给出了计算溶液中离子、分子的活度系数和溶液渗透系数的公式,四元体系Li+,Mg2+//Cl-,borate-H2O在308.15 K时的Debye-Hückel参数Aϕ=0.3851,硼酸盐参数采用相应的溶解度数据拟合,其他所需的模型参数见表3。因此,利用盐在水中的溶解平衡常数,通过联立方程组,即可求得盐在水中的溶解度,并绘制了该四元体系理论预测的相图,见图5。由图可见,计算相图与实验相图总体趋势吻合较好,硼酸盐溶液中存在[B4O5(OH)4]2-、[B3O3(OH)5]2-、[B(OH)4]-等多种形态离子,需进一步开展不同形态硼酸盐体系热力学性质研究,获得更精确的含硼离子作用参数,提高模型预测的精度。

图5 四元体系(Li+,Mg2+//Cl-,borate–H2O)308.15 K计算与实验相图对比Fig.5 Comparison of the calculated and experimental phase diagramof the system(Li+,Mg2+//Cl-,borate–H2O)at 308.15 K
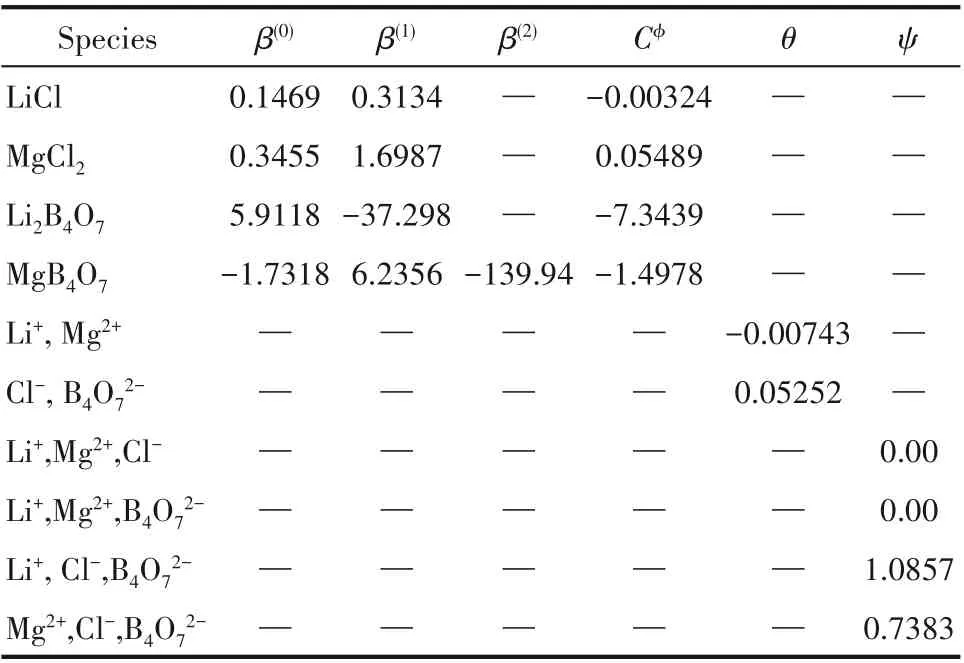
表3 四元体系Li+,Mg2+//Cl-,borate–H 2O在308.15 K模型参数Table 3 Pitzer parameters of the system(Li+,Mg2+//Cl-,borate–H 2O)at 308.15 K
3 结 论
本文采用等温溶解平衡法,开展富锂硼盐湖老卤体系Li+,Mg2+//Cl-,borate–H2O固液相平衡与相图研究,获得平衡溶液的液相组成、密度、折射率和pH,并绘制了该体系干盐相图、水图和物化性质图。研究结论如下。
(1)该四元体系有5个盐类矿物结晶区LiCl·H2O、Li2B4O7·3H2O、MgCl2·6H2O、Mg2B6O11·15H2O和锂光卤石LiCl·MgCl2·7H2O。其中锂光卤石LiCl·MgCl2·7H2O是异成分复盐,其结晶区最小,氯化锂溶解度大,对其他组分有盐析作用。
(2)体系中硼酸根主要以 [B4O5(OH)4]2-,[B3O3(OH)5]2-的结构形式存在,镁硼酸盐的结晶形态为多水硼镁石,其结晶区约占总面积的90%以上,表明镁硼酸盐易于结晶析出。溶液中MgCl2存在下章氏硼镁石(MgB4O7·9H2O)不稳定,转化为多水硼镁石(Mg2B6O11·15H2O)。
(3)采用Pitzer热力学模型对该四元体系的溶解度进行理论预测,计算相图与实验相图吻合较好。该四元体系的相平衡与相图研究,可为含锂硼盐湖卤水资源锂、镁、硼产品开发及其综合利用提供化工热力学基础数据。
符号说明
aw——水活度
J——Jänecke指数,mol/100 mol(2Li++Mg2+)
K——盐的溶解平衡常数
M——组分分子量
m——组分的质量摩尔浓度,mol·kg-1
nD——溶液的折射率
pH——溶液的酸度值
w——组分的质量百分数,%
γ——离子活度系数
ρ——溶液的密度,g·cm-3

