不同分子量聚乙二醇对氧化铁粉体粒径和形貌的影响
吴 月,苗拯宁,侯帅帅,夏义文
(安徽景成新材料有限公司,安徽合肥 230000)
纳米氧化铁是氧化铁材料中应用领域较广的一种化工材料,考虑到纳米氧化铁自身的无毒以及低污染性、磁学性质优异,同时也具有较好的耐光性和抗腐蚀性等优点,因此在生物医学领域、磁性材料领域、建筑材料领域、催化剂领域、化妆品领域、环境保护领域等诸多领域有着极为广泛的应用[1,2]。
磁铁矿四氧化三铁(Fe3O4)、磁赤铁矿伽马三氧化二铁(γ-Fe2O3)和赤铁矿阿尔法三氧化二铁(α-Fe2O3)是被研究最多的三种铁系列材料[3]。这三种氧化铁均由铁和氧两种元素组成,然而三者的晶体结构、物理和化学性质存在极为显著的差异。[4]研究表明,纳米γ-Fe2O3被广泛地应用在药物领域中的载体材料[5]、核磁共振领域中的造影增强剂材料[6]、癌症治疗领域专用材料[7,8]、生物基因工程技术材料[9-11]、磁生物分离技术材料、[12]生物细胞分离与标记材料[13]、药物靶向传导材料[14]和医学肿瘤治疗材料等生物医学领域相关材料。
纳米级γ-Fe2O3的主要合成方法包括溶剂热法、溶胶凝胶法、沉淀法以及微乳液法等。溶剂热法是通过溶剂的作用,在密闭的容器中借助高温高压发生化学反应而得到纳米粒子的方法[15]。这种方法得到的产物的形貌比较规整,粒度分布相对均匀,但是对设备的要求比较严苛,前期投入成本比较高。溶胶凝胶法可以认为是比较新的工艺,主要是利用金属化合物的水解和缩聚反应先得到溶胶,再通过脱水形成凝胶,最后经过干燥和煅烧等过程得到所需纳米粒子[16]。这种方法的化学原材料价格便宜,反应条件比较温和,同时产物的粒径均匀,但是形成溶胶和凝胶所需的反应周期相对较长,颗粒粒径也比较容易受到环境因素的影响。沉淀法是最普遍的合成方法,原理主要是在二价铁和三价铁离子的混合水溶液(或其他混合溶液)中,加入沉淀剂(比如碱)而直接得到氢氧化铁或其他难溶的铁沉淀,经过离心、干燥和煅烧得到产物[17,18]。这种方法得到的氧化铁系列产物纯度比较高、粒度分布均匀,但是在干燥工艺过程中粒子之间容易团聚,而且在沉淀反应过程中容易把杂质引进来,因此这种工艺也存在局限。微乳液法一般都是包括水(或电解质水溶液)、油、表面活性剂和助表面活性剂四相,借由形成的微乳液滴中的化学物质交换和反应制备出多种规则的纳米粒子,能够有效地降低团聚作用,使得到几纳米的产物成为可能[19]。
本文目的在于提供一种利用PEG的固相法制备纳米γ-Fe2O3的方法。并且采用了较为简单的机械研磨,通过固相法制备了不同形貌纳米级γ-Fe2O3。本文中的固相法工艺条件简单,成本低,对设备的要求低,绿色环保以及γ-Fe2O3的产量大。该方法通过改变PEG的分子量制备不同粒径的纳米级γ-Fe2O3。
1 实验部分
1.1 原料
碳酸亚铁,六水三氯化铁,氢氧化钠,碳酸钠(无水碳酸钠或水合碳酸钠,以下均以无水碳酸钠为例),PEG-2000,PEG-6000,PEG-10000均为分析纯原料,水为超纯水。
1.2 纳米γ-Fe2O3的制备
称取1.45g碳酸亚铁(12.5mmol)、6.76g六水三氯化铁(25mmol)、4.00g氢氧化钠(100mmol)于陶瓷研钵中,研磨5min后再加入0.20g不同分子量的PEG(PEG-2000、PEG-6000、PEG-10000),研磨20min后再加入1.06g无水碳酸钠(10mmol),具体用量和条件见表1。继续手工研磨固体混合物60~120min,反应结束后,将陶瓷研钵中的混合物转移到50mL的离心管中,加入20~30mL的去离子水,用玻璃棒搅拌悬浊液2~5min,接着离心悬浊液,过滤,继续加入去离子水,重复洗涤和离心的步骤五次;将离心结束的固体在60~80℃的温度下干燥1~2h,紧接着在马弗炉煅烧,煅烧温度是200℃,煅烧时间为60min;最后把煅烧后的粉末装入样品袋中,得到γ-Fe2O3粉体。
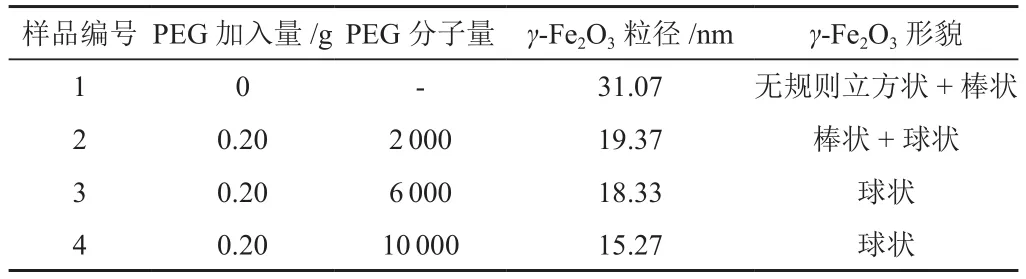
表1 实验条件和γ-Fe2O3检测结果
1.3 纳米γ-Fe2O3的表征
反应所得产物γ-Fe2O3纳米粒子的晶相组成采用日本X射线粉末衍射仪(电压35KV,电流30mA,λ=0.154178nm)进行分析,扫描速度是4(°)/min,扫描范围是20o~70o;根据谢乐公式计算出γ-Fe2O3的一次粒径。透射电子显微镜(TEM)对生成的γ-Fe2O3形貌进行分析,加速电压是200kV。
2 结果与讨论
2.1 PEG分子量对γ-Fe2O3晶体类型和颗粒形貌的影响
1号样是不加PEG的γ-Fe2O3样品,其对应的XRD结果如图1(a)所示,经过谢乐公式计算,其粒径是31.07nm。XRD图谱中四个样品(a-d)均出现六个极其明显的衍射峰,2θ为30.2o、35.5o、43.5o、53.5o、57.4o和62.9o的衍射峰分别对应于(220)、(311)、(400)、(422)、(511)和(440)晶面,衍射峰的位置和强度完全同γ-Fe2O3标准卡(JCPDS标准卡No.39-1346)保持一致,除γ-Fe2O3的特征衍射峰外并未出现任何其余的杂峰,说明合成的物相单一。加入PEG后,随着分子量从2 000增加到10 000,如图1所示,产物的晶体类型保持不变,但是粒径从19.37nm逐渐降低到15.27nm,一方面说明加入PEG后,γ-Fe2O3的粒径显著降低;另一方面说明PEG的分子量对γ-Fe2O3的粒径有一定的影响。
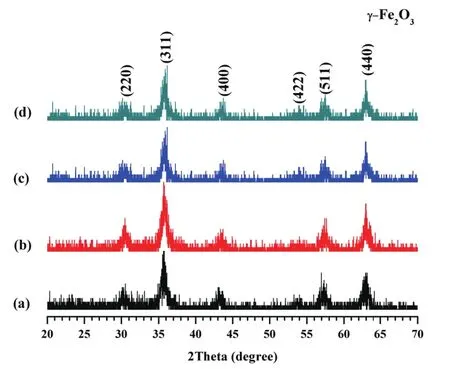
图1 不同条件下γ-Fe2O3的XRD图谱
对得到的γ-Fe2O3的形貌进行观察,SEM的结果如图2所示。当不添加PEG时,制备得到的纳米γ-Fe2O3粒子的SEM如图2(a)和(b)所示。由图2(a)和(b)可见,反应体系中不添加PEG,得到无规则的立方状和棒状的混合结构,此时的纳米颗粒形态大部分为无规则的立方状结构,少数是棒状结构,其中棒状结构的长约200nm,长径比较大。还可以发现少部分未组装成棒状或无规则立方状的球形纳米粒,可以推测这些球状纳米粒是基本单元,正是这些球状单元自组装才得到的棒状或无规则立方状聚集体结构。当加入PEG后,如图2(c)和(d)所示,可以看出γ-Fe2O3的形貌发生显著的改变。添加较低分子量的PEG(PEG-2000)时,如图2(c)和(d)所示,γ-Fe2O3的形貌是球状和棒状的混合结构,其中球状的平均粒径约20nm。

图2 不同条件下γ-Fe2O3的SEM图
2.2 可能的反应机理
四氧化三铁和三氧化二铁在一定温度的条件下可实现相互转化[20]。对于四氧化三铁而言,它的导电性和磁性比较优异,但是具有较差的热力学稳定性,一般而言,四氧化三铁在常温下可以缓慢转化为γ-Fe2O3,只是这个转化过程极为缓慢,而且需要氧气的参与,然而,将所处环境温度提高到260℃时,这个转化过程就能够快速地完成[21]。对于棒状结构的长度相比不加PEG时有所增加,长径比变大。当PEG的分子量增加到6 000时,如图2(e)和(f)所示,则几乎全部得到球状γ-Fe2O3,其平均粒径是25nm左右。添加PEG-10000后,如图2(g)和(h)所示,发现γ-Fe2O3的形貌和加入PEG-6000的形貌变化不大,都是球状的纳米粒子,平均粒径同样变化不大。因此,通过改变PEG的分子量,可在微观上改变γ-Fe2O3的形貌,实现对γ-Fe2O3形貌的调控作用。γ-Fe2O3而言,它呈现的是阳离子缺位的尖晶石型结构[22],γ-Fe2O3是四氧化三铁向α-Fe2O3相过度的中间亚稳相,在更高的温度下(420~460℃)就可完全地转变为最稳定的α-Fe2O3相[22]。本实验中煅烧温度为200℃,得到红褐色的γ-Fe2O3纳米粉体。其实,当煅烧温度为80℃时,得到的是黑色的Fe3O4纳米粉体,其XRD的检测结果如图3所示。因此,升高温度利于得到γ-Fe2O3纳米粉体。
聚乙二醇是一种非离子型的表面活性剂,具有较长的疏水链,由于分子结构的空间位阻效应,导致粒子之间的键合作用显著降低,从而对颗粒平均粒径的降低极为有利,同时也能够在一定程度上起到防止团聚的作用。[21]在化学合成的过程中,聚乙二醇(PEG)可以认为是一种模板剂,具体归类是软模板,从而诱导晶体可以定向排列和生长,这就为得到复杂多变的特殊微观形貌提供了理论支持[20,21]。PEG 10000相对于PEG 2000或PEG 6000有较大的聚合度,因而具有较好的空间位阻效应,表现为分散性更好,也起到阻止γ-Fe2O3团聚的作用,使得粒径降低。但是,具体的反应机理还有待深入研究。
3 结论
通过固相法,利用机械研磨的方式,在PEG的定向作用下,快速而又简便地制备了平均粒径是20nm的不同形貌的γ-Fe2O3粉体,主要得到以下两个结论:
1)提高PEG的分子量,γ-Fe2O3粉体的平均粒径降低,形貌由棒状/球状逐渐变为球状,然而不添加PEG时,得到的是较大粒径的无规则立方状/棒状结构的γ-Fe2O3粉体。
2)煅烧温度也会显著影响产物的晶体类型,在较低温度下(80℃),得到的是Fe3O4,而在200℃时,则得到γ-Fe2O3粉体。

