光暗条件下菌-藻共生系统处理废水污染物研究
吴丹丹, 张乔丹, 黄 鑫
(安徽建筑大学 环境与能源工程学院, 安徽 合肥 230601)
随着城镇化的不断发展,污水排放量与日剧增,废水的有效处理对改善水体环境至关重要。目前,国内污水处理工艺普遍存在占地面积大、处理成本较高等问题。活性污泥法处理工艺,需要频繁切换厌氧和好氧条件,存在后期产生剩余污泥处置难度较大的问题[1-2]。微藻能高效去除水体氮、磷物质,但存在后期微藻收集难度大、不宜分离的难题[3]。研究表明微藻同活性污泥相结合形成的菌-藻共生系统可大幅提高污染物的去除率,且有利于菌-藻生物质的絮凝和后期分离[4]。运用菌-藻共生系统处理废水的最大优势是提高了废水中污染物的资源化转化率。菌-藻共生系统中的微藻在去除废水污染物时,其自身的生物质也得到积累,且这些生物质可作为资源化产品的原料:磷元素通过系统作用转化为微藻脂质(生物柴油原料),氮元素通过系统作用转化为微藻蛋白质(饲料添加剂)和色素(虾青素)[5]。
微藻作为自养生物,光照是其生长的重要条件。本研究在生物量相同的情况下,探究光暗条件对纯藻、菌-藻体系处理污染物的影响,并观察菌-藻共生系统的变化。
1 材料与方法
1.1 小球藻的富集和活性污泥的驯化
选用上海光宇生物科技有限公司的小球藻,采用BG-11培养基进行培养,培养温度25 ℃,光照强度2 000 lx左右,光暗比14∶10,配置磁力搅拌器,转速210~230 r/min,放置在人工光照培养箱内。活性污泥取自污水处理厂二沉池,取回后闷爆处理去除有机质,然后用人工配置的废水驯化处理,人工废水成分与实验废水成分相同,每两天换一次水。
1.2 菌-藻系统构建及实验组设置
实验设置4组:纯藻光照组、菌-藻1∶1光照组、纯藻黑暗组、菌-藻1∶1黑暗组,每组实验设置2个平行样。总生物量200 mg,光照组时间设定24 h,光照强度2 300 lx左右,黑暗组用厚黑布包裹与光照组放置在相同培养箱内,培养箱温度设置为25 ℃,磁力搅拌器转速280~300 r/min,实验装置如图1所示。

图1 实验装置图
实验前富集的小球藻液及驯化的活性污泥,真空抽滤过0.45 μm生物滤膜,在105 ℃烘箱烘4 h,利用重量差法计算小球藻和活性污泥的生物量,根据实验组所需的生物量计算小球藻和活性污泥的体积,经离心机8 000 r/min离心10 min,弃去上清液,用配置的人工废水冲洗离心管并转移至人工配置的废水内。实验周期为5 d,每天取样一次。
1.3 人工废水配置
精确称取葡萄糖(324 mg)、 NaNO3(242.4 mg)、 K2HPO4·3H2O(36.75 mg)、 EDTA(1 mg)、 C6H10FeNO8(6 mg)、 C6H8O7·H2O(6 mg)、 CaCl2(27 mg)、 MgSO4·7H2O(75 mg)、 H3BO3(2.86 mg)、 MnCl2·4H2O(1.81 mg)、 ZnSO4·7H2O(0.222 mg)、 CuSO4·7H2O(0.079 mg)、 CoCl2·6H2O(0.05 mg)、 Na2MoO4·2H2O(0.391 mg)于1 L去离子水中,调节pH=7.0~7.1。设置人工废水的COD、 NO3--N、 PO43--P浓度分别为350 mg/L、40 mg/L、5 mg/L。
1.4 分析方法
培养液经离心机8 000 r/min离心10 min,取上清液过0.45 μm滤头,用于测定N、P含量和COD指标,离心后的固相用于叶绿素A的测定。采用紫外分光光度法和钼锑抗分光光度法测定N和P含量,重铬酸钾法测定COD,采用80%丙酮溶液浸提法测定小球藻叶绿素A[6],在680 nm波长下用紫外分光光度测定藻类OD值[7],使用荧光显微镜观察菌-藻形态。
2 结果与讨论
2.1 污染物去除
2.1.1 NO3--N去除
总生物量控制在200 mg的条件下,纯藻、菌-藻光暗组对NO3--N的去除情况如图2所示。实验第1 d菌-藻1∶1光照组的NO3--N从39.1 mg/L下降到0.95 mg/L,去除率达到99%;纯藻光照组的NO3--N一直处于下降状态,实验第5 d下降至19.8 mg/L,去除率49%;菌-藻1∶1黑暗组的NO3--N在第1 d后仍有明显的下降趋势,实验第5 d下降到11.6 mg/L,去除率达到70%;纯藻黑暗组的NO3--N在实验第1 d有所下降(27 mg/L),后续基本不变,去除率只有30%。实验结果说明,菌-藻组在黑暗条件下去除NO3--N效果优于纯藻组,光照条件下菌-藻组处理效果最佳。
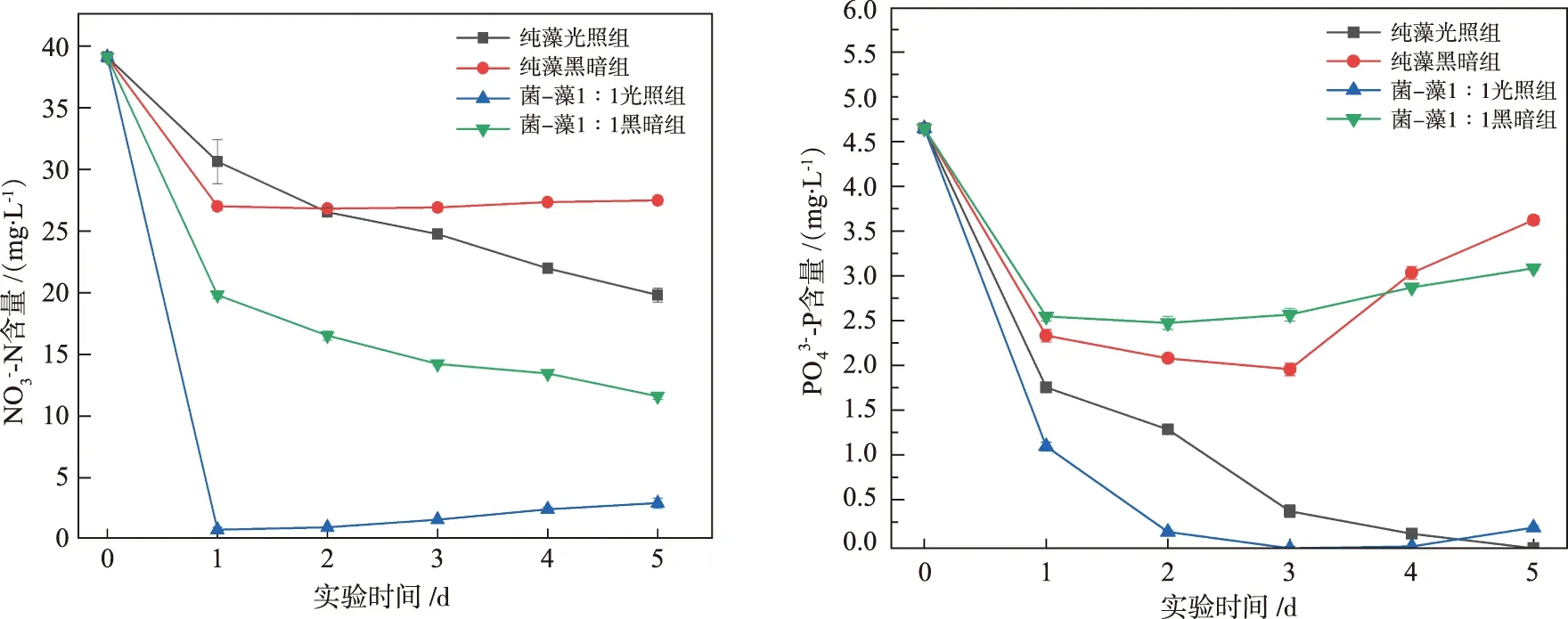
图2 NO3--N去除情况 图3 PO43--P去除情况
2.1.2 PO43--P去除
PO43--P去除情况如图3所示。各组实验第1 d PO43--P均出现下降。光照条件下菌-藻1∶1实验组在第2 d时PO43--P从4.6 mg/L下降至0.19 mg/L,去除率达到99%;纯藻组在光照条件下PO43--P的含量一直处于下降状态,实验第5 d去除率达到99%。相对而言,黑暗条件下菌-藻组和纯藻组对PO43--P的去除不明显,在实验第1 d后PO43--P含量处于平稳状态,后期纯藻组第3 d后出现了PO43--P的释放现象。主要原因在于微藻对PO43--P的去除主要依靠有氧环境下的吸收,经过多阶段磷酸化转化为磷脂和ATP等体内有机物[8]。光照有利于小球藻的光合作用产生氧气,促进PO43--P的消耗,黑暗限制了小球藻的光合作用,导致去除不理想。 相比于纯藻组,菌-藻组在光照条件下快速去除水体磷元素,表明菌-藻系统能够协同促进PO43--P的去除。
2.1.3 COD去除
COD去除情况如图4所示。实验第1 d,菌-藻组无论是黑暗还是光照条件下,对COD的去除速率比纯藻组快。实验第5 d菌-藻光照组的COD由最初的311 mg/L下降至37 mg/L,去除率达到88%,这与NO3--N的去除情况相对应,表明菌-藻对碳、氮的利用是协同进行的。光可以作为在菌-藻混合模式中相关物质吸收的促进剂[9]。在光照条件下的菌-藻体系中,细菌作为分解者,能够利用小球藻光合作用产生的氧气分解有机物,同时其产生的无机物可被小球藻利用,菌与藻的协同加速了COD的去除。

图4 COD去除情况
2.2 光照组菌-藻形态变化
采用40倍荧光显微镜对菌-藻光照组实验前后的菌-藻形态进行观察。小球藻在显微镜下为绿色细胞体,荧光镜检时能够发出红光,如图5所示。实验开始时,菌-藻光照组中的菌与小球藻处于分散状态如图5(a)和图5(c)所示。实验第5 d,小球藻和活性污泥已处于聚集状态如图5(b)和图5(d)所示,表明形成了良好的菌-藻共生系统。
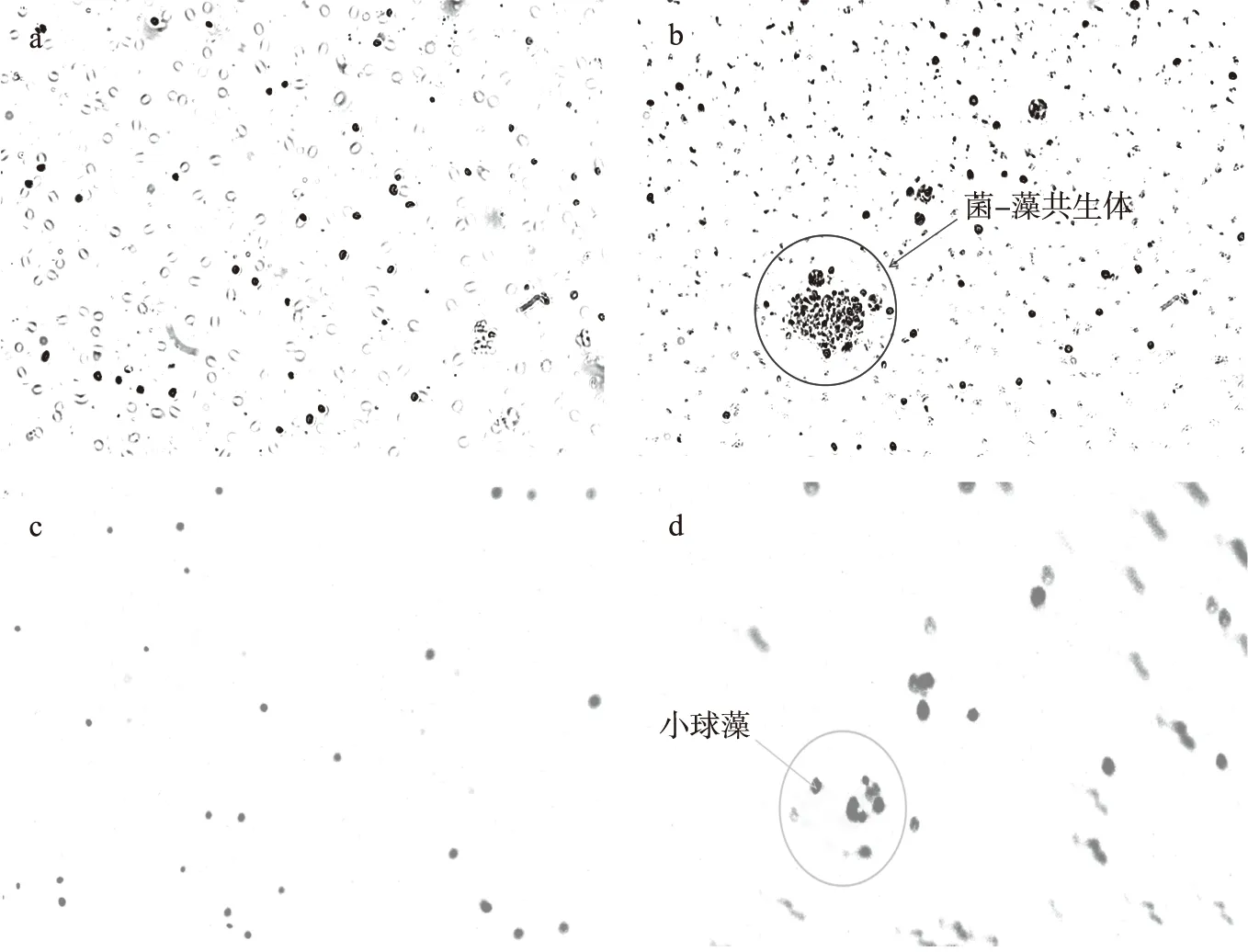
图5 菌-藻光照组不同时期形态变化图
2.3 小球藻生物量变化
通过测定小球藻叶绿素A含量和OD值表征小球藻生物量变化如图6和图7所示。各组实验OD值和叶绿素A含量变化趋势相同。由图7可知,整个实验周期光照条件下的纯藻组和菌-藻组小球藻都有一定的生长,实验前两天菌-藻组生长速率更快。实验第5 d,菌-藻光照组叶绿素A从原来的1.57 mg/L增至3.83 mg/L,增幅为145%,纯藻光照组由3.2 mg/L增至5.1 mg/L增幅为59.3%。黑暗条件对纯藻组小球藻的生长有较大影响,在实验第3 d后OD值和叶绿素A迅速下降,说明了藻类出现死亡现象,这是导致后期纯藻黑暗组出现磷释放的原因;黑暗条件下的菌-藻组,OD值和叶绿素A在实验前期有一定的上升,后期出现缓慢下降,黑暗条件对菌-藻组中小球藻的影响较小。
3 结 语
在光照、黑暗条件下对比研究了纯藻组和菌-藻组对污染物的去除效果。光照条件下菌-藻1∶1组处理效果最好,COD、NO3--N 、PO43--P去除率分别达到 88%、99%、99%。光照条件更有利于菌-藻体系小球藻的生长,协同加速去除废水污染物。菌-藻光照组叶绿素A从原来的1.57 mg/L增至3.83 mg/L,增幅为145%。黑暗条件对纯藻组处理污染物效果影响较大。通过荧光显微镜对菌-藻光照组生物形态变化的观察可知,小球藻与活性污泥在实验结束时形成了良好的共生系统。

