分子对接技术筛选鲈鱼肌球蛋白中黄嘌呤氧化酶抑制肽
赵贵琴,李婷婷,宋敏杰,孙 宏,励建荣*,谢 晶,邓尚贵
痛风作为一种常见的慢性病,其发病人数呈逐年上升趋势。目前对于痛风的治疗方法主要有抑制尿酸生成和促进尿酸排泄两种,其中抑制尿酸生成的药的效果远高于促进尿酸排泄的药[1]。常用的抑制尿酸生成的药,例如别嘌呤醇、非布司他这类化学药物对肾脏有较大的副作用,不宜长期使用[2]。开发生物活性成分作为黄嘌呤氧化酶抑制剂成为近年的研究热点。例如:Li 等[2]从脱酚核桃水解产物、大豆水解产物和鲣鱼水解产物中提取出黄嘌呤氧化酶抑制肽;姚兰等[3]从大叶冬青中分离出了抑制黄嘌呤氧化酶的有效成分;Shi 等[4]从尖蕾狗牙花中分离出的生物碱成分也能较好地抑制黄嘌呤氧化酶。此外,高良姜[5]、鼠曲草[6]、芦荟[6]、槲皮素[7]等植物源性前体物质中都分离出可有效抑制黄嘌呤氧化酶作用的物质。
嘌呤类物质是引起痛风的前体物质,且黄嘌呤氧化酶(Xanthine oxidase,XOD)是人体尿酸代谢中的最后一个酶,该酶在治疗高尿酸血症及通风方面受到广泛关注。有研究指出可以通过抑制黄嘌呤氧化酶的活性来减少尿酸的生成[8]。目前已报道许多植物源的黄嘌呤氧化酶抑制剂,如绿原酸[9]、黄酮类物质[10]、白皮杉醇[11]、白藜芦醇[11]、异丹叶大黄素[11]等,而动物源性的黄嘌呤氧化酶抑制剂鲜有报道。本文选取鲈鱼体内的一种肌球蛋白作为研究对象。
传统的蛋白质纯化方法根据蛋白质的溶解度、分子大小、带电性质和配体特异性的分离方法分为四类[12]。其中根据溶解度的大小纯化蛋白可以用盐析、等电点沉淀和低温有机溶剂沉淀法;根据蛋白质分子大小可以用透析、超滤和凝胶过滤法;根据带电性质可用电泳法和离子交换层析法;根据配体特异性分离可以用亲和色谱法[13-16]。传统的蛋白纯化方法具有过程繁琐、历时长,且得到的产物纯度低、产量小等缺点。分子对接技术可以缩短蛋白纯化过程所需时间,并可很好地筛选出所需的多肽,对多肽进行生物活性预测及试验验证,得出效果良好的多肽。吕靖[17]通过分子对接技术筛选到可以抑制脲酶活性的抑制剂,尿素的快速水解会引起氨的非生产性挥发,造成局部环境pH值的升高,给环境和人体带来负面影响,通过筛选脲酶抑制剂以缓解对环境和人体造成的危害。樊玥[18]利用分子对接技术将三肽与黄嘌呤氧化酶对接,筛选出其中具有较强ACE 抑制效果的三肽。Palakurti 等[19]利用虚拟筛选、3D 建模筛选出β-分泌酶抑制剂,这类酶抑制剂可以有效缓解阿尔兹海默症。Wu 等[20]利用分子对接技术成功地从甜高粱籽粒酶解产物中筛选出血管紧张素转换酶抑制肽,开发预防高血压的新型产品。
综上所述,本文将利用虚拟酶解、分子对接,并结合体外实验验证等方法,从鲈鱼肌球蛋白中筛选可有效抑制黄嘌呤氧化酶的多肽。通过合成这些多肽,并体外抑制试验验证,最终获得具有良好黄嘌呤氧化酶抑制效果的肽。
1 材料与方法
1.1 材料与试剂
鲈鱼肌球蛋白氨基酸序列,来自美国国立生物技术信息中心NCBI(http://www.ncbi.nlm.nih.gov)蛋白数据库[21]:Myosin-7B (Myosin heavy chain 7B,cardiac muscle beta isoform) [Dicentrarchus labrax]1936 aa protein。
别嘌呤醇结构,来自美国国立生物技术信息中心NCBI(http://www.ncbi.nlm.nih.gov)数据库[21]。
黄嘌呤氧化酶,北京索莱宝科技有限公司;黄嘌呤标准品,北京索莱宝科技有限公司;甲醇(色谱级),上海麦克林生化科技有限公司;冰乙酸(色谱级),上海阿拉丁生化科技股份有限公司;抗超氧阴离子试剂盒,南京建成生物工程研究所;四丁基氢氧化铵离子对试剂(色谱级),上海迈瑞尔公司;活性肽(纯度>95%),生工生物工程(上海)股份有限公司。
1.2 仪器与设备
高效液相色谱仪岛津LC-2030,日本岛津公司;电子分析天平MS105DU,瑞士梅特勒-托利多仪器有限公司;涡旋混合器XH-T,金坛区白塔新宝仪器厂;电热恒温水槽DK-8D,上海-恒科学仪器有限公司;Discovery Studio 2017 R2 Client,美国Accelrys 公司。
1.3 试验方法
1.3.1 虚拟酶解 从美国国立生物技术信息中心NCBI(http://www.ncbi.nlm.nih.gov)蛋白数据库中检索鲈鱼肌球蛋白可以得到Myosin-7B (Myosin heavy chain 7B,cardiac muscle beta isoform)[Dicentrarchus labrax],该肌球蛋白来自鲈鱼心肌,共有1 936 个氨基酸。将该蛋白通过网站(https://www.expasy.org/)PeptideCutter[22]进行虚拟酶解。其中所使用的酶为低特异性的胰凝乳蛋白酶、胃蛋白酶(pH 1.3)、胰蛋白酶,通过这3 种酶的共同作用将上述蛋白质水解为多肽链,然后根据需要选择四肽、五肽和六肽。
1.3.2 分子对接 从蛋白质数据库PDB(http://www.rcsb.org/)[18]中获取黄嘌呤氧化酶(Xanthine Oxidase,XOD) 的3D 结构,从中检索到了1FIQ——一种从牛乳中获取的黄嘌呤氧化酶的晶体结构。受体蛋白1FIQ 共有6 个结合位点,主要位点为:Fe2S2(无机)团簇(FES)、黄素腺嘌呤二核苷酸(FAD)、二氧钼离子(MOS)。根据文献记载,FAD 苯并咪唑类似物对XOD 具有非竞争性、不可逆抑制作用[23],因此,在本次分子对接过程中选择FAD 结合位点。该结合位点共有12 个氨基酸残基结合位点:Asp360、Val259、Asn351、Val342、Phe337、Thr262、Glu263、Ile264、Gly350、Ser347、Leu257、Leu404,在该结合位点处能与这些氨基酸残基结合,则有能抑制XOD 的可能性。同时用筛选出的多肽与黄嘌呤位点进行对接,对结果进行验证。
将得到的XOD 晶体结构导入Discovery Studio 2017 R2 Client(DS2017),并对其进行分子对接前的去水加氢原子等一些准备操作。将上一步得到的多肽在DS2017 软件中进行3D 建模,将其作为配体进行能量最小化。
以1FIQ 作为受体蛋白,以虚拟酶解的多肽为配体,以(X:32.366,Y:17.515,Z:111.022)为对接中心,以7.2 为对接半径进行分子对接。采用Dock Ligands 中的半柔性对接LibDock 进行分子对接,并且设置参数为刚性优化、快速筛选,其余设置为默认值进行分子对接。按打分将筛选出的多肽进行下一步操作。
1.3.3 药物代谢动力学预测 利用Discovery Studio 2017 R2 Client 进行药物代谢动力学(ADMET)的预测,进一步筛选多肽。ADMET 是对药物的吸收、分布、代谢、排泄和毒性进行全面的研究[24],ADMET 性质研究主要以人源性或人源化组织功能性蛋白质为“药靶”,将体外研究技术与计算机模拟等方法相结合[25],研究药物与体内生物物理和生物化学屏障因素间的相互作用,为体外筛选XOD 抑制剂提供了良好的基础。
1.3.4 黄嘌呤氧化酶抑制效果验证 通过高效液相色谱法进行活性验证,以黄嘌呤转化量反映酶活性变化,用1 mL 黄嘌呤(200 μL/mL)与50 μL黄嘌呤氧化酶(0.1 U/mL)反应作为空白对照,在反应体系中分别加入 0.6,0.7,0.8,0.9,1.0,2.0,3.0 mg/mL 的多肽1 mL,根据加入多肽后对整个反应体系中黄嘌呤的转化量的影响确定其抑制作用,整个反应体系在35 ℃下反应20 min,随后加入20 μL 盐酸(1 mol/L)作为反应终止剂。色谱条件根据任丽琨等[26]的研究并稍有改变,色谱条件为:柱温45 ℃,流动相=V甲醇∶V混合液(V水∶V冰乙酸∶V四丁基氢氧化铵=997∶1.5∶1.5)=5∶95,检测波长254 nm,流速0.5 mL/min,进样量10 μL 进行等度洗脱检测。
超氧阴离子检测按照试剂盒方法进行检测,用超氧阴离子试剂盒检测XOD 氧化黄嘌呤或次黄嘌呤转化为尿酸的过程中产生的超氧阴离子O2-。
2 结果与分析
2.1 鲈鱼肌球蛋白虚拟酶解结果
从NCBI 中获得一条有1 936 个氨基酸的鲈鱼肌球蛋白。肌球蛋白是鲈鱼体内的主要蛋白之一,并且具有可靠的氨基酸序列。利用Peptide Cutter 模块,并选择其中的低特异性的胰凝乳蛋白酶、胃蛋白酶(pH 1.3)、胰蛋白酶3 种酶的组合作用于鲈鱼肌球蛋白。因为肽链过长的多肽不容易与XOD 的活性位点结合,因此选择氨基酸较少的肽链,根据需要筛选了所需肽链,共得到三肽100 条、四肽45 条、五肽39 条、六肽33 条,具体结果如表1所示。
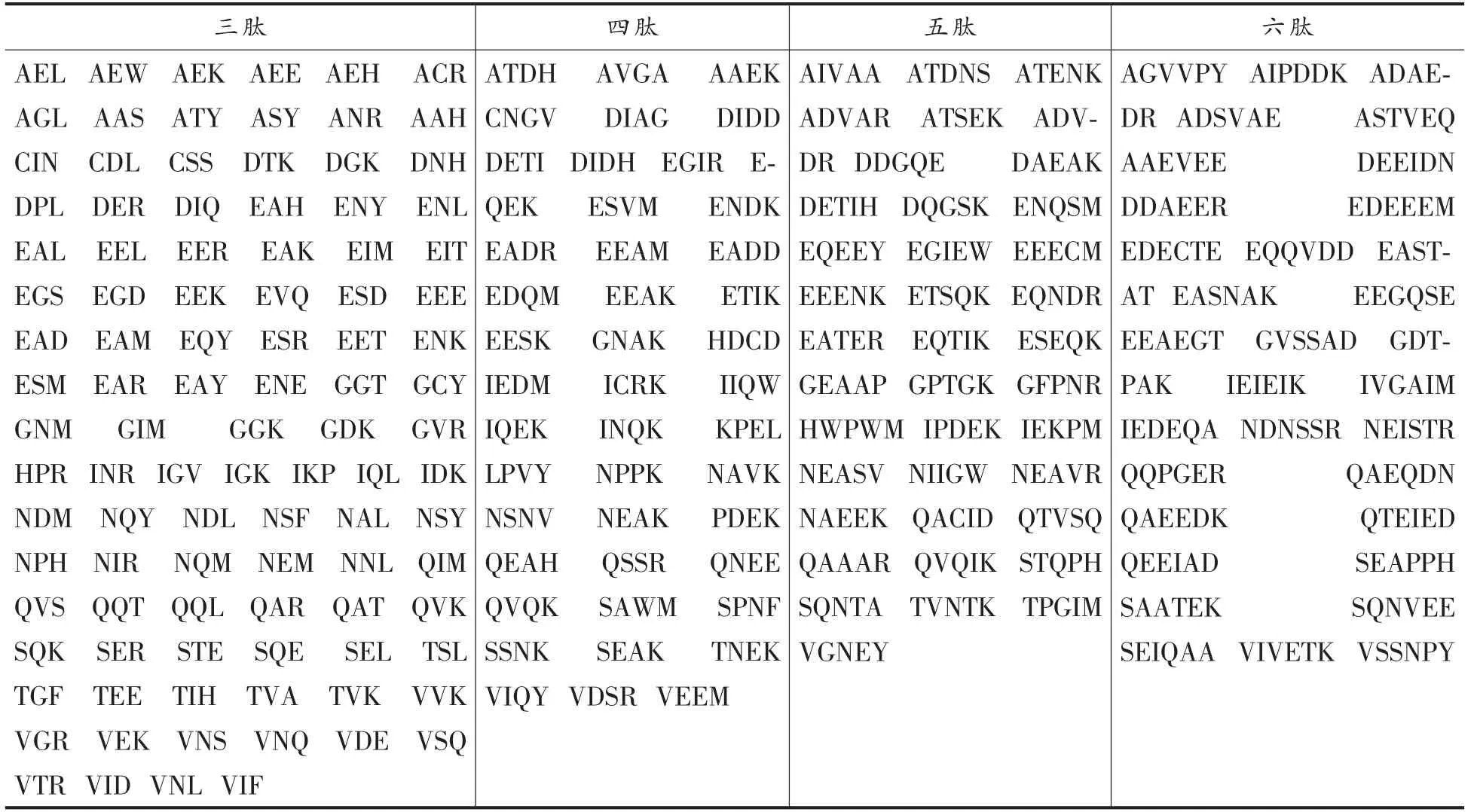
表1 鲈鱼肌球蛋白虚拟酶解结果Table 1 Results of virtual enzymatic hydrolysis of myosin in bass
2.2 多肽与黄嘌呤氧化酶的分子对接结果
黎青勇[27]已经研究了抑制XOD 的三肽,因此本文主要对四肽、五肽、六肽进行研究。分子对接可以通过研究分子间相互作用从而预测分子间的结合方式,因而被广泛用于抑制剂的筛选。
受体蛋白1FIQ 共有6 个结合位点,主要活性位点为:Fe2S2(无机)团簇(FES)、黄素腺嘌呤二核苷酸(FAD)、二氧钼离子(MOS)。根据文献记载FAD 苯并咪唑类似物对XOD 具有非竞争性、不可逆抑制作用[27],因此,在本次分子对接过程中选择FAD 结合位点。该结合位点共有12 个氨基酸残基结合位点:Asp360、Val259、Asn351、Val342、Phe337、Thr262、Glu263、Ile264、Gly350、Ser347、Leu257、Leu404,在该结合位点处能与这些氨基酸残基结合,则有抑制XOD 的可能性。同时用筛选出的多肽与黄嘌呤位点进行对接,对结果进行验证。
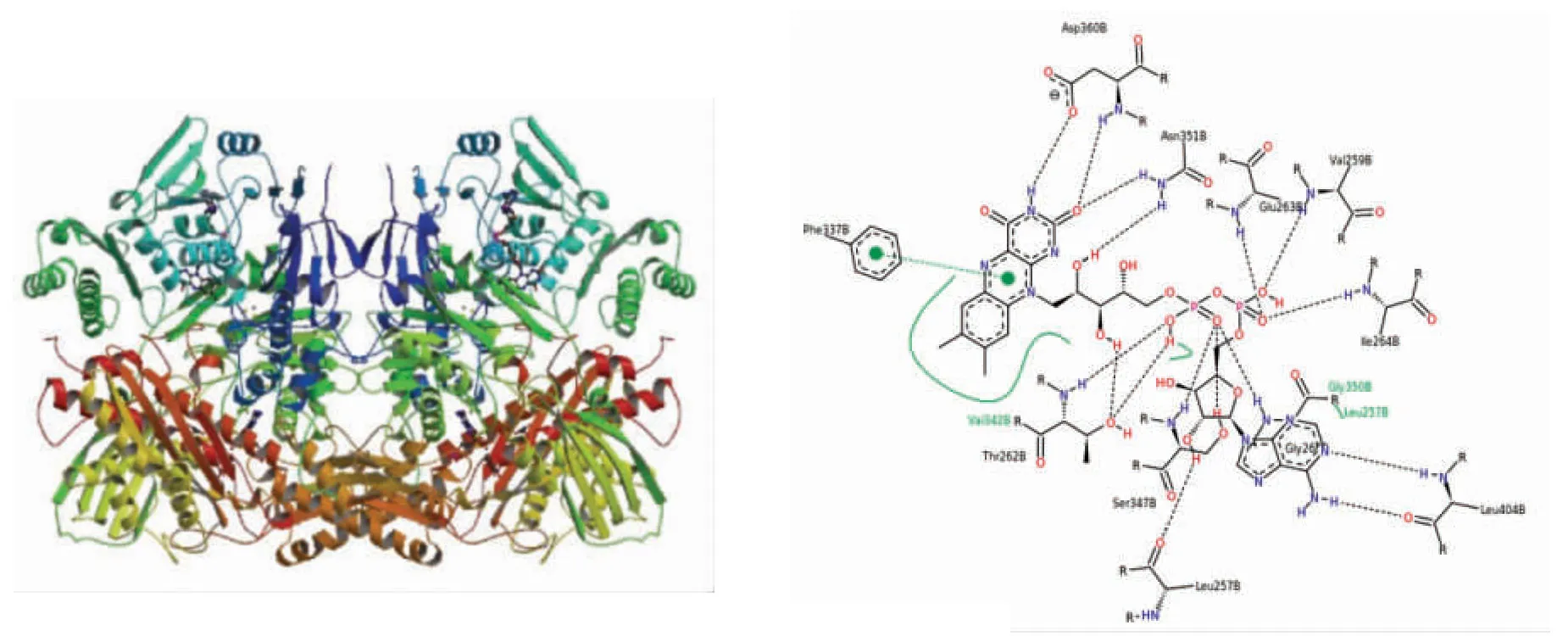
图1 1FIQ(左)及FAD 配体(右)Fig.1 1FIQ (left) and FAD ligand (right)
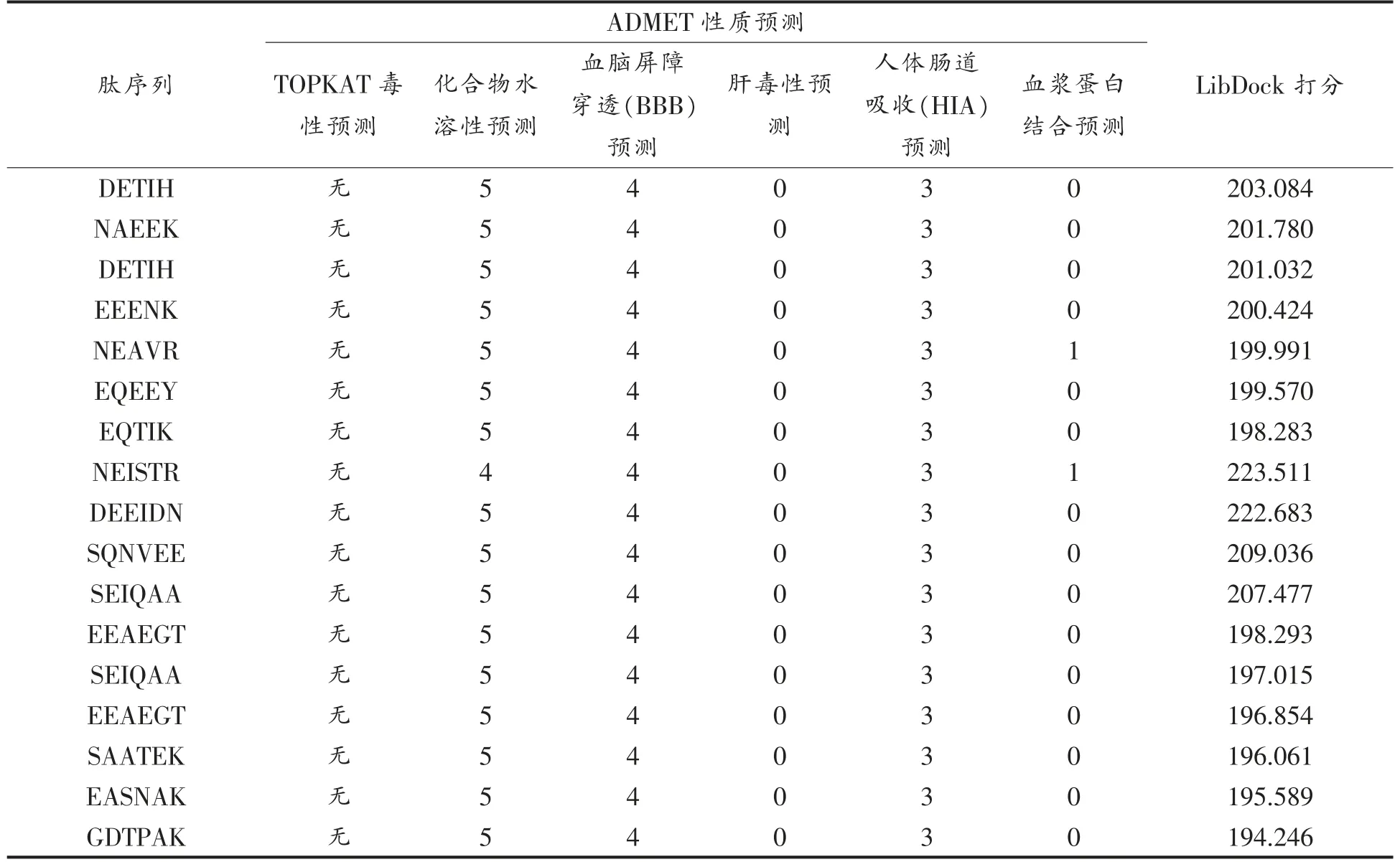
2.2.1 ADMET 及分子对接结果 根据分子对接的打分结果分别选择出3 种多肽打分最高的10条多肽并对这30 种多肽进行了ADMET 预测。如表2所示,所有多肽水溶性良好且都未显示出TOPKAT 毒性以及肝毒性,这表明打分较高的这些肽对人体有害的可能性较小[28],虽然穿透血脑屏障的可能性不明确,但是由于其吸收率低可以猜测其对血脑屏障的穿透力也极低,可忽略不计。综上所述,ADMET 预测结果显示了人体友好型多肽。

表2 ADMET 及分子对接结果Table 2 ADMET and molecular docking results
根据表3所示内容,在ADMET 预测中只有血浆蛋白预测结果显示出了差异性,其中EADR、QSSR、ADVDR、NEAVR、NEISTR 的预测结果中显示其与血浆蛋白的结合能力高于90%,表明这5种多肽与血浆蛋白的结合能力可能高于目标酶,即不能到达目标结合位点产生相应反应[30],因此,这5 种肽不能用于接下来的活性验证过程。
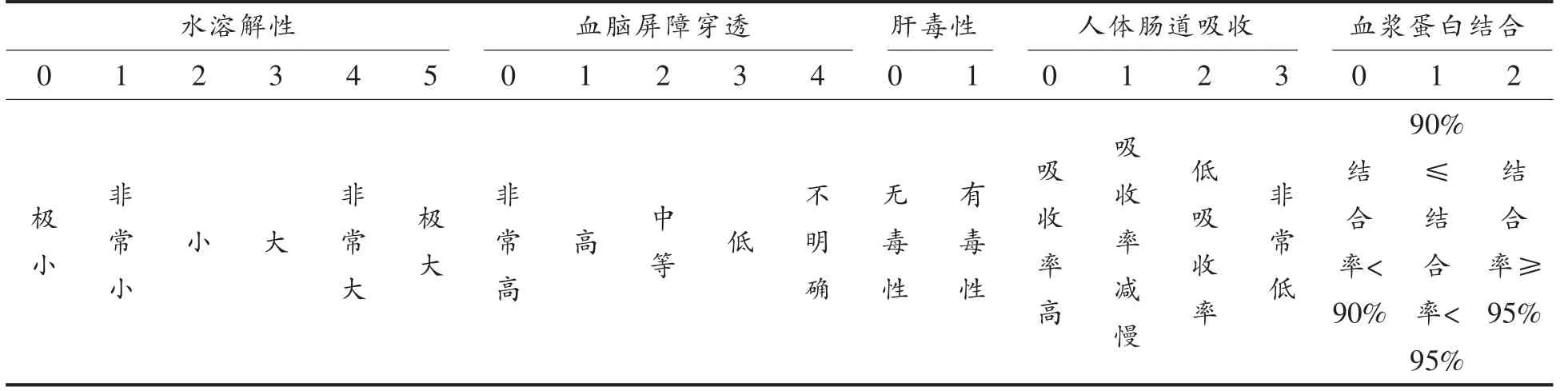
表3 ADMET 赋分参考表[28-29]Table 3 ADMET scoring reference table[28-29]
在ADMET 预测性能相差不大的情况下,选择分子对接打分较高的3 种多肽进行分子对接的进一步结合分析以及活性验证,有文章指出芳香族氨基酸残基,如色氨酸、酪氨酸、苯丙氨酸和组氨酸这4 种氨基酸的多肽,更有利于抑制XOD[27],因此选择选择五肽EQEEY 进行验证。最终选择四肽DIDH、五肽EQEEY、六肽DEEIDN 进行接下来的分析。
2.2.2 多肽抑制XOD 机理 多肽需要与XOD 结合后,才能产生正向或反向的结果,基于此分析DIDH、EQEEY 和DEEIDN 在分子对接过程中与XOD 形成的结构,并对其进行分析。该过程中用已知的XOD 抑制剂别嘌呤醇作为对照,并对筛选出的3 个多肽与XOD 的结合方式与别嘌呤醇与XOD 的结合方式进行对比分析。
(续表2)
图2为3 种多肽与XOD 结合后的2D 可视化分析。图2a 为已知的XOD 抑制剂别嘌呤醇,以它为对照来分析筛选出的3 种肽与XOD 的结合,从而推断3 种肽是否有抑制XOD 的潜力。别嘌呤醇与XOD 的氨基酸残基Gly265、Asn261、Gly350 之间形成范德华作用力,与XOD 的氨基酸残基Glu263、Leu257、Thr262、Ser347 形成氢键作用力,与XOD 的氨基酸残基Val258 和Ile264 之间形成疏水相互作用。别嘌呤醇通过与XOD 的这些氨基酸残基相互作用结合,从而产生抑制效果。图2b为DIDH 与XOD 的相互作用模式图,其中DIDH与XOD 的氨基酸残基 Glu267、Thr262、Leu305、Lys256、Ala302、Leu287、Pro281、Leu245、Glu402、Lys249 之间形成范德华力,与XOD 的氨基酸残基Ile264、Gly260、Asn261、Val259、Glu263、Ser347、Gly350、Gly349、Ala301、Leu404 之间形成氢键相互作用,与XOD 的氨基酸残基Leu257、Leu398、Ile403、Ala346、Ile353 之间形成疏水相互作用。图2c 为EQEEY 与XOD 的相互作用模式图,EQEEY与XOD 的氨基酸残基 Asn351、Gly350、Glu267、Ser347、Val345、Gly260、Leu257、Pro253、Glu254、Ala255、Ile353、Gly399、Pro400、Leu397、Lys395、Ser392 之间形成范德华力,与XOD 的氨基酸残基Val259、Glu263、Ile264、Arg394、Leu398、Thr396 之间存在氢键作用,与XOD 的氨基酸残基Ala346之间产生疏水相互作用。图2d 为DEEIDN 与XOD 的相互作用模式图,DEEIDN 与XOD 的氨基酸残基 Val345、Leu404、Gly349、Thr354、Ile353、Ala346、Val342、Ile264、Asn331、Phe337、Leu305、Gly265、Val258、Pro400、Gly399、Glu402、Lys249、Ile403、Arg394 形成范德华作用力,与XOD 的氨基酸残基Thr262、Asn261、Ser347、Gly260、Thr396、Leu257、Val259、Lys256 形成氢键相互作用,与XOD 的氨基酸残基Leu398 形成疏水相互作用。
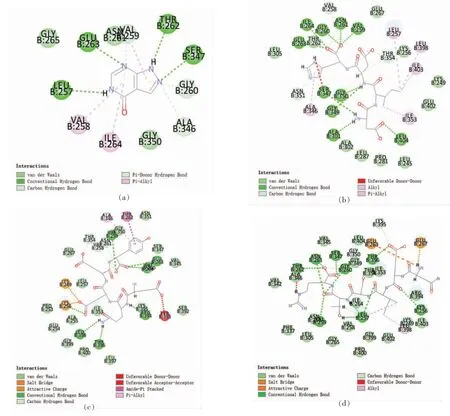
图2 别嘌呤醇-XOD(a)、DIDH-XOD(b)、EQEEY-XOD(c)、DEEIDN-XOD(d)FAD 结合位点2D 模式图Fig.2 2D pattern diagram of FAD binding sites of Allopurinol-XOD (a),DIDH-XOD (b),EQEEY-XOD (c),DEEIDN-XOD (d)
3 种肽与XOD 的氨基酸残基结合情况可以看出,DEEIDN 与XOD 的结合最为稳固,不仅作用的氨基酸数量最多,而且形成氢键的数量也多,DEEIDN 相比于其它两种肽,与重要氨基酸残基的结合量是4,是3 种肽里最多的,所以预测DEEIDN 将拥有最好的XOD 抑制活性。DIDH 的氢键形成数量是10,是3 种肽里形成氢键最多的肽,因此与XOD 形成了最稳定的结构[31],但是由于其氨基酸数量是3 种肽里最少的,这可能导致了其与有效氨基酸残基的结合数量不高,所以抑制活性较DEEIDN 低[32]。最后是EQEEY,它是与XOD 作用最少的肽,与有效氨基酸残基的结合有2 个,因此预测其活性较低,但是因为其分子质量大于DIDH,所以可能在进入活性口袋的过程中易被阻隔[33]。根据上述结果,以别嘌呤醇与XOD 的氨基酸残基结合为标准,统计了筛选出的3 种肽与别嘌呤醇一致的结合位点,其中只有疏水相互作用没有出现在筛选出的3 种肽中。
将筛选出的3 种肽与XOD 的已知活性抑制位点——黄嘌呤结合位点(对接中心为X:20.162026,Y:9.638915,Z:122.168331)进行对接,只有四肽DIDH 可以与该位点结合。DIDH 与XOD 的氨基酸残基 Phe649、Val1011、Ser876、Phe1099、Leu873、Ser1075、Phe1013 之间形成范德华力,与Glu802、Pro1076、Asn768 之间形成氢键,与Leu648、Leu1014 间形成疏水相互作用。黄嘌呤位点的对接可以证明DIDH 有可能是在这个位点与XOD 对接从而抑制XOD 活性,但是其它筛选出的肽却无法通过该位点进行直接对接,间接证明了FAD 位点成为XOD 抑制肽的筛选位点。与黄嘌呤结合位点相比,FAD 位点处可以与更多的氨基酸残基相接触,并且因为可定义的活性位点半径远大于黄嘌呤结合位点,所以可以容纳分子质量较大的肽,这一点也说明了黄嘌呤位点只能与四肽DIDH 结合。
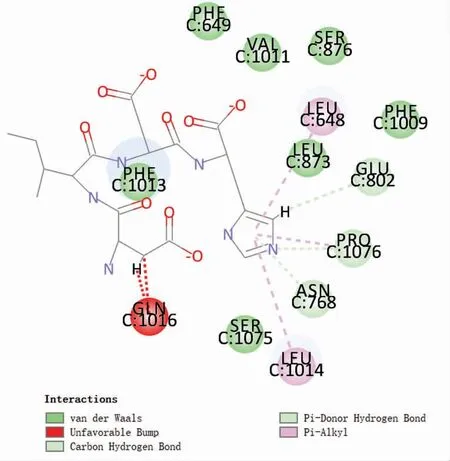
图3 DIDH-XOD 黄嘌呤结合位点2D 模式图Fig.3 2D pattern diagram of DIDH-XOD xanthine binding site

表4 XOD 氨基酸残基结合对照表Table 4 Comparison table of XOD amino acid residue binding
2.2.3 活性验证结果 从生工生物工程(上海)股份有限公司合成了纯度>95%的DIDH、EQEEY、DEEIDN 以进行最终的活性验证,首先用质量浓度为10 mg/mL 的3 种多肽验证其是否有XOD 抑制性,然后确定有抑制效果的多肽,并测定其半抑制浓度。
根据图4b 可以确定黄嘌呤在该液相条件下在9.844 min 时出的峰,其峰面积为6 166 632,然后在相同的条件下检测出加入50 μL XOD 后结果如图4a 所示,黄嘌呤的峰面积减小为3 418 978,这说明在该反应条件下XOD 具有良好的酶活能够降解黄嘌呤。在此基础上,分别向反应体系中加入10 mg/mL 的3 种多肽,在反应相同时间后发现其具有良好的XOD 抑制活性,加入3 种多肽的反应体系中,黄嘌呤并未明显减少,其峰面积保持在6 048 187,5 959 283,6 030 867,与对照组黄嘌呤的含量差别不大,因此可以看出,3 种多肽具有良好的XOD 抑制活性。根据图5可以直观地看出3种肽中DEEIDN 拥有相对较好的XOD 抑制性,3种肽的抑制效果都非常明显。该结果与上述的分子对接结果相一致。
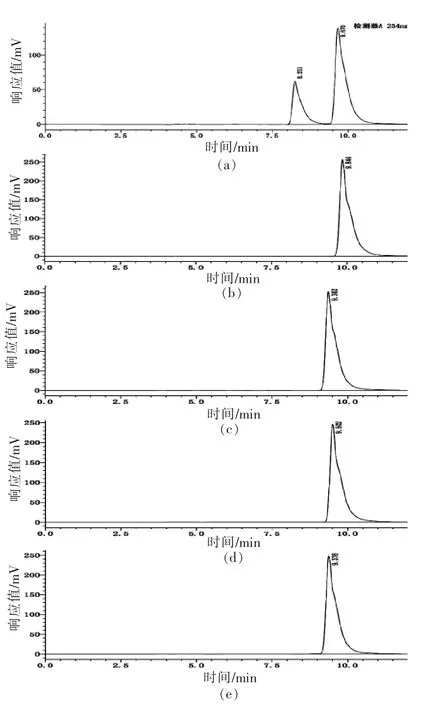
图4 黄嘌呤+XOD(a)、黄嘌呤(b)、黄嘌呤+XOD+DIDH(c)、黄嘌呤+XOD+EQEEY(d)、黄嘌呤+XOD+DEEIDN(e)液相示意图Fig.4 High performance liquid phase diagram of xanthine+XOD (a),xanthine (b),xanthine +XOD+DIDH (c),xanthine +XOD+EQEEY (d),xanthine +XOD+DEEIDN (e)

图5 黄嘌呤+XOD(a)、黄嘌呤(b)、黄嘌呤+XOD+DIDH(c)、黄嘌呤+XOD+EQEEY(d)、黄嘌呤+XOD+DEEIDN(e)活性验证效果统计图Fig.5 Statistical results of activity verification of xanthine +XOD (a),xanthine (b),xanthine +XOD+DIDH (c),xanthine +XOD+EQEEY (d),xanthine+XOD+DEEIDN (e)
为了进一步确认3 种多肽的抑制活性,通过浓度梯度反应以及SPSS 软件确定其半抑制浓度[34]。
抑制率的计算公式为:

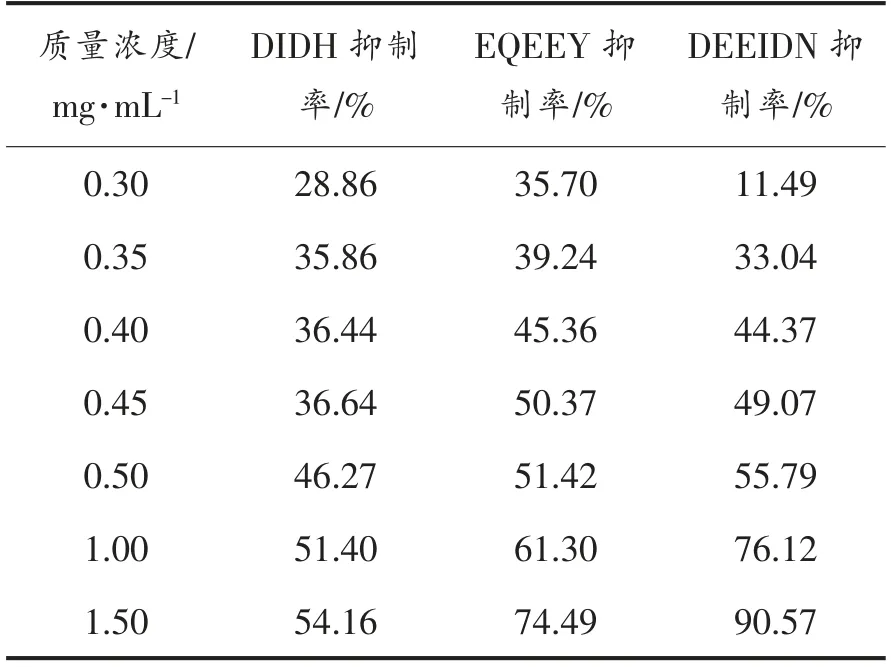
表5 DIDH、EQEEY、DEEIDN 的抑制率及半抑制浓度统计表Table 5 Statistical table of inhibitory rates and semi-inhibitory concentrations of DIDH,EQEEY,DEEIDN
在相同浓度下,3 种肽的抑制率及半抑制浓度都有不同的分布。从抑制率方面来看,DEEIDN的抑制率在浓度变化不大的情况下迅速发生变化,随着浓度的变化幅度增大,其抑制率的增速反而下滑,这说明其半抑制浓度较小,根据SPSS 的统计分析其IC50=0.503 mg/mL,具有较强的XOD抑制活性,是3 种多肽中半抑制浓度最小的,并且DEEIDN 在相同的情况下,抑制率也是最高的,这与上述的分子对接结果相一致。DIDH 的抑制率是最低的,其半抑制浓度IC50=0.976 mg/mL,数据表明DIDH 对XOD 的抑制性是最低的,根据与XOD氨基酸残基的结合情况来看,很有可能是因为与Gly350 形成的范德华力的抑制效果大于与Ser347形成氢键的效果。在这种高剂量的情况下,可能会对人体造成未知的伤害,并且其工业化应用的成本高,不宜产业化使用。EQEEY 在浓度较小的情况下,抑制率就已经是三者中最高的,随着浓度的增大,抑制率的升高速率逐渐减慢,导致了其半抑制浓度的增大,其半抑制浓度IC50=0.512 mg/mL。EQEEY 的抑制效果比DIDH 高,但又比EQEEY低,但其在低浓度的范围下抑制率较高,可以将这一特性转化为实际生产中的应用,在质量浓度小于0.5 mg/mL 的使用情况下,这3 种肽中EQEEY最具竞争力。
由于XOD 将黄嘌呤或次黄嘌呤转化为尿酸的同时,会产生超氧阴离子O2-从而导致对机体的氧化损伤,因此可以从超氧阴离子的产生效果间接来看小肽分子对XOD 的抑制性。
抗超氧阴离子自由基活力单位的公式:

3 种肽的抑制超氧阴离子的效果已经统计出,在稀释相同倍数的情况下,加入DEEIDN 后产生的抗超氧阴离子自由基单位最多。3 种多肽的抗自由基能力都低于标准品VC,但是对于空白组来说,可以减少超氧阴离子自由基对人体的损伤。3 种多肽的抗超氧阴离子自由基的能力 DEEIDN>EQEEY>DIDH,与上述3 种多肽的活性验证结果相一致,也与分子对接结果相一致。说明3 种多肽不仅对超氧阴离子自由基的产生有一定的抑制效果,而且对XOD 具有一定的抑制效果,成功筛选出了具有XOD 抑制性的活性肽。

表6 DIDH、EQEEY、DEEIDN 的超氧阴离子抑制效果Table 6 Inhibitory effect of DIDH,EQEEY,DEEIDN on superoxide anion
3 结论
本文通过线上虚拟酶解从鲈鱼肌球蛋白中分离出了多肽,并且对符合分子对接要求的多肽进行了ADMET 预测及分子对接打分,从中成功地筛选出对人体友好,且有抑制XOD 活性潜力的3种多肽。在对这3 种多肽进行活性验证后,发现了六肽DEEIDN 不仅具有良好的XOD 抑制率,半抑制浓度低于另外两种肽,并且可以有效地清除超氧阴离子自由基,减少黄嘌呤氧化酶反应过程中产生的活性氧对人体造成的氧化伤害,是一种有研究前景的XOD 抑制肽。
协同增效是功能性肽的一个发展趋势[35-36],因此,在筛选出XOD 抑制肽后,可以寻求其它有效成分与筛选出的多肽一起作用于XOD,使其抑制效果大于单一抑制剂对XOD 的抑制性是本试验下一步的目标。

