皂化处理对中华管鞭虾虾青素提取物的虾青素组成和体外抗氧化性的影响
贾 喆,张肖瑕,刘欣妍,许 艳,宋 茹
(浙江海洋大学食品与药学学院,浙江舟山 316022)
中华管鞭虾(Solenocera crassicornis)俗名红虾,外壳呈粉红色,广泛分布于我国黄海、南海及日本、印度尼西亚等海域,属于一年生底栖甲壳动物[1]。中华管鞭虾营养丰富、味甜鲜美,是我国重要的海捕虾、经济虾种类之一,大部分加工成虾仁出口。但是,中华管鞭虾在加工过程中产生30%~50%包括虾头、虾壳等在内的副产物同样含有大量的营养成分,而这些副产物目前主要被用作低值饲料原料,深加工利用还较少,未充分挖掘其中的经济价值[2]。
虾青素(astaxanthin,Asta)化学名称3,3´-二羟基-4,4´-二酮基-β,β´-胡萝卜素[3−5],是一种橙红色酮式类胡萝卜素。虾青素具有抗氧化、抗肿瘤、抗癌等多种生理功效[4−6],其抗氧化性比β-胡萝卜素及叶黄素强10 倍,比天然维生素E强100 倍[7−8]。因此,虾青素在食品添加剂、医药、化妆品等领域有着广泛应用。虾青素分子含有两个六元环结构,六元环上的羟基能够与脂肪酸结合形成虾青素脂肪酸酯(Astaxanthin esters),根据结合脂肪酸数量不同,又可以分为虾青素单酯(Astaxanthin monoesters)和虾青素双酯(Astaxanthin diesters)[9−10]。同时,由于六元环结构中两个手性中心的存在,可以使虾青素产生三种光学异构体,即左旋(3S,3´S)、内消旋(3S,3´R)和右旋(3R,3´R)[11−12]。虾青素可以用化学法合成,也可以直接从藻类、酵母和甲壳类动物中提取天然虾青素。化学合成虾青素的抗氧化活性远低于天然虾青素,如:自由基消除能力比天然虾青素低20 倍,淬灭单线态氧能力比天然虾青素低50 倍[13]。此外,化学合成的虾青素不可避免会有化学杂质残留问题,因此在食品中使用会受到一定程度限制[14−15]。
中华管鞭虾的虾青素提取物有显著的抗氧化活性,且以酯型虾青素为主[16−17]。因为游离型虾青素化学结构比酯型虾青素简单,所以易通过一些修饰改性技术制备天然虾青素高级产物[18−19]。虾青素酯类经皂化或酯酶水解转化为游离型虾青素,其中酶水解法所得副产物少,但是成本高。而皂化法需要严格控制皂化时间,否则虾青素会发生严重降解。Su等[20]报道采用低温皂化法将酯型虾青素转化为游离型虾青素,经低温皂化后的虾青素降解率低,且副产物生成量少。本研究以中华管鞭虾的虾壳为原料,采用低温皂化法转化虾青素提取物中酯型虾青素,系统研究皂化时间对虾青素总量、抗氧化活性、游离型和酯型虾青素相对含量和虾青素光学异构体组成影响,旨在为中华管鞭虾的虾青素综合应用奠定基础。
1 材料与方法
1.1 材料与仪器
新鲜中华管鞭虾 华润万家超市;人工合成虾青素标准品(3S,3´S:3S,3´R:3R,3´R=1:2:1)纯度>99%,德国Dr.Ehrenstorfer公司;1,1-二苯基-2-三硝基苯肼(DPPH)日本和光纯业株式会社;羟自由基测试盒、总抗氧化能力测试盒 南京建成生物工程研究所;二氯甲烷、甲醇、甲基叔丁基醚、乙腈 色谱纯,上海阿拉丁生化科技股份有限公司;其他试剂 分析纯,上海国药集团。
SSW-600-2S型电热恒温水槽 上海博讯实业有限公司医疗设备厂;UV-5900 型紫外可见分光光度计 上海源喜仪器有限公司;RE-2000A型旋转蒸发仪 上海亚荣生化仪器厂;SM800 型酶标仪 上海永创医疗器械有限公司;Agilent 1260 Infinity高效液相色谱仪 德国安捷伦科技有限公司。
1.2 实验方法
1.2.1 虾青素提取 参考文献[19]并适当修改,具体如下:新鲜中华管鞭虾取壳、破碎,按照1:5(m:v)比例加入无水乙醇,37 ℃水浴振荡提取1 h,然后6000×g离心10 min,收集上清液,沉淀重复提取2 次,合并上清液,旋转蒸发浓缩,按1:2(v:v)比例加入石油醚萃取3 次,收集石油醚层,经旋转蒸发浓缩后,避光冷冻干燥24 h,干燥物充氮气,−20 ℃保藏备用。
1.2.2 皂化处理 参考Su等[20]方法并适当修改,具体如下:虾青素提取物用无水乙醇复溶,按4:1(v:v)比例加入0.105 mol/L氢氧化钠-甲醇溶液,5 ℃水浴下分别皂化0、2、4、6、12 h,按1:2.5(v:v)加入去离子水终止反应。石油醚萃取皂化液3 次至基本无色,合并石油醚层,经旋转蒸发浓缩后,避光冷冻干燥24 h,干燥物充氮气,−20 ℃保藏备用。
1.2.3 虾青素浓度测定 采用齐宇等[21]分光光度法,将冻干的皂化和未皂化虾青素提取物用无水乙醇复溶后,经6000×g离心10 min,取上清液测定477 nm下吸光值(y),根据虾青素标准曲线y=0.0947x+0.0108(R2=0.9926)计算样品中虾青素浓度(μg/mL)。
1.2.4 游离型和酯型虾青素分析 参考Yuan等[22]方法,具体条件如下:采用ZORBAX SB-C18色谱柱(4.6 mm×250 mm,5 μm),柱温25 ℃,流动相A为二氯甲烷:甲醇:乙腈:水=5:85:5.5:4.5(v:v:v:v),流动相B为二氯甲烷:甲醇:乙腈:水=22:28:45.5:4.5(v:v:v:v),进样量10 μL,0~10 min用100%流动相A洗脱,10~20 min用0~100%流动相B线性洗脱,20~35 min用100%流动相B洗脱,35~45 min用100%~0 流动相B线性洗脱,流速1.0 mL/min,检测波长477 nm。虾青素标准品(游离型)(40 μg/mL)在上述条件下洗脱,提取物中游离型与酯型虾青素相对浓度按照公式(1)计算:

式中:C表示游离型、酯型虾青素相对浓度,μg/mL;S表示游离型或酯型虾青素总峰面积,mAU·s;S标准表示虾青素标准品总峰面积,mAU·s;C标准表示虾青素标准品浓度,μg/mL。
1.2.5 虾青素光学异构体分析 采用杨澍[23]高效液相色谱法分析,具体条件如下:采用Chiralpak IC色谱柱(4.6 mm×250 mm,5 μm),进样体积10 μL,甲基叔丁基醚(MBTE)/乙腈(95:5,v:v)为洗脱剂,流速1.0 mL/min,柱温35 ℃,检测波长477 nm。
人工合成虾青素标准品(3S,3´S:3S,3´R:3R,3´R=1:2:1)用无水乙醇溶解,制备50 μg/mL工作液,然后用无水乙醇依次稀释成40、30、20、10、5 μg/mL使用液,采用Chiralpak IC色谱柱分离,以各异构体的浓度(μg/mL)为横坐标(x),峰面积(y)为纵坐标,将3S,3´S、3S,3´R和3R,3´R虾青素异构体的浓度和峰面积进行拟合,得到三种光学异构体回归方程,结果见表1。

表1 虾青素三种光学异构体回归方程Table 1 Standard curves of three Asta optical isomers
1.2.6 体外抗氧化性分析
1.2.6.1 清除DPPH自由基能力 参照Bersuder等[24]方法进行:将皂化(0~12 h)虾青素提取物、无水乙醇和0.02%DPPH乙醇液,按1:4:1(v:v:v)混合,室温下避光放置60 min,无水乙醇调零,测定517 nm处吸光值(A样品),样品对DPPH自由基清除率按照公式(2)计算:

式中:A对照用等体积无水乙醇代替样品,A样品空白用等体积无水乙醇代替0.02%DPPH乙醇液。
1.2.6.2 羟自由基清除能力及总抗氧化能力 使用羟自由基测试盒和总抗氧化能力测试盒测定,结果以U/μg虾青素表示。
1.3 数据统计与分析
使用Origin 2018 软件绘制图形,结果以平均值±标准差(n=3)表示。采用SPSS19.0 软件对组间差异性进行分析,P<0.05 表示差异显著。
2 结果与讨论
2.1 皂化时间对虾青素浓度影响
由图1 可知,中华管鞭虾的虾青素提取物在477 nm处有最大吸收峰,皂化处理可以提高提取物的虾青素浓度,其中皂化2 和4 h时,总虾青素浓度分别达到8.71 和8.79 μg/mL,显著高于未皂化的虾青素浓度(P<0.05)。当皂化超过6 h时,总虾青素浓度开始显著下降(P<0.05),其中皂化12 h时,总虾青素浓度降至4.66 μg/mL。图1A光谱扫描结果显示虾青素提取物除了在477 nm有虾青素特征吸收峰外,在280 nm附近吸收峰明显,说明提取物中含有大量蛋白质和肽类物质。虾蟹壳中虾青素通常与蛋白质结合在一起,活体虾蟹壳表现为蓝紫或青绿色[25]。图1B中皂化2 和4 h时,提取物中总虾青素浓度显著高于未皂化的虾青素(P<0.05),推测与皂化条件下虾青素结合蛋白质发生水解,释放出来的虾青素导致提取物中总虾青素浓度增加有关。但是,当皂化时间过长时,虾青素会发生不同程度的降解,结果导致提取物中总虾青素浓度降低。Su等[20]报道了低温皂化处理会导致半虾红素、虾红素及其它降解产物生成量增加,结果造成总虾青素浓度降低。本研究采用分光光度法测定不同皂化时间下总虾青素浓度变化,虽然未进一步检测皂化物中虾青素降解物的含量变化,但是从图1B也能够看出当皂化时间过长时,总虾青素浓度急剧降低。
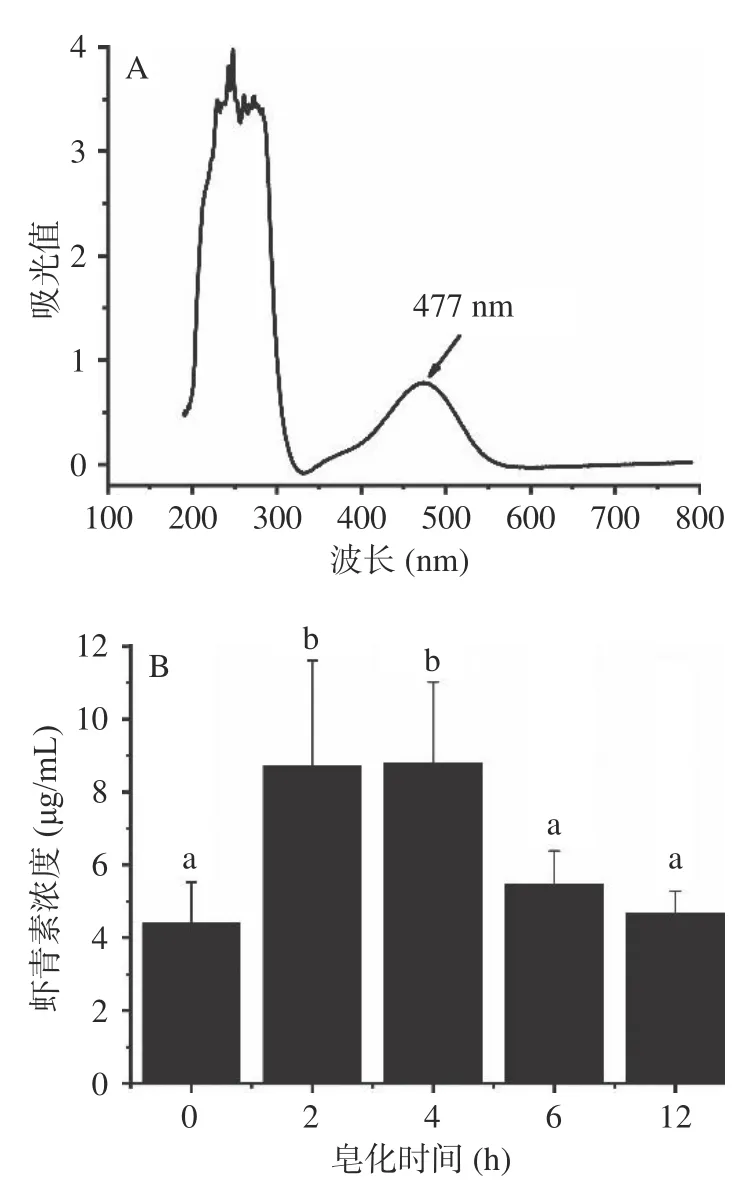
图1 虾青素提取物紫外可见光谱扫描及皂化时间对总虾青素浓度影响Fig.1 UV-visible full wavelength scan of Asta extracts and effect of saponification time on the total concentration of Asta
2.2 皂化时间对虾青素体外抗氧化活性影响
不同皂化时间下,虾青素提取物的DPPH自由基清除率、羟自由基清除能力和总抗氧化性变化如图2 所示。图2A中,皂化2 h时,虾青素提取物对DPPH自由基的清除率最高达到25.85%,显著高于未皂化的15.16%(P<0.05)。随着皂化时间的延长,虾青素提取物清除DPPH自由基能力开始急剧下降,其中皂化6 h和12 h时虾青素提取物对DPPH自由基清除率仅为5.75%和1.81%。同样,皂化时间对虾青素提取物的羟自由基清除能力和总氧化性也有显著性影响,但是与DPPH自由基清除率呈现不同的变化规律。图2B中随着皂化时间的延长,虾青素提取物对羟自由基的清除效果呈上升趋势,其中皂化4~12 h时羟自由基清除能力无统计学上差异(P>0.05),皂化6 h时清除效果最强,为3.17 U/μg。而图2C中虾青素在皂化6 h时,总抗氧化能力最高达到0.62 U/μg,之后皂化时间延长至12 h时,总抗氧化能力急剧降低至0.133 U/μg。图2 结果进一步说明不同皂化时间下,虾青素提取物的抗氧化性发生变化,但是与总虾青素浓度变化(图1B)并未表现出完全的一致性,如:经6 和12 h皂化,虾青素提取物的总虾青素浓度低于皂化2 和4 h的虾青素浓度,同样皂化6 和12 h的虾青素提取物对DPPH自由基清除率显著低于其他皂化时间下的DPPH自由基清除率(P<0.05)。皂化4~12 h时,提取物的总虾青素浓度表现出差异性(图1B),但是对羟自由基清除能力无统计学上差异(P>0.05)。因此,本研究进一步分析了不同皂化时间下虾青素提取物中游离型和酯型虾青素相对浓度变化。

图2 不同皂化时间下虾青素提取物的抗氧化能力比较Fig.2 Comparison of antioxidant activities of Asta extracts after saponification for different time
2.3 皂化时间对游离型和酯型虾青素的影响
采用高效液相色谱分离法可以直观看出酯型虾青素转化为游离型虾青素程度[22],中华管鞭虾的虾青素提取物经过不同时间皂化后虾青素的分布变化如图3 所示。虾青素酯化后疏水性增强,而双酯又强于单酯,因此HPLC采用C18柱分析检测虾青素时,依次洗脱下来游离型虾青素、虾青素单酯、虾青素双酯[26]。通过对比标准品及参考文献[17]确定未皂化的中华管鞭虾的虾青素提取物中含有游离型虾青素(其中峰1~3 分别为全反式虾青素、9-顺异构体、13-顺异构体)和酯型虾青素。随着皂化的进行,虾青素提取物中游离型虾青素中的全反式、9-顺式和13-顺式峰值增加明显,当皂化6 h时,虾青素提取物中的酯型虾青素峰明显减少,至皂化12 h时完全消失。图3 结果表明经过6~12 h皂化处理,虾青素提取物中酯型虾青素基本完全转为游离型虾青素。
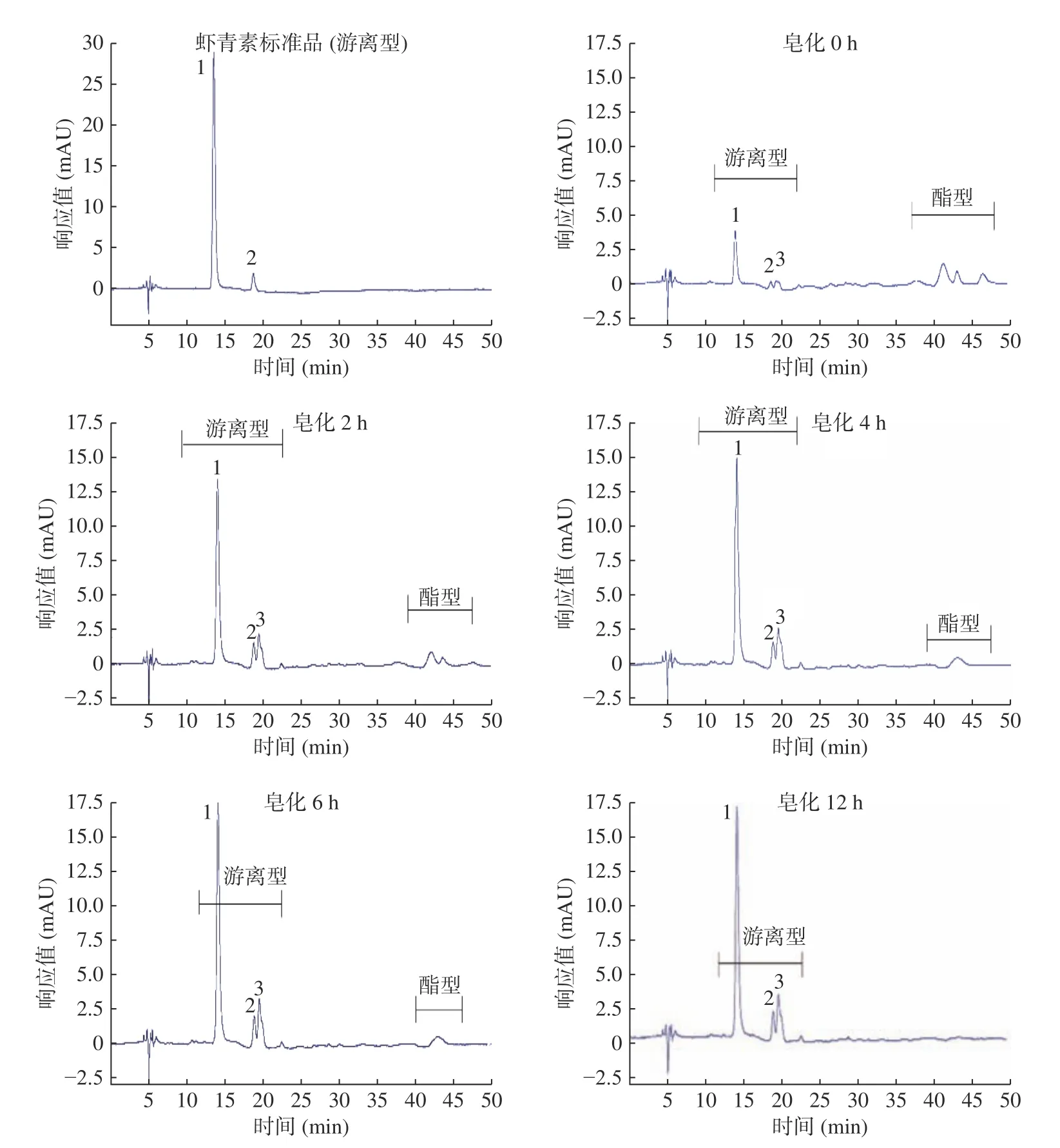
图3 不同皂化时间下虾青素提取物中游离型和酯型虾青素分布情况Fig.3 Distribution of free Asta and Asta esters in the Asta extracts after saponification for different time
由图4 可知,未皂化中华管鞭虾的虾青素提取物中酯型虾青素相对浓度显著高于游离型虾青素(P<0.05)。经过皂化后,酯型虾青素转化为游离型虾青素效果显著,其中皂化2 h时游离型虾青素相对浓度由皂化前的8.14 μg/mL增至27.11 μg/mL,而酯型虾青素则由10.20 μg/mL降至5.60 μg/mL(P<0.05)。当皂化时间大于6 h,游离型虾青素的相对浓度趋于稳定,保持在34 μg/mL左右。提取物中的酯型虾青素在皂化12 h时基本水解完全,但皂化物中游离型虾青素相对浓度无显著性增加(P>0.05),应与长时间皂化处理游离型虾青素发生部分降解有关。因此,要合理控制皂化时间。
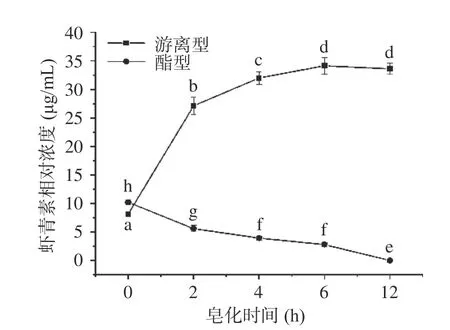
图4 不同皂化时间下虾青素提取物中游离型和酯型虾青素相对浓度比较Fig.4 Comparison of relative concentration of free Asta and Asta esters in the Asta extracts after saponification for different time
2.4 皂化时间对虾青素光学异构体浓度影响
人工合成虾青素是三种光学异构体的混合物(3S,3´S:3S,3´R:3R,3´R=1:2:1)[27],在 Chiralpak IC手性柱上洗脱顺序为3S,3´S、3S,3´R、3R,3´R[23]。自然界不同生物体的虾青素光学异构体组成存在明显差异,如:雨生红球藻主要为3S,3´S型[28],红发夫酵母中虾青素光学异构体主要是3R,3´R型[29],三文鱼中虾青素光学异构体以3S,3´S为主[30],甲壳动物对虾和螃蟹则是存在较为独特的3S,3´S/3S,3´R/3R,3´R异构体混合物[29]。从图5 结果可以看出:未皂化的中华管鞭虾的虾青素提取物中含有上述三种光学异构体,并且以3S,3´S和3S,3´R为主。当皂化2 h时,三种光学异构体的峰高及峰面积增加明显,说明虾青素脱酯及脱蛋白后有助于三种光学异构体含量增加。
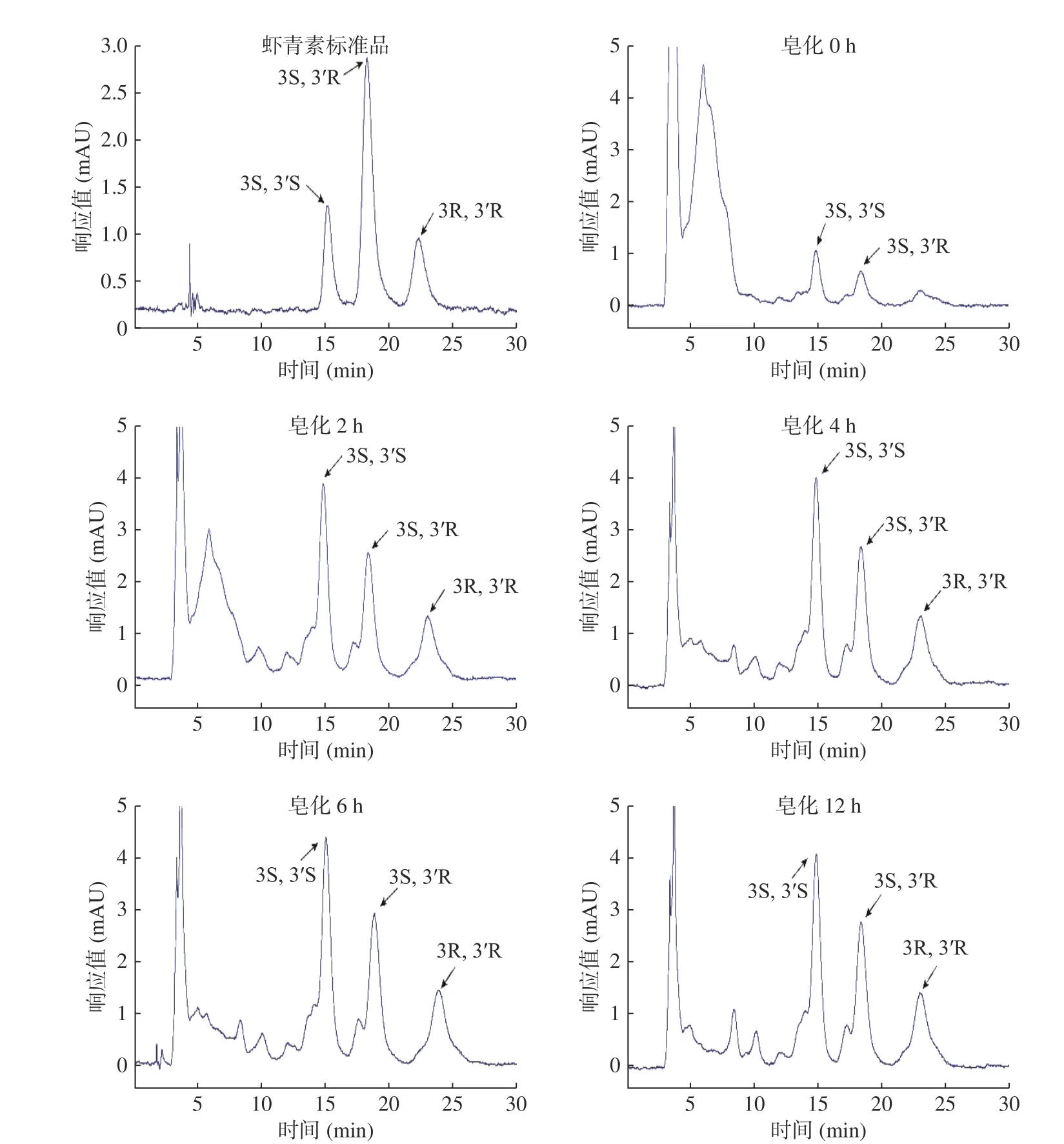
图5 不同皂化时间虾青素提取物中光学异构体分布比较Fig.5 Distribution comparisons of three Asta optical isomers in the Asta extracts after saponification for different time
进一步分析了不同皂化时间下,虾青素提取物中三种光学异构体的浓度和相对含量变化,结果见图6,其中,图6A为三种光学异构体浓度随时间变化关系,图6B为不同皂化时间下三种光学异构体相对含量变化。从图6A可知,皂化处理后虾青素提取物中三种光学异构体浓度增加显著,皂化2 h时3S,3´S浓度由未皂化的2.41 μg/mL增加到13.83 μg/mL,3R,3´R也从低于检出限增至5.66 μg/mL。皂化时间大于2 h,三种光学异构体的浓度并未随着皂化时间的延长而快速增加。皂化至12 h时,3S,3´S、3S,3´R和3R,3´R浓度依次为16.65、12.47和8.63 μg/mL,与皂化2 h时相比仍有显著性提高(P<0.05)。进一步比较了三种光学异构体间比例组成发现(图6B):皂化2 h时,3S,3´S、3S,3´R和3R,3´R的相对含量分别为49.27%±2.98%、30.54%±0.24%和20.19%±4.53%,即:3S,3´S:3S,3´R:3R,3´R的相对含量比为2.4:1.5:1.0。而皂化12 h时,3S,3´S:3S,3´R:3R,3´R相对含量比为2.4:1.7:1.0,表明皂化过程中游离型虾青素三种光学异构体间的相对含量比较为稳定,并未随着皂化时间的变化而发生明显变化。
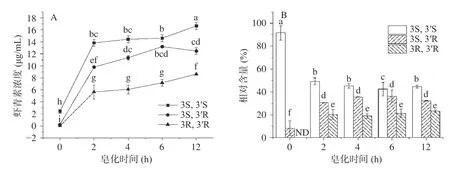
图6 不同皂化时间虾青素提取物中光学异构体的浓度及相对含量比较Fig.6 Comparisons of Asta optical isomers concentrations and relative contents in the Asta extracts after saponification for different time
2.5 不同皂化时间下提取物中光学异构体浓度与抗氧化能力相关性分析
虾青素提取物经过皂化,总虾青素浓度、体外抗氧化能力及虾青素组成均发生了改变(见图1~图6)。据报道虾青素的三种光学异构体表现出不同的抗氧化能力[31−32],所以实验进一步研究了皂化处理后,提取物中虾青素3S,3´S、3S,3´R和3R,3´R三种光学异构体浓度与羟自由基清除能力关系,结果见图7。
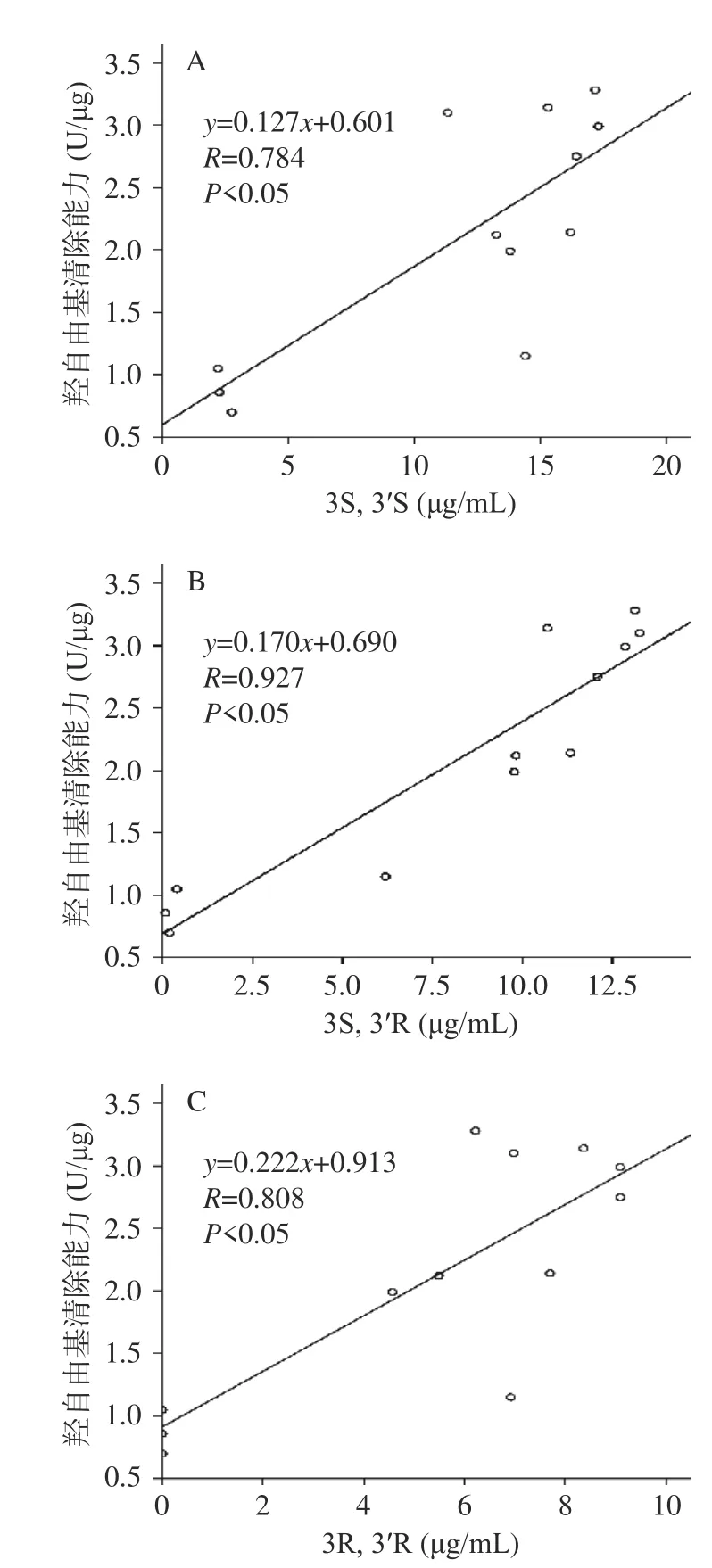
图7 不同皂化时间下虾青素提取物中三种光学异构体浓度与羟自由基清除能力关系Fig.7 Relationships between the three Asta optical isomers concentrations and scavenging hydroxyl radicals of the Asta extracts after saponification for different time
图7 结果表明,不同皂化时间下,虾青素提取物的羟自由基清除能力与三种光学异构体浓度有较为显著的线性相关性(P<0.05),说明虾青素提取物的羟自由基清除能力与三种光学异构体有明显的剂量依赖性。当清除羟自由基能力相近时,所需光学异构体浓度越低,表示该异构体的抗氧化能力越强,可以看出虾青素提取物中虾青素光学异构体对羟自由基清除能力依次为:3R,3´R>3S,3´R>3S,3´S,即:皂化后中华管鞭虾的虾青素提取物中3R,3´R羟自由基清除能力强于另外两种光学异构体。张瑞莲[32]报道虾青素三种光学异构体抑制亚油酸自动氧化的能力为3S,3´S=3R,3´R>3S,3´R,说明不同来源的虾青素光学异构体在不同抗氧化评价体系中会表现出不同的抗氧化能力。一般来讲,外消旋型虾青素(3S,3´S和3R,3´R)的抗氧化活性强于内消旋型(3S,3´R)[27],而本研究中虾青素内消旋体3S,3´R也表现出较强的羟自由基清除能力,推测可能与皂化物中三种光学异构体之间的相互协同作用有关,具体还需后续实验深入研究。
3 结论
中华管鞭虾的虾青素提取物经适当皂化处理,可以明显提高虾青素浓度及体外抗氧化活性,其中皂化2~4 h,总虾青素浓度在8.70 μg/mL左右,DPPH自由基清除能力在皂化2 h达到25.85%,而皂化6 h时虾青素提取物的羟自由基和总抗氧化能力分别达到3.17 和0.62 U/μg。HPLC分析结果表明皂化前2 h时,酯型虾青素快速转化为游离型虾青素,且3S,3´S、3S,3´R和3R,3´R三种光学异构体生成速率高。中华管鞭虾的虾青素的光学异构体以3S,3´S型为主,不同皂化时间下虾青素提取物中3S,3´S:3S,3´R:3R,3´R的相对含量比保持在2.4:1.5~1.7:1.0 之间。研究发现中华管鞭虾的虾青素提取物中的三种光学异构体与羟自由基清除表现出较强的线性相关性,且3R,3´R清除羟自由基能力最强。皂化后虾青素各异构体间相互作用,以及与生物活性关联性有待于进一步研究。
——基于正交试验优化的皂化反应法△

