A型核纤层蛋白编码基因LMNA调控IOP1表达机制的初步研究*
孔令粤,刘佳鑫,郭 放,郭 涛,冯安妮,赵仕滔,黄浚炜,刘新光,赵 炜△
1.广东医科大学衰老研究所,广东东莞 523808;2.广东省医学分子诊断重点实验室,广东东莞 523808;3.广东医科大学第二临床医学院,广东东莞 523808;4.广东医科大学医学技术学院,广东东莞 523808;5.广东医科大学基础医学院,广东东莞 523808
早老症(HGPS)是由于A型核纤层蛋白的编码基因(LMNA)发生突变[1-3],产生异常剪接的蛋白(早老素),在细胞核内堆积引发的具有早老特征的疾病[4]。研究发现,使用自噬诱导剂蛋白酶体抑制剂(MG132)处理HGPS患者的成纤维细胞,可以有效改善细胞的早老表型[5],暗示LMNA基因和细胞自噬之间存在一定的联系,但是具体调控机制尚不清楚。人的唯铁脱氢酶编码基因1(IOP1)是一种铁硫蛋白,主要参与细胞质和细胞核中铁硫蛋白的合成[6]。本课题组在前期研究中发现LMNA和IOP1之间可能存在相互调控关系,本研究着重探讨两者之间,特别是它们在细胞自噬中潜在的调控机制,希望为HGPS的治疗提供借鉴。现报道如下。
1 材料与方法
1.1主要材料 人胚胎肾细胞(HEK293T)为本实验室保存。胎牛血清(FBS)、高糖DMEM培养基、Lipofectamine RNAiMAX、IOP1-siRNA (ID:HSS148890)、LMNA-siRNA (ID:HSS106094)及50 nmol/L阴性对照NC-siRNA (12935400)均购自美国Thermo Fisher Scientific公司。cDNA合成试剂盒(PrimeScriptTMRT reagent Kit with gDNA Eraser) 购自日本Takara公司。RIPA裂解液、PMSF、 5×Loading Buffer 均购自中国碧云天生物技术有限公司。TGX Stain-Free FastCast Acrylamide试剂盒购自美国Bio-Rad公司,0.2 μmol/L PVDF膜购自德国Merck Millipore公司,牛血清清蛋白(BSA)购自生工生物工程(上海)股份有限公司,AP标记二抗购自美国Proteintech公司,NBT/BCIP购自美国Sigma公司。IOP1抗体、Lamin A/C抗体、LC3BⅠ抗体、LC3BⅡ抗体、FOXO3a抗体、p62抗体、ATG5、ATG12抗体、GAPDH抗体均购自美国CST公司。荧光定量PCR仪型号为LightCycler 480,购自瑞士罗氏公司。
1.2方法
1.2.1细胞培养 HEK293T在37 ℃,5% CO2培养箱中用含10% FBS的高糖DMEM培养基培养。
1.2.2siRNA干扰实验 将HEK293T接种于6孔板中,当细胞密度达到30%~50%时进行转染。用Lipofectamine RNAiMAX转染终浓度为50 nmol/L 的IOP1-siRNA、LMNA-siRNA及50 nmol/L阴性对照NC-siRNA。用于提取总RNA的细胞在转染后48 h收集,用于提取总蛋白的细胞在转染后96 h收集。
1.2.3荧光定量PCR 采用两步法进行荧光定量PCR,先使用Trizol法提取细胞总RNA,按照cDNA合成试剂盒(PrimeScriptTMRT reagent Kit with gDNA Eraser)的操作说明,取1 μg RNA用于反转录合成cDNA,然后采用SYBR Green法在LightCycler 480仪器上进行荧光定量PCR。IOP1基因的定量引物序列为5′-GAA AAA AGG GCG GGA AGT GPC R-3′和5′-GCT CCC GTC ATC TTC AAT GC-3′,LMNA基因的定量引物序列为5′-TGG ACG AGT ACC AGG AGC TT-3′和5′-ACT CCA GTT TGC GCT TTT TG-3′,内参基因GAPDH的定量引物序列为5′-TGC ACC ACC AAC TGC TTA GC-3′和5′-GGC ATG GAC TGT GGT CAT GAG-3′。反应条件为:95 ℃ 1 min预变性;95 ℃ 5 s变性,55 ℃ 30 s退火,72 ℃ 30 s延伸;循环数40次。
1.2.4Western Blotting 收集细胞后,加入RIPA裂解液及PMSF,冰上裂解30 min,加入5×Loading Buffer,100 ℃水浴10 min。使用TGX Stain-Free FastCast Acrylamide试剂盒配制12% PAGE胶,电泳后将蛋白质转移到0.2 μmol/L PVDF膜,3% BSA室温封闭1 h后,加入一抗,4 ℃孵育过夜,1×TBST漂洗3次后,加入AP标记的对应二抗,室温孵育1 h。通过NBT/BCIP法显色。
1.3统计学处理 采用SPSS19.0软件进行统计学分析。两组间比较采用t检验进行分析。以P<0.05为差异有统计学意义。
2 结 果
2.1在HEK293T中干扰LMNA的表达对IOP1和细胞自噬的影响 有文献报道在小鼠中敲除LMNA基因后,细胞自噬的标志物之一LC3BⅡ/LC3BⅠ的比例上调[7]。为了在细胞水平研究LMNA与自噬的关系,本文在HEK293T中转染靶向LMNA基因的siRNA,进而检测LC3BⅡ/LC3BⅠ的表达水平。荧光定量PCR分析结果见图1A,与NC对照组相比,在转染了靶向LMNA基因siRNA的实验组中,LMNA的mRNA干扰效率达到85%。LMNA蛋白水平明显下调,见图1B。
本文进一步通过Western Blotting检测LC3BⅡ/LC3BⅠ的相对比例(图1B),结果显示,与NC对照组相比,LC3BⅡ/LC3BⅠ的比例上调,表明在HEK293T中下调LMNA基因的表达水平,可以上调细胞的自噬水平。转染了靶向LMNA基因的siRNA的HEK293T中,IOP1的mRNA转录水平和蛋白水平都明显下调,这表明LMNA基因、IOP1基因和自噬之间可能存在调控关系。

注:与NC对照组比较,*P<0.05。
2.2在HEK293T中干扰IOP1的表达对LMNA基因的影响 鉴于在HEK293T中干扰LMNA基因的表达,IOP1基因的mRNA转录水平和蛋白水平都明显下调,本文在HEK293T中转染靶向IOP1基因的siRNA,进而检测LMNA基因的表达水平。与NC对照组相比,在转染了靶向IOP1的siRNA的实验组中,IOP1基因的mRNA(图2A)和蛋白水平明显下调,见图2B。然而,LMNA基因的mRNA和蛋白水平都没有明显改变。结果表明,在HEK293T中干扰IOP1基因的表达不影响LMNA基因的表达水平。

注:与NC对照组比较,*P<0.05。
2.3在HEK293T中干扰IOP1基因的表达对细胞自噬的影响 为了进一步研究LMNA基因、IOP1基因和自噬之间潜在的调控关系,本文在转染了靶向IOP1基因siRNA的HEK293T中(IOP1基因的表达水平被证实下调,图3A),通过Western Blotting检测多个细胞自噬的标志物:LC3BⅡ/LC3BⅠ、p62、ATG5-ATG12复合体、ATG5和ATG12。结果显示(图3B),LC3BⅡ/LC3BⅠ蛋白比值升高,FOXO3a、ATG5、ATG12、ATG5-ATG12复合体蛋白水平升高,p62蛋白水平略有降低,暗示细胞的自噬水平上升。
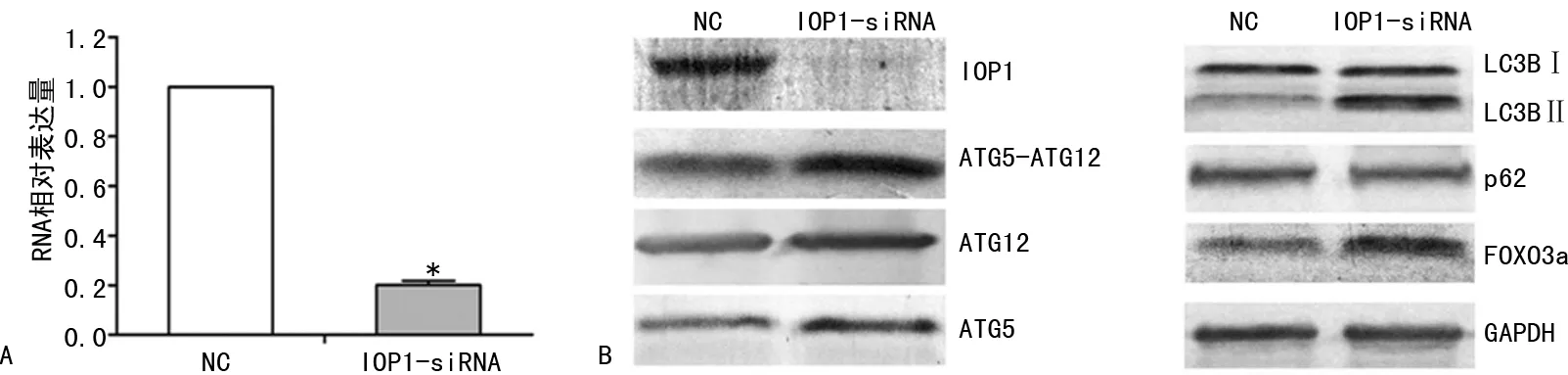
注:与NC对照组比较,*P<0.05。
3 讨 论
铁硫蛋白是以铁原子和硫原子组成的铁硫簇为辅基的一大类蛋白,参与众多生理过程,如细胞代谢、呼吸链电子传递、DNA合成修复以及基因表达调控等[8]。有研究报道,在人乳腺癌细胞和小鼠细胞中沉默铁硫蛋白NAF-1的表达,可以激活自噬[9];铁硫蛋白NEET蛋白参与信号传导、凋亡、自噬等多种细胞活动[10]。这些研究提示,铁硫蛋白很可能在细胞自噬中起着重要作用。但是,IOP1基因作为铁硫蛋白家族中的一员,是否参与调控调细胞自噬,鲜见相关报道。
有研究报道,在二倍体酿酒酵母中缺失NAR1基因(人类IOP1基因在酵母中的同源基因) 的一个拷贝,会明显缩短酵母的复制性寿命,表明NAR1及其人类同源基因IOP1基因很可能在细胞衰老中起重要作用[11]。另外,IOP1基因的另一个人类同源基因IOP2(也叫NARF)能与A型核纤层蛋白前体相互结合[12],LMNA基因突变会导致以HGPS为代表的一系列核纤层蛋白疾病。研究发现,核纤层蛋白病的细胞样本中都存在细胞自噬受损现象,使用mTOR药物抑制剂(可以激活自噬)处理后可以有效缓解细胞病理的相关表型[5]。
本文在HEK293T中转染靶向LMNA基因的siRNA之后,细胞自噬的标志物之一LC3BⅡ/LC3BⅠ蛋白比值上调,同时,IOP1的mRNA转录水平和蛋白水平都明显下调,这表明下调LMNA基因的表达,可以有效降低IOP1基因的表达水平,反之,下调IOP1基因的表达,不会影响LMNA基因的表达水平。这表明LMNA基因对IOP1基因存在单向的调控关系。
为了进一步探讨IOP1基因是否也参与调控细胞自噬,本研究在HEK293T中转染靶向IOP1基因的siRNA,直接降低IOP1基因的表达水平,进而检测自噬标志物的表达情况。结果显示,LC3BⅡ/LC3BⅠ蛋白比值、FOXO3a、ATG5、ATG12、ATG5-ATG12复合体蛋白水平升高,p62蛋白水平略有降低。
在哺乳动物细胞中,LC3蛋白可以被ATG4剪切形成LC3-Ⅰ,诱导自噬后,LC3-Ⅰ通过ATG7、ATG3和ATG12-ATG5-ATG16L多聚体与高亲脂性磷脂酰乙醇胺(PE)部分结合,转变为(自噬体)膜型LC3(即LC3-Ⅱ)。因此,LC3BⅡ/LC3BⅠ蛋白比值越大,提示自噬水平越高。p62是LC3-Ⅱ的自噬底物蛋白,与LC3Ⅱ呈负相关关系[13]。
FOXO3a是FOXO转录因子家族成员之一,在细胞衰老、凋亡、自噬中起着重要作用。研究发现,FOXO3A可以直接与自噬相关基因的启动子,例如LC3B、ATG12结合,进而激活细胞自噬,减缓环境压力对细胞的毒害作用[14-16]。
综合这些细胞自噬标志物的检测结果,本文推测在HEK293T中干扰LMNA基因的表达后,可能通过下调IOP1基因的表达,进而上调转录因子FOXO3a的表达水平,最终导致自噬相关基因的表达。
综上所述,在HEK293T中LMNA基因可以调控IOP1基因的表达,进而参与调控细胞自噬过程。而LMNA基因通过何种途径调控IOP1基因的表达,是直接调控,还是通过其他信号通路间接调控,相关的分子机制尚需要更深入的研究。

