液相悬浮阵列芯片在检验医学中的应用进展*
李 敏,豆小文,熊 丹 综述,张秀明△ 审校
1.安徽理工大学医学院,安徽淮南 232000;2.深圳市罗湖医院集团医学检验实验室/深圳大学第三附属医院医学检验科,广东深圳 518001
随着疾病精准诊疗需求提升,对于疑难性疾病,单一指标往往无法实现疾病的精准诊断,多指标联合检测早已成为临床检验的常态。蛋白或基因芯片的产生为快速、准确、高效的临床诊断、治疗和预后监测提供了重要的技术手段。液相悬浮阵列芯片作为其中之一,已广泛应用于微生物鉴定[1]、肿瘤标志物检查[2]、药物筛选[3-5]等领域。
20世纪90年代后期,液相悬浮阵列芯片技术作为后基因组新兴分子生物学检测芯片技术逐渐发展起来[6-8],其是集基因芯片、流式细胞技术、激光分析以及数字信号处理等于一体的新技术。将小分子物质(如抗体、抗原、核酸探针等)致密地排列于特定载体微球(表面有不同的基团修饰,如羧基、羟基、生物素、链霉亲和素等)上,利用分子间特异亲和反应,实现对基因、配体、抗原等活性物质分析,从而达到多元检测生物活性物质(超1 100种)或诊断多种疾病的目的。即可该技术的优势在于所需样本量仅微量足矣(10~50 μL)、适用样本种类多且可同时定量多靶标等[9-10]。液相悬浮阵列芯片技术的首个商品化产品——灵活的多组分分析分子诊断技术平台(xMAP)由美国Luminex公司研制成功,并通过了美国食品与药物管理局(FDA)认证,于2005年度荣获国际临床诊断技术革新奖[11]。随着该技术的发展,其已呈现出广泛的临床检测应用前景。
1 液相悬浮阵列芯片技术原理
液相悬浮阵列芯片技术是基于xMAP技术和xTAG技术(二者均属于Luminex公司),核心采用载体编码微球对待检测目标物进行识别,载体编码微球材料主要为聚苯乙烯、光子晶体等,微球直径一般5.6 μm,表面标记不同荧光染料。
xMAP技术核心是将聚苯乙烯微球用不同比例的橙色和红色荧光染料染色,根据二者荧光的比例不同可染成不同浓度的微球,还可添加第3种荧光染料,增加荧光编码微球的数量。不同荧光编码微球上共价偶联相应的探针,混合在同一体系,再加入待测样本。在液相悬浮溶液中,待测物质被荧光编码微球上的探针识别并结合,结合了待测物质的荧光编码微球一一排成单列被鞘液传送系统传送,依次被红色和绿色激光激发。红色激光用来激发荧光编码微球本身的荧光,来识别微球的种类;绿色激光则用来激发报告分子携带的荧光,通过荧光强度实现待测物的定量分析[11]。xTAG是xMAP 技术的延伸,应用了Luminex专用的通用标签,利用标签和反标签序列的互补配对对核酸试验优化改进。运用PCR技术扩增待检测物质的核酸,其产物与TAG引物混合,若存在目标核酸,则目标引物延伸并掺加入标记物,然后将带有反TAG序列的微球加入反应体系中,微球通过专一的互补配对来识别目标引物。检测鞘液系统中目标引物标记的荧光信号即可获得分析结果[8]。随着微球编码技术、解读编码微球设备及编码微球制备工艺改进,新型液相悬浮阵列芯片技术已在临床检验应用领域发挥了愈加重要的作用。
2 微球编码技术类型
编码微球作为液相悬浮阵列芯片技术关键元件之一,目前以Luminex公司和BD公司的cytometric珠阵列系统[12]等商业化有机荧光染料编码微球为主。此类微球应用范围最为广泛,但存在一些缺陷:(1)有机荧光染料发射光谱易与常用定量标记物发生干扰[13-14],前者往往具有较宽的发射光谱;(2)有机荧光染料吸收光谱比较窄,检测中需多束激光激发,成本较高[15];(3)有机荧光染料易发生光漂白,不利于临床应用。为了弥补有机荧光编码微球的不足,越来越多的学者不断研发出各种功能性纳米颗粒编码微球。
2.1上转换荧光纳米材料编码微球 稀土掺杂上转换荧光纳米编码微球是采用络合共沉淀法、溶剂热法或热分解法掺杂Yb3+-Er3+、Yb3-Tm3+离子的β-NaYF4合成的编码微球,可以在低能量下实现反Stokes发光,并在二极管近红激光器激发下发出可见光(半高宽多发射峰小)[16-17]。相比于有机荧光染料,上转换纳米材料具有耐光漂白、低毒性等优点,因此上转换荧光纳米颗粒更适合用来编码荧光微粒[18-20]。上转换纳米颗粒的多色发光是其待克服难题之一,有学者研究单发射峰上转换纳米材料可克服其劣势,为该编码材料临床应用提供了可能[21-24]。
2.2量子点(QDs)编码荧光微球 QDs又称半导体纳米颗粒,具有独特光学特性:(1)同一激光可激发不同粒径QDs,具有较宽激发光谱;(2)改变QDs形状和化学组成可调节其发射光谱分布于整个可见光区;(3)具有较大Stokes位移,避免激发和发射光谱的信号重叠;(4)QDs效率高、荧光寿命长、生物相容性强等。QDs的编码数量可利用公式实现多色编码[25]。与有机荧光染料相比,虽然二者均采用短波长激发光,在检测过程中产生较强背景噪声,但QDs荧光寿命较长,故QDs编码微球可通过时间分辨免疫与因短波激光产生的强背景干扰分开,实现高灵敏检测的目的。
2.3荧光寿命编码微球 荧光寿命是荧光染料的内参数[26],将不同荧光寿命的靶向QDs混合,通过改变其组成比例,可获得不同荧光寿命编码微球,其编码信息量大,是液相悬浮阵列芯片实现多元和特定分析的优异载体。由于流式细胞仪鞘液系统所需激光器一般3个以上,采用多元荧光寿命编码微球检测成本高,如何降低该载体的应用成本是未来需解决的核心问题。
2.4表面增强拉曼散射光谱(SERS)编码微球 SERS由吸附于粗糙贵金属Au、Ag、Cu等表面上吡啶分子实现液相体系中拉曼散射信号约6个数量级以上的信号增强[12,27],已广泛应用于生物传感器和生物成像等技术。SERS具有以下优势:(1)拉曼谱带线宽极窄(约1 nm),具有较强编码能力;(2)灵敏度高,可以对单分子进行检测;(3)拉曼散射寿命短,防止了其能量转移、光褪色等,信号稳定性好;(4)所需激发光波长范围宽。值得注意的是,在液相悬浮阵列芯片系统中,SERS信号易与荧光信号重叠,因此需谨慎选择适宜的荧光标记分子和拉曼分子。
2.5结构色编码微球 通过纳米粒子有序组装结构对光的反射和干涉,产生的一系列结构色的光子晶体(即电解质周期性排列结构),也可作为编码微球载体。光子晶体材料的结构周期性和折射率决定反射光的波长。由布拉格方程可知,光子晶体材料的颜色不易被漂白,且可调节。相比荧光编码微球,结构色编码微球(光子晶体)具有较好的稳定性和极低的检测成本,在临床疾病的诊断中有着强大的市场竞争力。
3 液相悬浮阵列芯片在临床检测中的应用研究
3.1病原体检测 随着新型分子生物学技术发展,荧光定量PCR、基因芯片、液相悬浮阵列芯片技术等已广泛应用于病原体感染监测,见表1。液相悬浮阵列芯片可通过一次筛查即可实现快速、高效、特异、灵敏的多种病原体鉴别诊断,为临床精准医疗决策提供可靠指导。
WANG等[25]基于新城疫病毒(NDV)蛋白和禽流感病毒(AIV)核蛋白包覆纳米磁珠,采用1∶200最佳血清稀释比建立双相xMAP法,实现同时检测NDV和AIV抗体,相比酶联免疫吸附试验(ELISA)灵敏度分别提高16和1 024倍。MARTIEZ-VENDRELL等[28]构建qSAT multiplex面板检测全血、血浆中恶性疟原虫富组氨酸蛋白2(PfHRP2)和疟原虫乳酸脱氢酶(pLDH),所测PfHRP2和pLDH结果与定量PCR和显微镜测定的寄生虫密度呈正相关关系,表明该法可预测寄生虫密度。液相悬浮阵列芯片技术不仅可定量检测病原体的抗原、抗体和核酸,还可定性鉴定病原体的血清分型。见表1。
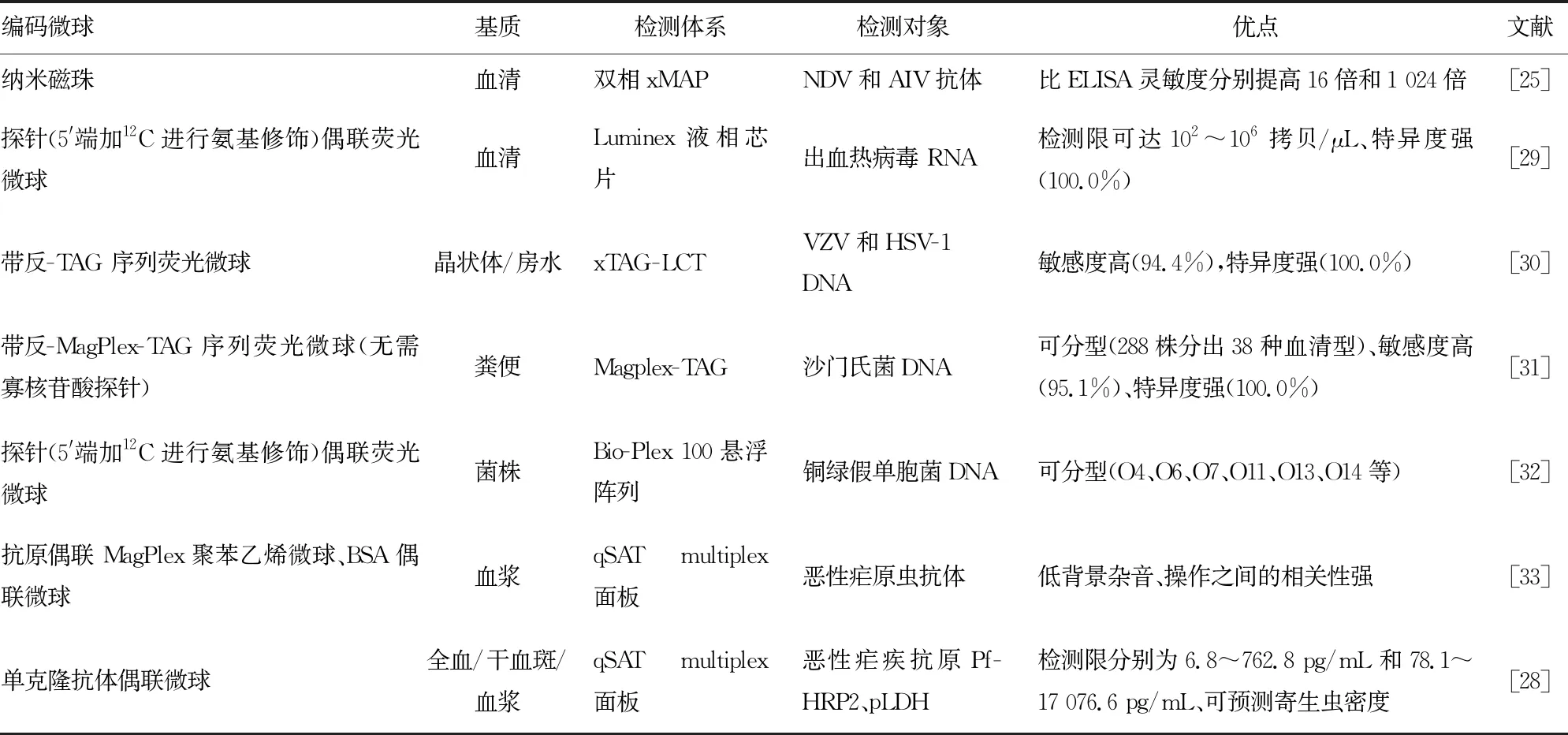
表1 液相悬浮阵列芯片技术在病原体检测中的应用
3.2自身免疫疾病标志物检测 自身免疫性疾病在机体细胞受疾病刺激下可合成分泌具有生物学活性的小分子物质如抗核抗体谱、糖尿病谱、自免肝谱等,是疾病发生、进展和预后的良好指标,其检测主要依赖ELISA、化学发光法,但这2种方法无法解决医院多项目通量难题,当单项目标本量较小时,存在开瓶稳定性和试剂浪费问题,悬浮阵列芯片可多因子组合检测,且具有高通量优势,是自免标志物检测的有力技术平台。
GUO等[33]首次报道了利用悬浮阵列技术实现多位点的多路发光氧通道免疫分析平台,设计了一种独特的由QDs主珠(QDH)和位点受体珠(ABs)组成的主-客体双功能条码,QDH提供高编码容量的功能,ABs促进发光氧通道免疫分析的功能。通过基于图像的解码,可以自动区分不同的条形码,并利用位置信号进行共局域化,实现了在一个反应中同时检测IFN-γ、IL-2、IL-10、IL-17A多个分析物。ZHENG等[34]建立图形编码的二氧化硅粒子平面衬底(25 μm×14 μm)的悬浮阵列芯片系统,编码粒子薄膜涂层由高、低折射率交替介质材料(Si3N4和SiO2)周期性多层叠加而成。利用该系统成功创建GRASP assay法,可联合检测Ⅰ型糖尿病患者的胰岛细胞抗原谷氨酸脱羧酶(GAD65)、胰岛素瘤抗原2 (IA-2)和锌转运蛋白8 (ZnT8) 3种血清自身抗体。与临床诊断结果比较,GRASP assay检测灵敏度高达92.0%,特异度达100.0%。此外,产品化的全自动磁条码多重液相芯片检测平台(MCLIA-800),采用多层复合材料,以“棒状”和“点状”组合制备编码多达4 096种的芯片,实现单管中同时进行17种抗核抗体的检测,该体系具有高通量、高灵敏度、反应速度快、随机进样等特点。自身免疫性生物标记物临床诊断应用研究尚在起步阶段,随着编码微球、设备不断改进,检测成本降低,该技术在自免诊断领域有望发挥更大的应用价值。
3.3肿瘤标志物检测 肿瘤筛查一般采用影像检查技术,该法对恶性肿瘤患者的预后评估缺乏有效的参考价值,组织病理活检作为金标准,对患者侵袭性极高。血清肿瘤标志物来源于肿瘤细胞或肿瘤微环境基质细胞,包括酶、蛋白质、激酶等,尤为适合人群普筛,液相悬浮阵列芯片技术在肿瘤标志物蛋白和游离核酸修饰等临床检测趋于流行。
XU等[35]基于反蛋白石光子晶体(PEGDA和琼脂糖构成)编码微球的液相悬浮阵列芯片技术检测肿瘤标志物甲胎蛋白(AFP)和癌胚抗原(CEA)。PEGDA构成的反蛋白石光子晶体能够提供编码信号和保证稳定性,且该结构空隙大利于分子的进出;琼脂糖提供功能基团固定抗体,检测限分别可达0.21 ng/mL和0.78 ng/mL。XIANG等[36]基于UiO-66-NH2金属有机框架包裹在不同形态的微生物表面,形成用于检测的新型微生物UiO-66-NH2复合材料而提出了的一种可识别形态的悬浮阵列。微生物赋予了复合材料不同形态和尺寸的条形码能力,UiO-66-NH2具有稳定的刚性外壳、较大的比表面积和具有多个结合位点的金属离子,可以简化蛋白的固定化过程,实现了同时检测结肠癌患者的miRNA-21、miRNA-17和miRNA-182核酸序列。此外,Luminex的Human Cancer Biomarkers液相悬浮芯片可对CA15-3、CA19-9、CA125、前列腺特异性抗原(PSA)等25种肿瘤标志物进行同步检测,利用生物素-链霉亲和素(BSA)和SA-PE荧光素实现微量因子的信号放大。液相悬浮阵列芯片作为肿瘤的普筛技术,不仅可大大缩减筛查检测时间,为临床提供辅助诊断依据,还可预判疾病发展的阶段和程度,在肿瘤标志物检测中具有巨大的应用潜力。
3.4其他生物活性物质的检测 心血管疾病作为危害人类健康的一大慢性疾病,其筛查诊断指标众多,液相悬浮阵列芯片技术可实现诸多心血管疾病生物标志物的联合检测,如冠心病可检测的标志物有脂联素/Acrp30、CD40、CD40配体等;急性心肌梗死可检测的标志物有心脏肌红蛋白、cTNI等。此外,可应用于糖尿病与代谢病生物标志物的检测,如胰岛素、胰岛素C-肽、IGFBP-1、IGFBP-3、IGFBP-rp1/IGFBP-7等。液相芯片不仅可用于临床疾病诊断,而且也可用于信号通路临床研究,如IFN-γ、IFN-γR1、肾素、PDGF-AA、PDGF-BB、EGF、M-CSF等小分子活性物质水平检测。
4 展 望
液相悬浮阵列芯片技术可弥补传统ELISA、化学发光技术的通量和组合检测需求,具有高通量、准确、快速、灵敏的优势。该技术具有广阔临床应用前景的同时也存在挑战。例如:(1)国内荧光微球技术落后,具有高性能、高附加值的荧光微球材料被国外Luminex公司垄断、占据着绝对龙头地位;(2)血清中嗜异性抗体的存在可能干扰蛋白分析,牛血清清蛋白(BSA)作为一种阻断剂可降低非特异性吸附克服背景信号增强,且不能连续监测样品浓度;(3)国内相关领域的技术人才缺乏,诸多标志物组在临床诊断的价值有待大样本、多中心研究。
与此同时,液相芯片技术的应用还面临诸多机遇:(1)与新型编码微球技术、数字信号处理技术、抗体核酸技术等充分结合,实现同一个平台多种临床样本分析;(2)有望在超过40个临床诊断领域如基因突变研究、细胞因子、病原微生物等深入应用研究;(3)“床旁检测”(POCT)诊断平台临床需求大,开发高通量微型液相悬浮阵列芯片技术实现POCT诊断是未来的趋势。随着医院接诊量提高,自动化检验需求加大,多指标联合的高通量筛查需求不断加大,液相悬浮阵列芯片技术多元化的发展与临床疾病诊断的联系越来越密切,液相芯片技术不仅可实现高通量、高精度、多项指标检测,同时还减少了样本量及检验人员工作量,在临床诊断方面有着广阔的应用前景。

