Otx1诱导外向钾电流并抑制小鼠神经母细胞瘤细胞增殖*
涂晓萌, 司 祥, 李 雪
(温州医科大学附属眼视光医院眼视光学和视觉科学国家重点实验室,浙江温州325027)
同源框转录因子参与大脑皮质的神经发育[1]。在啮齿类动物胚胎中,同源框转录因子Otx1(orthodenticle homeobox 1)表达在发育早期大脑皮质神经前体细胞,以及出生后的皮质神经元中[2-6]。研究显示,Otx1基因靶向缺失的小鼠具有自发性的癫痫发作[5,7]。Otx1 可以自主性调节大脑皮质神经元的电生理特性——大脑皮质异位表达Otx1可提高动作电位阈值,并延长爆发式动作电位之间的时间间隔[8]。动作电位间的时间间隔由复极化和超极化决定,受外向钾电流的调控。电压门控性钾通道(Voltagegated potassium channels,Kv)在控制神经元的静息电位以及动作电位的复极化过程中发挥着重要的作用[9-10],它的缺失可增加癫痫发作的倾向性[11]。因此大脑皮质中Otx1的缺失可能调控Kv的表达或功能。
Otx1敲除小鼠表现出皮质神经元数量减少和大脑发育不全,皮质变薄[6,12]。此外,2p15-16.1染色体微缺失综合征的患者表现出智力发育障碍、自闭症和小头畸形[13],OTX1是该染色体微缺失的基因之一[14-15],OTX1的缺失可能与小头畸形有关。在小鼠大脑中敲减Otx1可延长神经前体细胞的分裂期和增殖状态,从而使得退出有丝分裂的神经元减少。反之,过表达野生型Otx1可增加皮质神经元的产生,但星形胶质细胞瘤相关的Otx1突变体Y320C不能上调皮质神经元的数目[16]。Otx1 调控皮质神经元数量的机制目前尚不清楚。由于发育期的大脑皮质神经前体细胞在由增殖转变为分裂退出时会发生超极化[17-19],我们设想 Otx1 也许通过调节 K+通道和超极化过程,进而影响神经细胞的增殖和分化。
本研究利用小鼠神经母细胞瘤N2a 细胞作为神经细胞的体外模型,采用全细胞膜片钳记录分析Otx1对K+外向电流的调节,并研究了K+外向电流和细胞增殖之间的关系。
材料和方法
1 细胞与主要试剂
N2a 细胞购于上海细胞资源中心。DMEM 培养液、胎牛血清、0.25% trypsin-EDTA 和 HBSS(Hanks'Balanced Salt Solution)购自Gibco。青、链霉素和4-氨基吡啶(4-aminopyridine,4-AP)购自Sigma;Opti-MEM 和 Lipofectamine 3000 购自 Invitrogen;点突变试剂盒购自天根生化科技有限公司;Cell-LightTMEdU Imaging Kit购自广州锐博生物科技有限公司。
2 实验仪器
二氧化碳细胞培养箱和CountessTMAutomated Cell Counter(Invitrogen);PCR扩增仪(Bio-Rad);激光共聚焦扫描显微镜(Zeiss LSM 710)。
3 主要方法
3.1 细胞培养和质粒转染 N2a 细胞培养在含有10%胎牛血清和1%-青链霉素的DMEM 中。细胞置于5%CO2培养箱中37 ℃培养。利用小鼠大脑cDNA文库通过PCR 扩增,分别得到Otx1和Kv4.2全长。Otx1的上游引物序列为5'-GCTGTTAGCATGATGTCTTACCTCAAACA-3',下游引物序列为5'-CCTGGGCTCACAAGACCTGGA-3';Kv4.2的上游引物序列为5'-ATGGCAGCCGGTGTTG-3',下游引物序列为5'-TTACAAGGCAGACACCCTGA-3'。通过EcoR I 和NotI 酶切位点将基因克隆到pLVX-EF1α-IRES-mCherry 的载体上,得到Otx1-mCherry 和Kv4.2-mCherry,该质粒共表达mCherry 作为报告基因。在人星形胶质细胞瘤中检测到OTX1点突变K321T 和Y320C 位于其保守的转录调控结构域[16]。于是我们在Otx1-mCherry 上采用点突变试剂盒,分别引入K321T 和Y320C 的点突变。使用Lipofectamine 3000将构建的质粒转染到N2a细胞中,37 ℃下培养24 h。
3.2 EdU 染色 采用Cell-LightTMEdU Imaging Kit(RiboBio)试剂盒,测量N2a 细胞的增殖。将Otx1和对照质粒转染的细胞,以每孔3×105的密度接种于24孔板,在37 ℃培养箱中培养24 h。加入50 nmol/L EdU 继续孵育细胞3 h。4%多聚甲醛室温固定30 min,甘氨酸(2 g/L)清洗5 min,加0.5% Triton X-100处理10 min。加Apollo®荧光染料(100 μL/well)孵育30 min 显色后,在Zeiss LSM 710 共聚焦显微镜下观察拍照。基于转染细胞的总数目计算出EdU 阳性(处于DNA合成期)细胞的比例。
3.3 电生理学记录 为了研究Otx1 对钾电流的调节作用,参照《Bioelectromagnetism》中关于Active Behavior of the Cell Membrane 的方法进行电生理学实验,记录分别转染Otx1-mCherry 和对照mCherry、Otx1突变体 K321T 或 Y320C 和对照 mCherry 的 N2a细胞的电生理参数。所有实验均在室温[(22±1)℃]下进行。利用微电极拉制仪P-97拉制记录所需的玻璃微电极。在记录电极内加入电极内液,电极内液成分(mmol/L):KCl 150,MgCl22,HEPES 5,EGTA 5,Glucose 5,Na2ATP 5,用KOH 调节 pH 为 7.3。玻璃微电极的入液电阻为3~6 MΩ。细胞外液成分(mmol/L):Na-gluconate 75,NaCl 70,KCl 5,HEPES 5,Glucose 5,pH 7.4。在显微镜下操纵微电极接触细胞,封接电阻达1 GΩ 时,负压下吸破细胞膜,使记录电极内液与细胞内液相通,形成全细胞记录模式。信号经Multiclamp 700B 放大,通过数模转化器Digidata 1332 转换后,在软件pCLAMP 10.1 下进行数据采样。采样频率为2~5 kHz。为消除细胞间的误差,根据细胞膜电容和刺激电压斜率获得电流密度(pA/pF),并构建电压-电流密度图。
为了构建动作电位的稳态激活和失活曲线,按照结果部分中描述的步骤给予相应电压刺激后记录电流。标准化各电流幅值(I/Imax),以标准化电流对各阶跃电位作图。构建I-V曲线,通过ClampFit 分析,进行Boltzmann 方程拟合。计算半最大激活或失活电压(voltage for half maximal activation/inactivation,V1/2),该值反映了半数K+通道激活或失活的难易程度。
4 统计学处理
所有实验至少重复3 次以上。所有数据均以均数±标准误(Mean±SEM)表示。使用Student'st检验或单因素方差分析后进行Tukey多重比较检验,分析组间差异。以P<0.05差异有统计学意义。
结 果
1 Otx1促进外向K+电流
为了探索Otx1对神经细胞电生理特性的调节作用,我们首先克隆了过表达Otx1的Otx1-mCherry。我们将对照载体和Otx1-mCherry 分别转染至N2a 细胞中,24 h 后用全细胞膜片钳记录去极化激活的外向电流。为了阻断电压门控的Na+和Ca2+电流,在细胞外液中加入 1 μmol/L TTX 和 0.1 mmol/L CdCl2。将钳制电压设置为-90 mV,再施予500 ms、阶跃为10 mV、-70~+80 mV 的系列去极化刺激,记录 N2a 细胞中的电流。如图1 所示,随着细胞膜去极化,电流和电流密度增加。因此Otx1过表达对外向电流的产生具有促进作用(图1A、B)。对照组在+80 mV 时的峰值电流为(329.17±11.30)pA,而Otx1过表达时相同电位下的峰值电流为(616.87±22.50)pA(P<0.01),见图1C。当CsCl 取代记录电极内外溶液中的KCl 时,该电流消失,证实Otx1 诱导的是电压依赖的外向K+电流。

Figure 1.Otx1 promoted a voltage-dependent outward current.A:whole-cell patch-clamp currents recorded from Otx1-mCherry- or mCherry-transfected cells(the cells were clamped at a voltage of -90 mV,followed by a series of depolarization stimulations at -70 to +80 mV,10 mV step,and 500 ms duration);B:the voltage-current density curves of Otx1-mCherry and mCherry groups;C:the peak currents at +80 mV of Otx1-mCherry and mCherry groups.Mean±SEM. n=3.**P<0.05 vs mCherry group.图1 Otx1促进电压依赖型外向电流
2 Otx1对K+电流激活和失活的影响
为了研究Otx1对K+通道的作用,我们检测了电压依赖的激活曲线(反映K+通道打开时的难易程度),钳制电压为-90 mV,测试电压为-30 mV,测试前以10 mV 的阶跃给予-70~+60 mV 的系列去极化(图2A)。计算尾电流与其最大值的比值I/Imax,绘制标准化激活曲线(图2B)。通过Boltzman 方程I/Imax=1/{1+exp[(Vm-V1/2)/k]}拟合数据后,得出半激活电压V1/2。对照组V1/2为(-9.68±2.30)mV,Otx1过表达组V1/2为(-12.42±0.70)mV(P>0.05),见图2C。这表明Otx1并不影响Kv的激活。
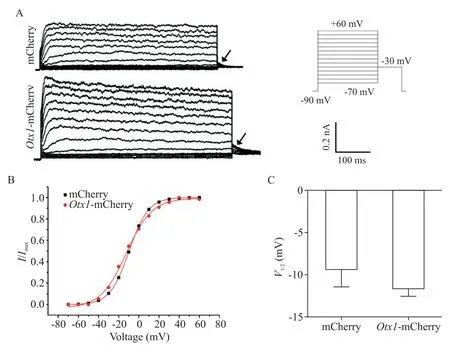
Figure 2.Otx1 did not affect the activation of potassium current.A:outward current and the indicated tail current(arrow)of Otx1-mCherry- or mCherry-transfected cells under the depolarization(the peak tail current was measured at a voltage of -30 mV after the clamping voltage of -90 mV and a series of -70 to +60 mV depolarization);B:the activation curves measured in mCherry- or Otx1-mCherry-transfected cells,fitted to Boltzmann equation;C:statistical analysis of the voltage for half maximal activation(V1/2)in Otx1-mCherry and mCherry groups.Mean±SEM. n=3.图2 Otx1对钾电流的激活无明显影响
K+通道随着去极化时间延长而逐渐衰减。K+通道失活的也取决于去极化电压。为构建失活曲线,预先给予5s、-90~+20 mV 的系列去极化之后,再加上+40 mV 的 250 ms 测试脉冲[14],以获得叠加的尾电流(图3A)。随着去极化电压的升高,电流的幅度减小。将去极化电压和标准化尾电流的曲线通过Boltzmann 方程I/Imax=1/{1+exp[-(Vm-V1/2)/k]}拟合计算半失活电压V1/2。在Otx1 的作用下,I-V曲线左移(图3B),表明失活过程加快。对照组V1/2为(-19.52±5.70)mV,而Otx1过表达组V1/2为(-37.23±3.30)mV(P<0.01),见图3C。
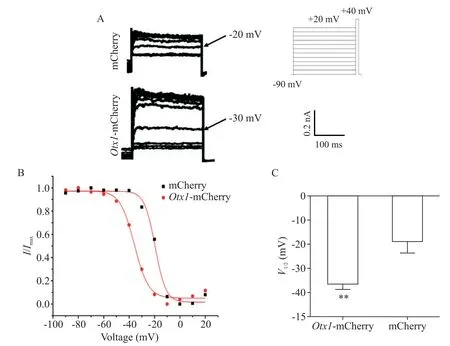
Figure 3.Otx1 accelerated the inactivation of potassium current.A:the current waveforms of mCherry- or Otx1-mCherry-transfected cells under the clamping voltage of -90 mV and a series of -90 to +20 mV stimulations for5s(the tail current was measured at a voltage of +40 mV);B:the inactivation curves measured in mCherry- or Otx1-mCherry-transfected cells,fitted to Boltzmann equation;C:statistical analysis of the voltage for half maximal inactivation(V1/2)in Otx1-mCherry and mCherry groups.Mean±SEM. n=3.**P<0.01 vs mCherry group.图3 Otx1加速钾电流的失活
3 Otx1引起外向电流失活后的恢复时间延长
失活后,Kv逐渐恢复并为下一次激活做好准备。为了研究Kv 的重新激活,保持电位在-90 mV,给予3 s、+40 mV 的预脉冲后,将 N2a 细胞的膜电位钳回到-80 mV,维持10 ms~4 s 的不等时间。最后在测试脉冲+40 mV 下测量电流,以评估外向电流随着复极化时间的恢复程度(图4A)。每个测试脉冲下的电流峰值归一化后,针对复极化的时间做图(图4B)。按单项指数式求出恢复时间常数τ。对照组τ=(143.61±13.90)ms,Otx1过 表 达 组 τ=(293.33±25.70)ms(P<0.01),见图 4C。这表明 Otx1 延缓了Kv电流的恢复。

Figure 4.Otx1 prolonged the recovery time of Kv after inactivation.A:a step jump from -90 mV to +40 mV(3 seconds)was followed by repolarization at-80 mV(the currents were measured at+40 mV after holding at the repolarization for various durations);B:the normalized peak current(I/Imax)induced by the test pulse was plotted against the time of repolarization at-80 mV;C:statistical analysis of the recovery time constant of outward current in Otx1-mCherry and mCherry groups.Mean±SEM. n=3.**P<0.05 vs mCherry group.图4 Otx1延长Kv失活后的恢复时间
4 OTX1诱导的外向K+电流抑制N2a细胞增殖
为了探讨N2a细胞中的K+电流是否受到Otx1的转录调控,我们研究了Otx1 的2 个C 端突变。Otx1突变体K321T和Y320C转染的N2a细胞的外向Kv电流要弱于表达野生型Otx1的细胞(图5A)。同时与野生型Otx1相比,突变体增加了细胞中EdU 的掺入比例(P<0.05 或P<0.01),见图5B。Otx1 诱导的K+电流可以被4-AP 阻断(图6A、B)。Kv4.2 是受4-AP抑制的K+通道之一。我们克隆了过表达Kv4.2的Kv4.2-mCherry,在 N2a 细胞中转染Kv4.2-mCherry 可增加外向K+电流密度(图6C)。用EdU 染色结果显示,与对照质粒的细胞相比,转染Kv4.2的细胞处于增殖期的比例显著降低(P<0.01),见图6D。

Figure 5.The effect of Otx1 mutants on potassium current and cell proliferation.A:the voltage-current density curves were determined in the cells transfected with Otx1 or the mutants(the cells were treated with a series of -70 to+80 mV depolarization in 10 mV step for 500 ms,following holding at-90 mV);B:the proportion of EdU-positive cells was calculated as the proliferating cells.Mean±SEM. n=3.*P<0.05,**P<0.01 vs Otx1-mCherry group.图5 Otx1突变体对钾电流和细胞增殖的影响

Figure 6.The effect of 4-AP on potassium current and cell proliferation.A:the current waveform of mCherry-or Otx1-mCherry-transfected cells;B:the current waveform after adding 3 mmol/L 4-AP to the extracellular fluid;C:the voltage-current density curves from the N2a cells expressing control or Kv4.2 plasmid(the cells were recorded under a series of -70 to+80 mV depolarization in 10 mV steps for 500 ms,following clamping voltage at -90 mV);D:the proportion of EdU-positive cells were calculated as the proliferating population.Mean±SEM. n=3.**P<0.01 vs pCAGEN+RFP-pCAAS group.图6 4-AP对钾电流和细胞增殖的影响
讨 论
Otx1突变小鼠表现出自发性癫痫发作[5,7]。我们在前期的研究中观察到,Otx1 调控皮质神经元的放电模式[8]。Otx1在大脑皮质上皮层中的过表达增加了低兴奋性的爆发式放电神经元比例,并改变其放电模式。过表达引起的电生理改变与Otx1突变带来的变化相反[8],表明对功能增强的研究可以揭示功能丧失所引起的表型变化。在本课题中,我们研究了过表达Otx1对N2a细胞电生理特性的影响;N2a细胞本身并不表达Otx1。我们观察到Otx1的异位表达诱导对4-AP 敏感、电压依赖性的K+外向电流。4-AP 是广谱的Kv 阻滞剂,因此尚无法确定Otx1 抑制的特定K+通道,但可以排除Kv7.4(该通道受4-AP的激活而增强)[20]。
K+电流是神经元膜电位的基础,也是动作电位复极化/超极化的决定因素。我们观察到Otx1 不改变Kv 的激活,但加速其失活,并延长失活后的恢复过程(图2~4)。这表明Otx1 对K+电流的调控可能是其在皮质神经元中延长爆发式放电时间间隔的一个重要原因。由此本研究证实了Otx1对皮质复杂神经回路的电生理特征具有细胞自主性的调控作用。
人类OTX1基因位于2 号染色体p15-16.1。染色体2p15-16.1 的微删除引起智力发育障碍、自闭症、癫痫和小头畸形[14-15,21]。Otx1不仅表达在成熟的神经元中,也表达在神经前体细胞中。在发育期皮质,敲减Otx1可增加增殖期的神经前体细胞,同时减少皮质神经元的生成[16]。因此OTX1的丢失可能是染色体2p15-16.1 微删除引起小头畸形的一个重要因素。但目前尚不清楚OTX1 如何影响皮质神经元的产生。而在增殖的神经前体细胞中也已检测到电压门控的K+电流[22-24]。在本研究中,我们观察到Otx1诱导的外向K+电流与N2a 细胞的增殖有关。K+电流调节Ca2+的流入,同时通过控制膜电位,间接影响Na+梯度依赖的营养物转运,以及细胞体积和细胞内的pH[25-26],因此可能是生理或病理条件下细胞增殖的重要调节因素。在后续研究中,我们需要确定介导Otx1 行为的特定K+通道,以揭示Otx1 调控神经增殖和2p15-16.1微缺失综合征的分子机制。

