一种小鼠2型糖尿病合并动脉粥样硬化模型的构建方法及评价*
杨金伟, 喻 嵘 , 吴勇军 , 刘 秀, 邓奕辉△
(湖南中医药大学 1中西医结合学院,2研究生院,3中医方证研究转化医学湖南省重点实验室,4药学院,湖南长沙410208)
糖尿病(diabetes mellitus)是由于胰岛β 细胞损伤(胰岛素分泌缺陷)及胰岛素抵抗状态(生物作用受损),出现以慢性血糖增高为特征的代谢紊乱综合征[1]。据国际糖尿病联盟于2019 年发布的最新全球糖尿病地图(第9 版)的数据统计,全球成人糖尿病患者(20~79 岁)已增至4.63 亿。我国糖尿病患者约1.164 亿,以2 型糖尿病为主,而心脑血管并发症是致死的主要原因[2-3],病变累及心、脑大血管形成动脉粥样硬化,严重者引起组织缺血坏死。目前糖尿病合并动脉粥样硬化的病因及各种并发症的发病机制尚未完全阐明,而理想动物模型的建立是实验研究的基础。
小鼠2 型糖尿病动脉粥样硬化实验模型制备方法主要有3 类:(1)基因杂交,将糖尿病模型小鼠与动脉粥样硬化模型小鼠进行杂交,但因其操作方法较为复杂、繁殖小鼠存在基因修复情况、制备成功率不明确等因素限制了实验使用[4]。(2)以动脉粥样硬化小鼠(ApoE-/-小鼠)为基础,配合链脲佐菌素(streptozocin,STZ)对小鼠胰腺损伤,模拟糖尿病过程。ApoE-/-小鼠可自发形成明显的粥样斑块,在高脂及STZ 的联合诱导下存在明显的糖脂代谢紊乱及胰岛素抵抗状态,实验过程中操作相对简单可靠,现阶段较多使用[5-6]。(3)以糖尿病模型小鼠为基础制备动脉粥样硬化模型,多采用喂养高脂饲料,可较好地模拟2 型糖尿病并发血管病变的病理过程,但研究对象的选择及诱导干预方法的不同,使其动脉粥样斑块的发生率和程度不明确。本课题组对2 型糖尿病动脉粥样硬化的研究中,以MKR 小鼠作为研究对象,联合STZ 及N-硝基-L-精氨酸甲酯(N-nitro-L-arginine-methyl ester,L-NAME)干预诱导,成功建立了稳定的2 型糖尿病动脉粥样硬化小鼠模型,可为研究糖尿病大血管病变的发病机制及治疗措施提供参考。
材料和方法
1 实验动物
本实验的MKR 小鼠为胰岛素/胰岛素样生长因子双重受体缺陷的转基因糖尿病小鼠,从美国国立卫生研究院(NIH)的Dr.Derek LeRoith 和Dr.Jun-Li Liu 处引进,湖南中医药大学SPF 级动物实验室自繁自用。FVB/N 及ApoE-/-小鼠由湖南中医药大学SPF实验动物中心向北京维通利华实验动物技术有限公司订购,许可证号为SYXK(湘)2013-0005。
2 实验饲料及试剂
普通饲料(编号U05615908,Co60辐照实验鼠维持饲料)、胆固醇及胆酸钠(江苏省协同医药生物工程有限责任公司)。高脂乳剂配方:胆固醇50 g、猪油100 g、丙基硫氧嘧啶1 g、胆酸钠10 g、吐温80 100 mL和丙二醇100 mL,蒸馏水定容至500 mL。以上均经灭菌处理。STZ(Sigma);丙基硫氧嘧啶片和LNAME(上海源叶生物科技有限公司);总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)和低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)试剂盒(南京建成科技有限公司);C-反应蛋白(C-reactive protein,CRP)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素1β(interleukin-1β,IL-1β)及IL-18 试剂盒(上海酶联生物科技有限公司);兔源基质金属蛋白酶9(matrix metalloproteinase 9,MMP-9)抗体和金属蛋白酶组织抑制物1(tissue inhibitor of metalloproteinase 1,TIMP-1)单克隆抗体(Abcam)。
3 实验方法
3.1 动物分组饲养 8周龄MKR小鼠20只,随机选取10 只作为MKR 空白(MKR blank)组,剩余MKR 小鼠与FVB/N、ApoE-/-小鼠给予溶于柠檬酸钠缓冲液(pH 4.5)中的STZ 40 mg·kg-1·d-1,连续5 d 进行腹腔注射造模,测得空腹血糖>11.1 mmol/L,则表示糖尿病造模成功;糖尿病造模成功后,除MKR空白对照组予生理盐水,其余MKR小鼠予L-NAME 0.2 mg·kg-1·d-1,同时联合高脂乳剂10 mL·kg-·1d-1灌胃进行造模12 周,建立糖尿病动脉粥样硬化模型。另取10 只FVB/N 小鼠作为正常(normal)组,以普通维持饲料饲养。饲养条件:温度(22±2)℃及相对湿度(50±5)%,光/暗周期为12 h/12 h。自由饮水,每日更换饮水瓶,定期清理笼具与垫料,通风,光线良好。
3.2 观察指标 取材前1 d,小鼠禁食不禁水8 h,小鼠尾静脉采血应用电化学法血糖仪检测空腹血糖;配制10%的水合氯醛4 mL/kg 腹腔注射麻醉,心脏采血后处死小鼠,收集血液,分离血清,用于血脂相关指标和胰岛素。用组织剪剥离小鼠胰腺,剔除胰腺组织周边脂肪,取出完整的胰腺组织。同时暴露心脏,自主动脉起始部开始分离向下至骼总动脉分叉处,向上分离左侧头臂干动脉和无名动脉,将心脏与血管一同取下,切取小鼠主动脉组织放入2 mL 4%多聚甲醛固定液常温保存24 h 做HE、Masson 染色及免疫组化检测。
3.3 血脂、胰岛素及血清 CRP、TNF-α、IL-1β 和 IL-18水平的检测 应用全自动生化分析仪检测血脂相关指标(包括TC、TG、HDL-C、LDL-C)。ELISA 法测定小鼠血清 CRP、TNF-α、IL-1β 及 IL-18 的含量。稀释和加样后用封板膜进行封板温育,配液洗涤进行加酶,通过显色后以450nm 的波长依次测量每孔吸光度。化学发光法测定胰岛素水平。胰岛素抵抗指数(HOMA-IR)=空腹血糖×血清胰岛素水平/22.5。
3.4 小鼠胰腺及动脉HE 染色 石蜡包埋,切片厚度3~4 μm,60 ℃烤片1~2 h;脱蜡:切片置于二甲苯中10 min,2 次。依次在100%、95%、85%和75%乙醇,每级放置5 min。蒸馏水浸洗5 min;苏木素染5~10 min,PBS 返蓝;伊红染3~5 min,蒸馏水冲洗;梯度酒精脱水;中性树胶封片、显微镜观察。
3.5 小鼠动脉Masson 染色 石蜡包埋切片(3 μm);切片脱蜡至水,核染液染色3~5 min;冲洗染色液,PBS浸泡切片5~10 min,胞核返蓝;滴加浆染液染色2 min;分色液分色30 s;滴加复染液染色6~8 min,无水乙醇冲洗干净;吹干、透明、封片,显微镜观察。
3.6 免疫组化法测定MMP-9 和TIMP-1 的表达水平 脱蜡前60 ℃恒温箱烘烤60 min;常规二甲苯浸泡两次脱蜡,依次用100%、95%、85%和70%浓度乙醇梯度水化5min;PBS 浸泡5 min,清洗 3 次;抗原修复后再次PBS浸泡5 min,清洗3次。样本处理后,免疫组化检测MMP-9和TIMP-1阳性表达率,加HRP灭活液覆盖样本,冰上放置,PBS 浸泡2 min,洗涤3 次;经水化、封闭,通过抗体稀释液稀释I 抗(1:100),加入 100 μL,每片 1 μg 抗体 I 抗孵育、II 抗孵育。制备DAB 显色液,运用显微镜下观察染色的程度,染好后立刻终止反应;将切片放入苏木素染液中,5 min 后用蒸馏水清洗干净,封片后于显微镜下拍照并计算MMP-9 和 TIMP-1 阳性细胞数。MMP-9 和 TIMP-1 阳性表达形式为胞核或胞浆呈棕黄色颗粒。
4 统计学处理
实验数据均运用SPSS 19.0统计软件处理。计量资料以均数±标准差(mean±SD)表示。组间比较若满足正态性者,多组比较采用单因素方差分析,两两比较采用SNK-q检验;不满足正态性资料用Kruskal-Wallis秩和检验。以P<0.05为差异有统计学意义。
结 果
1 各组小鼠血糖、血脂和胰岛素水平及胰岛素抵抗指数的变化
造模诱导过程中正常组小鼠空腹血糖波动不明显;MKR 小鼠在诱导干预为动脉粥样硬化模型前血糖较其他组增高;通过腹腔注射STZ 及高脂乳剂的灌胃,FVB/N、ApoE-/-及MKR 小鼠血糖较正常组均显著升高,差异有统计学意义(P<0.05),ApoE-/-及MKR模型组升高尤为明显,而这2 组间无显著差异(P>0.05);整个造模周期中,MKR 小鼠体现出较为稳定的血糖高值,见图1。
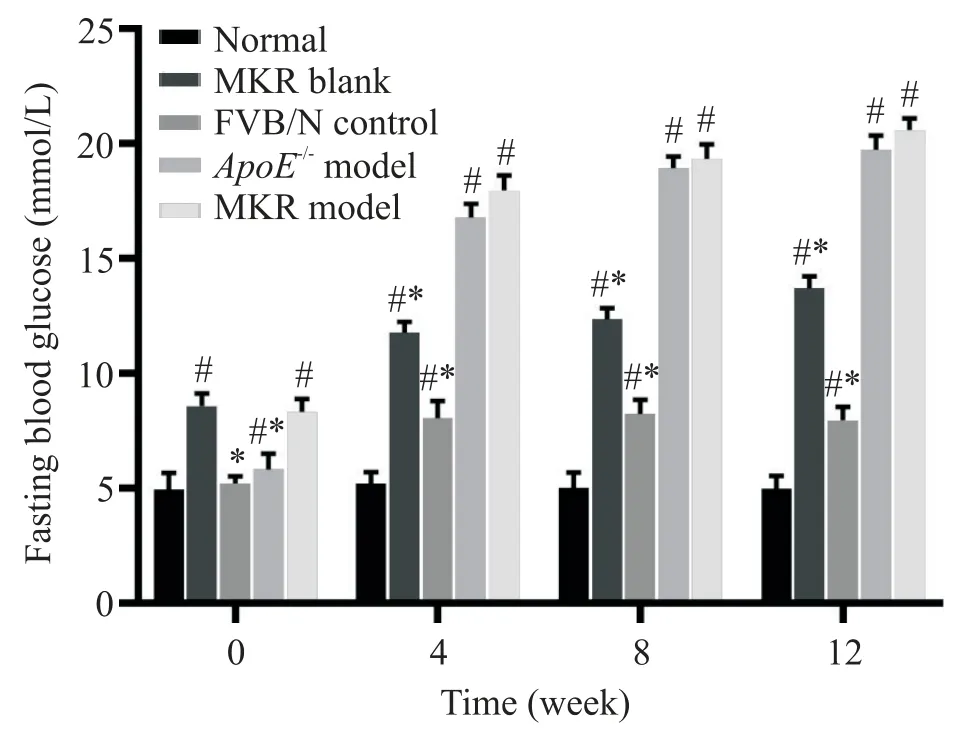
Figure 1.Comparison of fasting blood glucose in each group.Mean±SD. n=10.#P<0.05 vs normal group;*P<0.05 vs MKR model group.图1 各组小鼠空腹血糖的变化
与正常组相比,ApoE-/-及 MKR 模型组 TG、TC 和LDL-C 水平显著增高,HDL-C 水平显著降低(P<0.05),说明MKR 小鼠经造模后存在血脂代谢异常;FVB/N 对照组及 MKR 空白组小鼠 TG、TC 和 LDL-C水平较正常组高(P<0.05),但仍不及MKR 模型组血脂的水平(P<0.05),见图2。
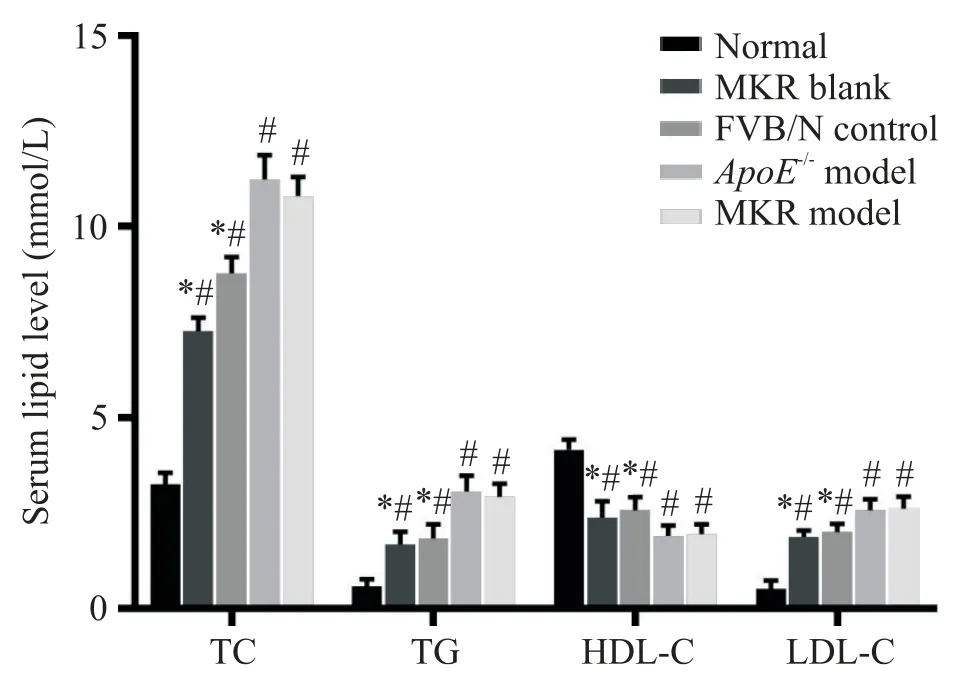
Figure 2.The levels of serum lipids in each group.Mean±SD.n=10.#P<0.05 vs normal group;*P<0.05 vs MKR model group.图2 各组小鼠血脂水平的变化
造模12周后,与正常组相比,其余各组小鼠血清胰岛素水平及胰岛素抵抗指数均显著升高(P<0.05);与FVB/N对照组比较,ApoE-/-及MKR模型组小鼠血清胰岛素水平及胰岛素抵抗指数进一步升高(P<0.05),见图3。
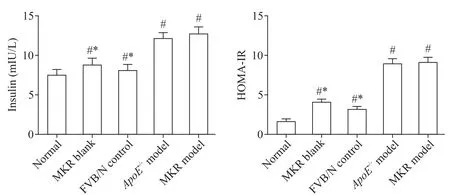
Figure 3.Comparison of fasting serum insulin level and HOMA-IR in each group.Mean±SD. n=10.#P<0.05 vs normal group;*P<0.05 vs MKR model group.图3 各组小鼠空腹血清胰岛素水平及胰岛素抵抗指数的变化
2 各组小鼠炎症相关因子变化情况
高脂乳剂及L-NAME 持续诱导后,FVB/N 对照组、ApoE-/-模型组及MKR模型组小鼠血清CRP、TNF-α、IL-1β 及IL-18 水平较正常组显著升高(P<0.05),其中以ApoE-/-及MKR 模型组更明显,而这2 组间的差异无统计学显著性(P>0.05);与 MKR 空白组比较,MKR 模型组血清中炎症因子水平显著升高(P<0.05),说明L-NAME 的持续干预可诱导炎症因子释放过程,见图4。
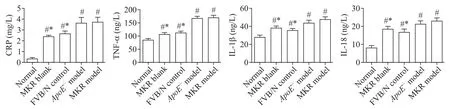
Figure 4.Comparison of CRP,TNF-α,IL-1β and IL-18 levels in each group.Mean±SD. n=10.#P<0.05 vs normal group;*P<0.05 vs MKR model group.图4 各组小鼠CRP、TNF-α、IL-1β及IL-18水平的变化
3 各组小鼠胰腺、主动脉染色特征分析
小鼠胰腺HE 染色病理切片显示,正常组胰岛清晰可见,胰岛与周围外分泌腺边界清晰,胰岛内可见丰富清晰的毛细血管;MKR 空白组胰岛细胞大小不等、分布不均,胰腺小叶结构紊乱;FVB/N 对照组可见部分胰岛细胞空泡变性,胰岛组织有轻微炎症因子浸润;ApoE-/-及MKR 模型组胰腺的外分泌部侵入胰岛,胰岛萎缩,大量炎症因子浸润。
小鼠动脉HE 染色病理切片显示,正常组主动脉内膜完整光滑,细胞排列整齐,未见炎症细胞聚集及斑块形成;MKR空白组主动脉内膜增厚,有斑块突出管腔,纤维组织排列紊乱;FVB/N 对照组主动脉有散在粥样斑块,中膜增厚伴部分平滑肌细胞增生,排列尚可,未见钙盐沉积及明显泡沫细胞堆积;ApoE-/-及MKR 模型组小鼠主动脉均有明显动脉斑块形成,管腔变窄,内膜明显增生,内含泡沫细胞及胆固醇结晶。应用图像分析仪分析斑块面积及Masson染色后含胶原斑块的面积,结果显示,与正常组比较,ApoE-/-模型组及MKR 模型组斑块面积与动脉壁横切面积的比值和含胶原斑块面积与斑块面积的比值均显著升高(P<0.05)。见图5。

Figure 5.The pathological changes of pancreatic and arterial tissues observed by HE and Masson staining(×400),and comparison of ratios of plaque area/lumen cross area and area containing collagen/plaque area in each group.Mean±SD. n=5.#P<0.05 vs normal group;*P<0.05 vs MKR model group.图5 各组小鼠胰腺和动脉组织的HE和Masson染色及主动脉粥样硬化斑块面积和含胶原斑块面积的变化
4 各组小鼠主动脉组织MMP-9 及TIMP-1 蛋白表达水平的变化
与正常组相比,MKR 空白组、FVB/N 对照组、ApoE-/-模型组及MKR模型组MMP-9阳性表达率均显著升高,TIMP-1 阳性表达率均显著降低(P<0.05),MMP-9/TIMP-1 比值显著升高;与MKR 模型组比较,MKR 空白组和FVB/N 对照组MMP-9 表达水平降低,TIMP-1 表达水平升高(P<0.05),而ApoE-/-模型组与MKR模型组之间无显著差异(P>0.05),见图6。
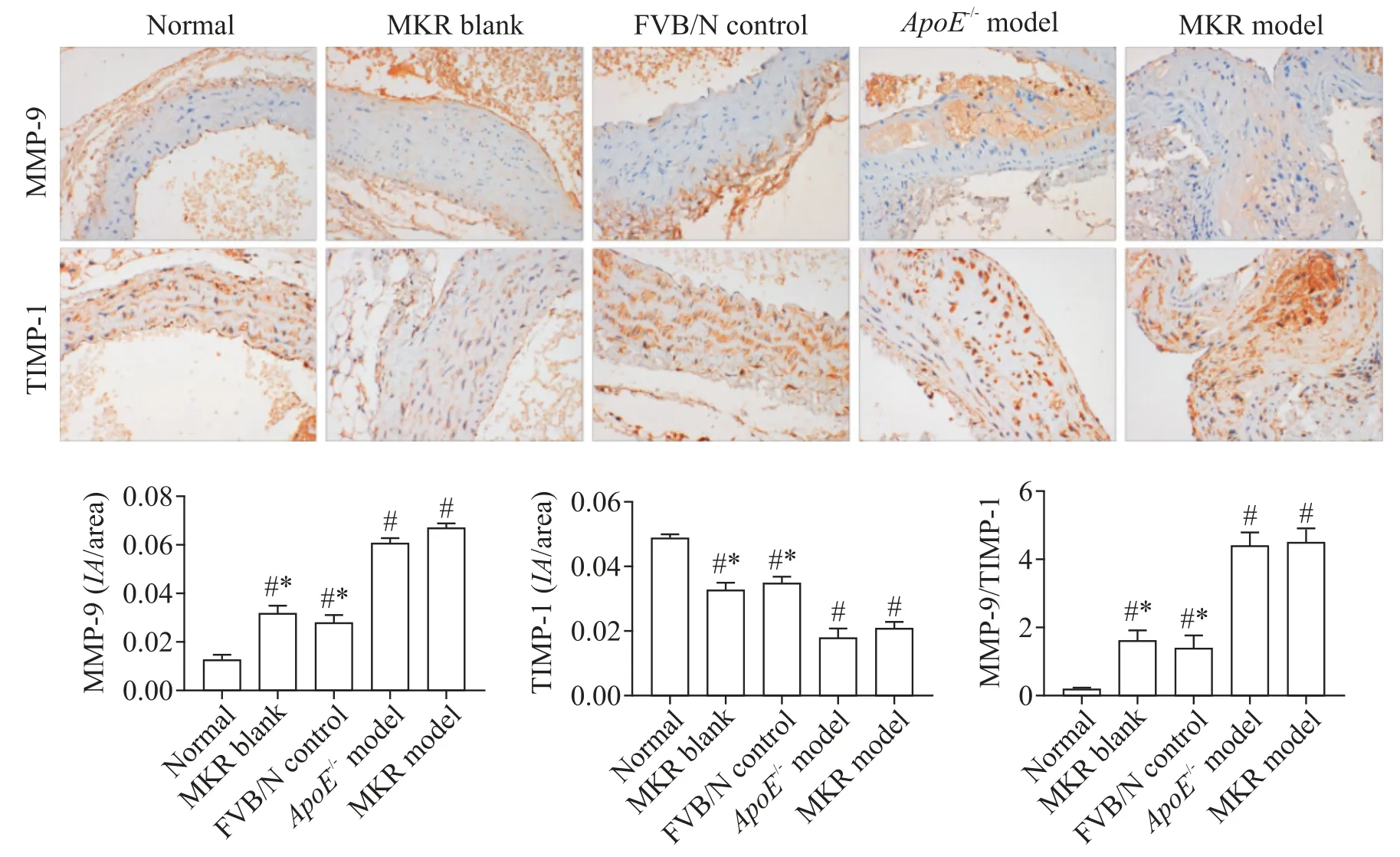
Figure 6.The protein expression of MMP-9 and TIMP-1 in the arteries detected by immunohistochemical staining.Mean±SD. n=5.#P<0.05 vs normal group;*P<0.05 vs MKR model group.图6 各组小鼠主动脉组织MMP-9及TIMP-1免疫组织化学染色
讨 论
糖尿病动脉粥样硬化是一个复杂的多细胞、多因素参与的慢性炎症性病理过程[7]。基本病理学特征是粥样斑块的形成。动脉内皮细胞损伤,出现脂质蓄积于内膜处,平滑肌细胞、泡沫细胞和胶原纤维积聚增生,随着病程进展伴有坏死、钙化的病变。糖尿病动脉粥样硬化的进程是多种致病因素交互的结果[8]。借助基因敲除手段辅以STZ诱导及高脂饲料,ApoE-/-小鼠在实验研究中可较好建立糖尿病动脉粥样硬化小鼠模型。但其本身存在较为明显的血脂代谢障碍及自发形成粥样斑块的特性,研究中难以区分加速的动脉粥样硬化是糖尿病的作用还是血脂代谢障碍的作用。
2 型糖尿病有胰岛素抵抗引起的高血糖和高胰岛素血症的病理特征[9]。MKR 小鼠是美国国立卫生研究院Dr.Derek LeRoith 等于2001 年建立的转基因非肥胖型2 型糖尿病动物模型小鼠[10]。该小鼠具有骨骼肌特异性胰岛素样生长因子1 受体(insulin-like growth factor 1 receptor,IGF-1R)缺陷而形成IGF-1和胰岛素受体(insulin receptor,IR)突变混合受体的特性,其 IGF-1 和 IR 功能均受损。MKR 小鼠在5周龄有明显的血糖升高、胰岛素抵抗、糖耐量异常及血脂代谢紊乱(LDL-C 和 TG 水平升高,HDL-C 水平降低)[11-12],表现出高血糖、高血脂、高胰岛素血症及周围组织胰岛素抵抗等特点并能稳定遗传,是良好的2型糖尿病及并发症研究的动物模型[13]。本研究中持续的高脂乳剂灌胃不仅可促使脂质代谢失衡也可更好维持胰岛素抵抗状态,STZ小剂量注射破坏胰岛功能,进一步确定模型的构建且体现胰岛素分泌不足的病理特点。L-NAME 的干预可加重血管的炎症损伤及粥样斑块的形成[14]。
本实验MKR模型组HE染色胰腺小叶结构破坏,大量腺泡萎缩形成空泡甚至破裂,炎症因子浸润明显;主动脉内膜增生,出现部分缺失;可见巨噬细胞,内膜含泡沫细胞;中膜增厚伴平滑肌细胞增生,排列不整齐。模型构建符合糖尿病动脉粥样硬化临床发病特点,在病理形态上出现了典型的胰腺损伤和粥样斑块形成的相关表现。糖脂代谢失衡是糖尿病动脉粥样硬化过程中的重要危险因素,机体持续高血糖及胰岛素抵抗状态的存在可诱导机体代谢异常、炎症反应及氧化应激损伤的持续状态,是疾病发展的始动因素[15]。而循环血中的胆固醇尤其是LDL-C 在氧化修饰后形成的ox-LDL,是启动炎症性病理过程重要因素。实验结果显示造模诱导干预下MKR 小鼠FBG、TG、TC及LDL-C水平明显增高,且较ApoE-/-模型组有更稳定的血糖高值、高胰岛素血症及胰岛素抵抗状态,较好地模拟代谢紊乱状态下粥样斑块形成过程。同时粥样斑块的形成是一个慢性炎症反应的过程,炎症可引起斑块不稳定。CRP、TNF-α、IL-1β及IL-18等炎症因子在动脉粥样硬化斑块处沉积且沉积的范围与斑块的不稳定性呈正相关已被多数研究证实:CRP作为机体炎症及感染敏感指标,可调节血管壁炎症反应,同时参与补体激活及巨噬细胞泡沫化[16];TNF-α由单核巨噬细胞释放,介导粥样斑块形成中的免疫炎症反应,在趋化因子的刺激下促进血小板黏附及脂质蓄积[17];IL-1β 可通过上调免疫效应(活化Th1、Th17和体液免疫),促进炎症局部释放及血栓形成;IL-18水平增高可刺激干扰素γ 释放,活化中心粒细胞、巨噬细胞及黏附分子对血管内皮细胞产生损伤[18]。MKR 模型组小鼠血清出现明显的炎症因子含量增高,反映了模型炎症释放的病理特点。同时,斑块纤维帽的厚薄程度和完整性是评估斑块稳定性重要因素。胶原是纤维帽的重要组成成分,机体内MMPs一旦被激活,整个细胞外基质能够被其分解,其中明胶酶MMP-9表达水平对预测易损性斑块具有较高的敏感性和特异性。TIMPs 作为MMPs 的天然抑制剂,其作用是抑制MMPs的活化,延缓动脉粥样硬化的形成和进展,MMPs 和TIMPs 表达的平衡直接影响斑块稳定性。本研究的免疫组化结果显示,MKR 模型组动脉管壁及斑块内MMP-9 的阳性表达量明显升高,同时TIMP-1的表达下调,引起MMP-9/TIMP-1的失衡状态,细胞外基质降解,促进斑块不稳定。
综上所述,MKR 模型组小鼠具备高血糖状态持续和糖尿病加速动脉粥样硬化的病理过程,且上述作用对医学干预不抗拒,可在2 型糖尿病动脉粥样硬化的实验研究中使用。

