谷氨酸草酰乙酸转氨酶抑制脑损伤后炎症反应的研究
张岱男 周世芳 肖 萌 马顺昌△
1)首都医科大学附属北京天坛医院,北京 100070 2)河南省神经修复重点实验室(新乡医学院第一附属医院),河南 卫辉 453100
创伤性颅脑损伤(traumatic brain injury,TBI)是最常见的神经系统损伤性疾病之一,仅次于四肢伤,主要因交通事故和暴力事件所致,对人类生命及生活质量造成严重威胁。按照TBI发生的时间和类型可分为原发性(直接)颅脑损伤和继发性(间接)颅脑损伤,继发性颅脑损伤引起的兴奋性氨基酸毒性、颅内高压、脑组织缺血缺氧、脑能量代谢紊乱等是导致后期高致死率、高致残率的常见原因,与患者预后密切相关[1-2]。谷氨酸(GLU)作为中枢神经系统重要的快速兴奋性神经递质,过量产生可经N-甲基-D-天门冬氨酸盐(NMDA)受体引起钙离子超载与非NMDA受体通路增加炎症损伤,加重神经功能损害、脑水肿和神经细胞凋亡等改变,是造成继发性脑损伤病情加重的主要原因。TBI后炎性因子,如肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)表达升高介导的炎症反应在继发性颅脑损伤中发挥重要作用[3]。因此,如何寻找可靠的治疗手段减轻炎症反应,从而减少神经细胞变性、坏死,减轻继发性脑损伤,提高患者的生存率,已成为神经科学领域研究的热点和难点[4]。GLU与草酰乙酸(OxA)经谷氨酸草酰乙酸转氨酶(GOT)催化产生天冬氨酸与α-酮戊二酸。研究发现,GOT降低外周血中谷氨酸浓度,是通过增强跨血脑屏障的谷氨酸稳态加速中枢神经系统的谷氨酸清除,进而降低其兴奋性毒性,产生神经保护作用[5-6]。研究表明,GOT在缺血再灌注大鼠模型中减少梗死面积并短暂消除长时程增强(LTP)的抑制[7-8]。此外,GOT在卒中、阿尔茨海默病及其他神经退行性疾病的动物模型中均具有良好的神经保护作用[9-11],但其对TBI患者中枢系统炎症反应的影响目前尚不明确。本研究通过构建TBI大鼠闭合性颅脑损伤模型,观察炎性细胞因子的释放是否具有时间依从性,探讨GOT能否抑制TBI后继发性脑损伤的炎症反应,以及向临床转化的潜力。
1 材料和方法
1.1实验动物分组及药物干预健康成年雄性SD大鼠36只,体质量250~300 g,购自北京维通利华有限公司。将大鼠随机分为3组,对照组(Sham组)12只,脑损伤组(TBI组)12只,GOT给药组(GOT+TBI组)12只。TBI+GOT组经颈部皮下注射GOT 0.3 mg/kg,1次/d,连续注射1周;Sham组和TBI组注射等量生理盐水,注射方式和注射次数与TBI+GOT组保持一致。
1.2大鼠脑损伤模型制作利用改良Feeney DM自由落体硬膜外撞击法制作TBI模型:氯胺酮60 mg/kg腹腔注射麻醉SD大鼠,俯卧位固定,剃去大鼠毛发,消毒,沿中缝位置切开头部皮肤,剥离软组织和骨膜,于颅骨中线右侧旁3 mm、人字缝前3 mm开一5 mm的圆形骨孔,硬膜保持完好,利用自由落体打击装置,将50 g砝码从20 cm高处落下,撞击置于硬脑膜上的圆锥,使其发生脑损伤,骨蜡封闭后,缝合头皮。Sham组不做撞击。
1.3标本制备模型制作成功后,分别于12 h、1 d、3 d、5 d取标本。在不同的时间点处死大鼠,取损伤的大脑组织,按照脑湿质量∶生理盐水=1∶9的比例加入预冷的生理盐水,冰上研磨,制备脑组织匀浆,3 000 r/min、4℃离心15 min,取上清液,80℃保存备用。
1.4检测方法ELISA检测细胞炎症因子TNF-α和IL-6的表达,按照试剂盒说明数书操作,加样后,封板于37℃敷育90 min,洗3次,加入Biotinylated antibody工作液,37℃敷育90 min,洗3次,加入streptavidin-HRP工作液37℃敷育30 min,洗3次,加入TMB,37℃避光敷育5~30 min,期间观察显色情况,加入Stop solution,酶标仪检测在450 nm处的各孔光密度(optical density,OD)。绘制标准曲线计算样本中TNF-α和IL-6的浓度。
2 结果
ELISA检测GOT对SD大鼠TBI后炎性因子的影响,与Sham组相比,TBI和TBI+GOT组脑组织中IL-6的表达在脑损伤后12 h、24 h显著升高(P<0.05),第3天、第5天回归至Sham组水平;与TBI组比较,TBI+GOT组脑组织中IL-6的表达在脑损伤后12 h、24 h显著降低(P<0.05),第3天、第5天回归至Sham组水平(表1、图1)。与Sham组相比,TBI和TBI+GOT组脑组织中TNF-α的表达在脑损伤后12 h、24 h显著升高(P<0.05),第3天、第5天回归至Sham组水平;与TBI组比较,TBI+GOT组脑组织中TNF-α的表达在脑损伤后12 h、24 h显著降低(P<0.05),第3天、第5天回归至Sham组水平(表2、图2)。
表1 脑损伤12 h、1 d、3 d、5 d后IL-6在脑组织中的浓度变化(pg/g,±s)Table 1 Changes in the concentration of IL-6 in brain tissue after 12h,1d,3d,5d after TBI(pg/g,±s)
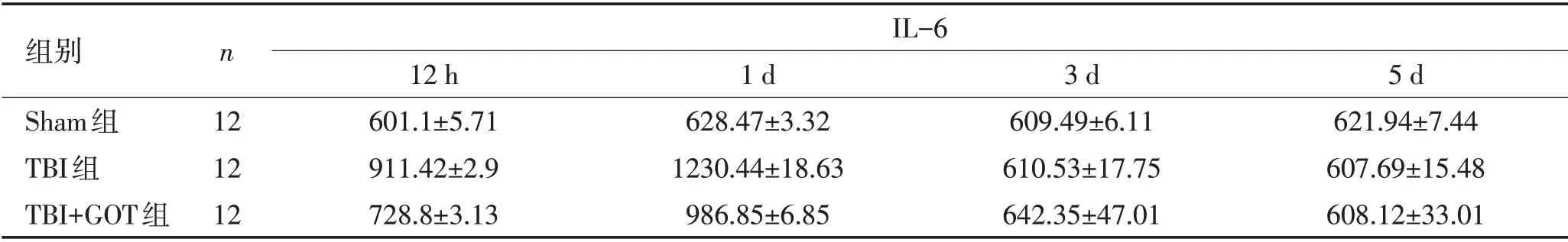
表1 脑损伤12 h、1 d、3 d、5 d后IL-6在脑组织中的浓度变化(pg/g,±s)Table 1 Changes in the concentration of IL-6 in brain tissue after 12h,1d,3d,5d after TBI(pg/g,±s)
组别Sham组TBI组TBI+GOT组n IL-6 12 12 12 12 h 601.1±5.71 911.42±2.9 728.8±3.13 1 d 628.47±3.32 1230.44±18.63 986.85±6.85 3 d 609.49±6.11 610.53±17.75 642.35±47.01 5 d 621.94±7.44 607.69±15.48 608.12±33.01
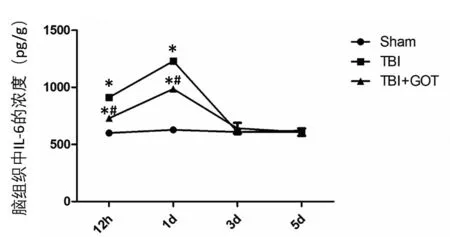
图1 脑损伤12 h、1 d、3 d、5 d后IL-6在脑组织中的浓度变化Figure 1 Changes in the concentration of IL-6 in brain tissue after 12h,1d,3d,5d after TBI
表2 脑损伤12 h、1 d、3 d、5 d后TNF-α在脑组织中的浓度变化(±s,pg/g)Table 2 Changes in the concentration of TNF-αin brain tissue after 12h,1d,3d,5d after TBI(±s,pg/g)

表2 脑损伤12 h、1 d、3 d、5 d后TNF-α在脑组织中的浓度变化(±s,pg/g)Table 2 Changes in the concentration of TNF-αin brain tissue after 12h,1d,3d,5d after TBI(±s,pg/g)
组别Sham组TBI组TBI+GOT组n TNF-α 12 12 12 12 h 716.83±10.6 808.81±3.79 770.39±5.68 1 d 709.27±4.35 1417.95±22.26 1060.72±307.41 3 d 710.83±1.58 723.84±30.15 697.21±15.05 5 d 721.95±4.89 736.15±37.05 704.92±27.28
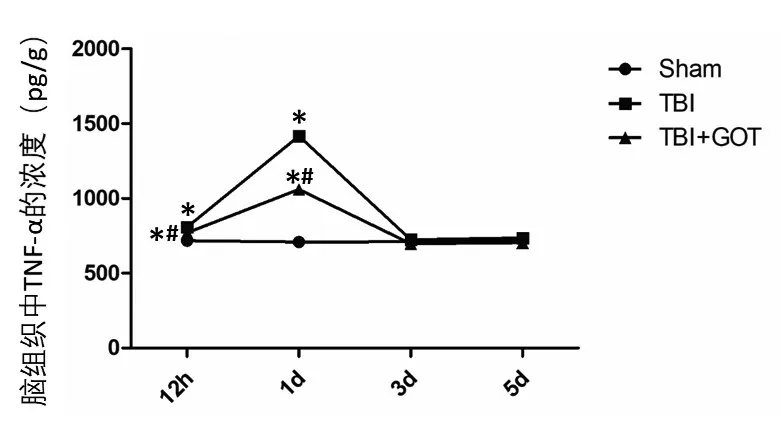
图2脑损伤12 h、1 d、3 d、5 d后TNF-α在脑组织中的浓度变化Figure 2 Changes in the concentration of TNF-αin brain tissue after 12h,1d,3d,5d after TBI
3 讨论
TBI发病率逐年增高,已成为威胁人类生命及生活质量主要的创伤性疾病之一,是45岁以下个体死亡的主要原因[12-13]。TBI后继发性脑损伤对预后具有决定性作用,其病理生理机制复杂,主要包括中枢神经系统能量代谢紊乱、神经功能障碍、颅内高压、脑微循环紊乱等[14-15]。近年来,有学者发现创伤后炎性细胞因子被激活分泌,其介导的炎症反应参与了脑损伤后病理生理演变的全过程[16-17]。因此,寻找可靠的治疗手段减轻炎症反应,减轻继发性脑损伤,提高患者的预后,已成为神经病学及康复医学领域研究的重点[4]。
本课题组前期的研究显示,GOT作为外周谷氨酸清除系统对神经退行性疾病具有潜在的保护作用[9-11],并且发现由GOT和草酰乙酸(Oxa)组成的基于外周血的清除系统在缺血再灌注大鼠模型中减少梗死面积[7-8]。GOT催化外周血谷氨酸与Oxa反应生成天冬氨酸和α-酮戊二酸,该反应为血浆中存在的可逆反应,其反应方向取决于底物间的相对浓度[18-19]。该酶化反应降低外周血中谷氨酸浓度,增加跨血脑屏障浓度梯度,当中枢系统细胞外液谷氨酸浓度病理性升高时,加速谷氨酸由中枢系统向外周转运,从而降低中枢系统兴奋性毒性[5]。
研究发现,颅脑损伤发生后,短时间内即可启动炎症反应,活化的小胶质细胞、巨噬细胞和中性粒细胞释放各种炎性细胞因子,如TNF-α、IL-6,破坏血脑屏障,损伤血管内皮细胞,是导致继发性脑损伤的重要原因[20-21]。此外,TBI后炎性细胞因子的超量表达还可导致钙离子超载、氧化应激、细胞凋亡等损害性级联反应,最终引起神经细胞的变性、坏死;其表达水平对创伤后病情评估、治疗措施及预后都具有重要价值[22]。TNF-α是TBI后早期释放的炎性因子,在中枢神经系统内主要由活化的巨噬细胞和T细胞产生,可激活小胶质细胞和星形胶质细胞,引起脑组织过度免疫损伤导致严重的神经毒性,加速神经细胞的变性、坏死[23]。IL-6在中枢神经系统内主要由有核细胞产生,如神经胶质细胞、B细胞、T细胞、血管内皮细胞等,其作为一种重要的炎性介质,在损伤早期的脑组织中显著增高,参与继发性脑损伤的过程[24]。TBI后血脑屏障受到破坏,外周血中的TNF-α和IL-6细胞因子通过受损的血脑屏障进入脑组织,同时中枢神经系统中星形胶质细胞和小胶质细胞分泌大量炎性细胞因子,导致中枢神经系统的炎性因子快速升高,激活损伤级联反应,介导免疫损伤,脑血管微环境改变,毛细血管通透性增加,形成恶性循环,进一步加速神经细胞死亡[25-26]。本研究发现,颅脑损伤后脑组织炎性因子TNF-α和IL-6的表达水平显著升高,24 h达到高峰,并于3 d后降低,其变化具有时间依从性。而给予GOT治疗后TNF-α和IL-6的表达水平在12 h、24 h明显降低,说明TNF-α、IL-6参与了TBI后的继发性炎症反应,且GOT干预后减少了脑组织炎性因子的释放,抑制了大鼠中枢神经系统炎症反应。
本实验通过Feeney DM自由落体撞击法制备TBI模型很好地模拟了临床工作中TBI的损伤特点,研究发现TBI后脑组织炎性因子的释放具有时间依从性,GOT能够降低TBI后中枢神经系统炎性因子TNF-α、IL-6的表达水平。GOT可以减轻创伤性脑损伤后的中枢系统炎症反应,可能有助于减轻继发性脑损伤,改善预后。

