丁型肝炎动物模型的研究进展
姚婷 臧国庆 陈小华
丁型肝炎是慢性病毒性肝炎的最严重形式,高达70%的病人可发展为肝硬化,增加肝细胞癌的风险[1]。 全球超过2.5亿人感染HBV, 其中约有1 300万合并HDV感染[2]。HBV/HDV共感染致病机制尚待阐明,干扰素作为目前常用药物,疗效甚微且副作用多[3]。虽然还有其他药物可用于治疗HDV,但是治疗方法远未令人满意,因此迫切需要新的治疗方法用于丁型肝炎抗病毒治疗。理想动物模型能深入研究病毒的感染过程、病理生理机制以及药物或者疫苗研发,因此,本文对现有的各种HDV动物模型的优缺点及其应用价值进行综述。
一、HDV介绍
HDV为环状负性RNA病毒,约有1 700个核苷酸,约70%的碱基配对形成双链杆状结构(图1),通过宿主RNA聚合酶Ⅱ复制病毒基因组,需要HBV表面抗原(HBsAg)进行病毒装配和传播,通过人牛磺胆酸钠共转运多肽(humanbile acids transportersodium taurocholate co-transporting polypeptide,hNTCP)感染肝细胞,具有嗜肝性[4]。HDV仅有一个开放阅读框架,编码HDAg,该蛋白有2种形式,一为由195个氨基酸残基组成的24kDa小蛋白(S-HDAg),二为由214个氨基酸组成的27kDa大蛋白(L-HDAg)[5]。
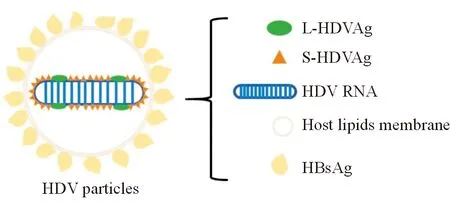
图1 HDV组成图
HDV有8个基因型,呈不同区域分布,我国主要流行基因I型和II型,属低流行区域[6]。聚乙二醇干扰素α是目前治疗HDV的主要药物,利巴韦林、拉米夫定、核苷类似物也有一定治疗作用,抑制L-HDVAg异戊烯化的药物或阻断NTCP受体的药物有望成为治疗丁型肝炎的新型药物[1-2,5]。
二、HDV感染动物模型
(一)天然动物模型 HBV和HDV具有物种特异性,仅感染人类,高等灵长类动物和树鼩[7],常见实验动物对HBV和HDV具有天然抵抗力[4-5]。黑猩猩作为具有免疫能力的HDV感染动物模型存在价格昂贵及伦理问题,未能广泛应用于实验研究[8];对于树鼩和其他未充分研究的物种,存在研究试剂缺乏、研究数据有限等问题[9]。土拨鼠肝炎病毒(WHV)具有与HBV相似的基因组、病毒体、复制机制及感染途径,并诱发肝细胞癌(HCC),因此WHV常用来替代研究HBV感染的相关发病机制、抗病毒及抗肿瘤的研究[8]。在土拨鼠模型中,观察到与患者体内一样的病毒复制现象:在HDV复制高峰期,HBV和WHV复制均受到抑制,同时发现环孢素A具有抗病毒作用[9]。鸭肝炎病毒的包膜蛋白不能包封HDV核糖核蛋白,因此不能协助HDV传播[10]。与近交系小鼠等常见的实验动物相比,天然动物模型一致性较差。
(二)转基因模型 利用转基因技术可以直接构建在肝脏中表达S-HDAg或L-HDAg的转基因小鼠。虽然这些动物能表达HDAg,但血清转氨酶水平一直处于正常范围,未发现明显的生物学或组织病理学证据提示肝脏疾病[11]。在HBV感染的基础上发生HDV重叠感染是丁型肝炎常见的发病形式,于是有人将HBV转基因小鼠和HDV转基因小鼠杂交,也未发现明显的肝脏损伤证据[7, 12]。hNTCP被发现是HDV的功能受体[12],hNTCP转基因模型随之出现(图2 A)。已有研究在小鼠、大鼠、犬、猪等肝细胞中成功表达hNTCP,促进了HDV感染模型的建立[13]。然而该模型只能维持非常短暂的HDV病毒血症,HBV也无法感染肝细胞,由此该模型无法用来研究HBV/HDV共感染的发病机制[14]。据推测,HBV入胞可能除了需要hNTCP之外,还需要其他人类肝细胞特异性因子的辅助[15]。同时只有小于17 d的hNTCP转基因幼鼠才能实现HDV感染,而此时小鼠的免疫系统还未发育成熟,因此用该模型来研究机体免疫系统对HDV的抗病毒作用仍不适用[9]。相比于免疫缺陷型人源化小鼠,hNTCP转基因小鼠的易于操作,具有一致性。利用此模型,研究人员证明HDV感染可被识别HBV包膜蛋白的S1或S结构域的单克隆抗体阻断,进一步说明了前S1和hNTCP之间的相互作用是HDV入胞的关键[12,15-16]。有研究者还对该模型进行了改进,将HBsAg结合的3个NTCP残基人源化,由此创造出HBV和HDV共同感染的条件,而且能在免疫系统发育完全的成年小鼠上完成。但是在HDV表达蛋白和复制基因组的第6天,HBV便丧失入胞能力[17],因此限制了HBV/HDV共同感染的研究。
(三)基于载体的模型 基于载体构造HDV模型主要为尾静脉注射重组质粒或病毒。这种载体模型相比于其他模型的突出的优点是能引入具有任何所需突变或基因型的HDV基因组,从而评估突变及不同基因型的发病机制,但是由于小鼠不是HBV和HDV的天然宿主,不能完全模拟病毒的复制周期,新产生的病毒颗粒不能重新感染肝细胞[18]。
Bruno B. Bordier等将分别带有HDV基因型I和Ⅲ的1.2倍全长基因组的质粒通过尾静脉注入HBV转基因鼠体内,并且在小鼠体内成功检测到HDV病毒血症(图2 B)[19]。然而,有学者发现基因组和反基因组HDV RNA的增加持续两周后,从第15天到第30天,HDV RNA逐渐减少。同时,在这些动物的血清中未检测到抗HDV抗体,这可能是HBV转基因小鼠处于免疫耐受的状态。该模型主要应用范围包括:1. HBV转基因小鼠对病毒抗原具有免疫耐受性,可以模拟慢性乙型肝炎的HDV重叠感染;2. 该模型可用来研究宿主与病毒之间的相互作用[8]。3. 该模型可以用来研究病毒的组装及释放。
利用腺病毒为载体,Lester等将重组的HBV和HDV基因组注射入小鼠体内(图2C),注射后的第7天,小鼠血清中检测到HBV和HDV基因组;病毒血症在第21天达到高峰,第45天开始下降,但是在第21天时病毒颗粒就丧失传染性,具体原因尚未明确,猜测可能是第21天时小鼠产生了HBsAg抗体限制了HDV的传染性[13]。腺病毒重组HDV可以在无HBV的存在下感染肝细胞,但是病毒组装成具有传染性的病毒颗粒时必须有HBV的存在。该研究进一步证实了HBV/HDV共同感染时HBV的病毒载量减少;相对与HDV单独感染,抗HDAg水平减低[20]。对于二者现象的推测为HDV竞争性消耗HBsAg,导致HBV病毒量下降;HDAg被包含在病毒颗粒中,减少了与B细胞的接触,导致抗体量下降[9]。总之,以腺病毒为载体的HDV模型可以用来研究疾病的发生发展及免疫应答,同时通过改变病毒的基因组确定病毒感染中的关键元件[13]。
(四)人源化小鼠 免疫缺陷小鼠通过转基因技术诱导小鼠肝脏遭受严重的损伤,然后通过移植人类原代肝细胞生长出带有人类肝细胞的小鼠肝脏。HDV感染模型的建立大约需要移植占整个肝脏组织40%~60%的人原代肝细胞,即约3×107个原代肝细胞/只。通过尾静脉注射丁型肝炎患者血清,实现丁型肝炎的感染病程(图2 D),大约6周后HDV RNA的拷贝数大约在106/mL[21]。该模型在固有免疫研究中展示出较高的应用价值,证实了高水平的干扰素刺激因子、炎症因子及前纤维化细胞因子与HDV引起重症肝炎有关[22]。同时可以研究重叠感染HDV对HBV的影响——高滴度(>8 log IU/mL)或长时间的HDV感染可能触发HDV诱导的HBV抑制[23]。该模型有以下几点不足:1. 人原代肝细胞无法在体内外增殖,限制了可利用动物的数量; 2. 人原代肝细胞离体后会迅速去分化,从而失去NTCP的表达,降低对HBV感染的敏感性;3. 人类肝细胞植入的小鼠免疫功能缺陷,因此无法用于分析病毒-宿主免疫之间的相互作用研究;4. 该模型耗时长,技术复杂,成本高[7]。
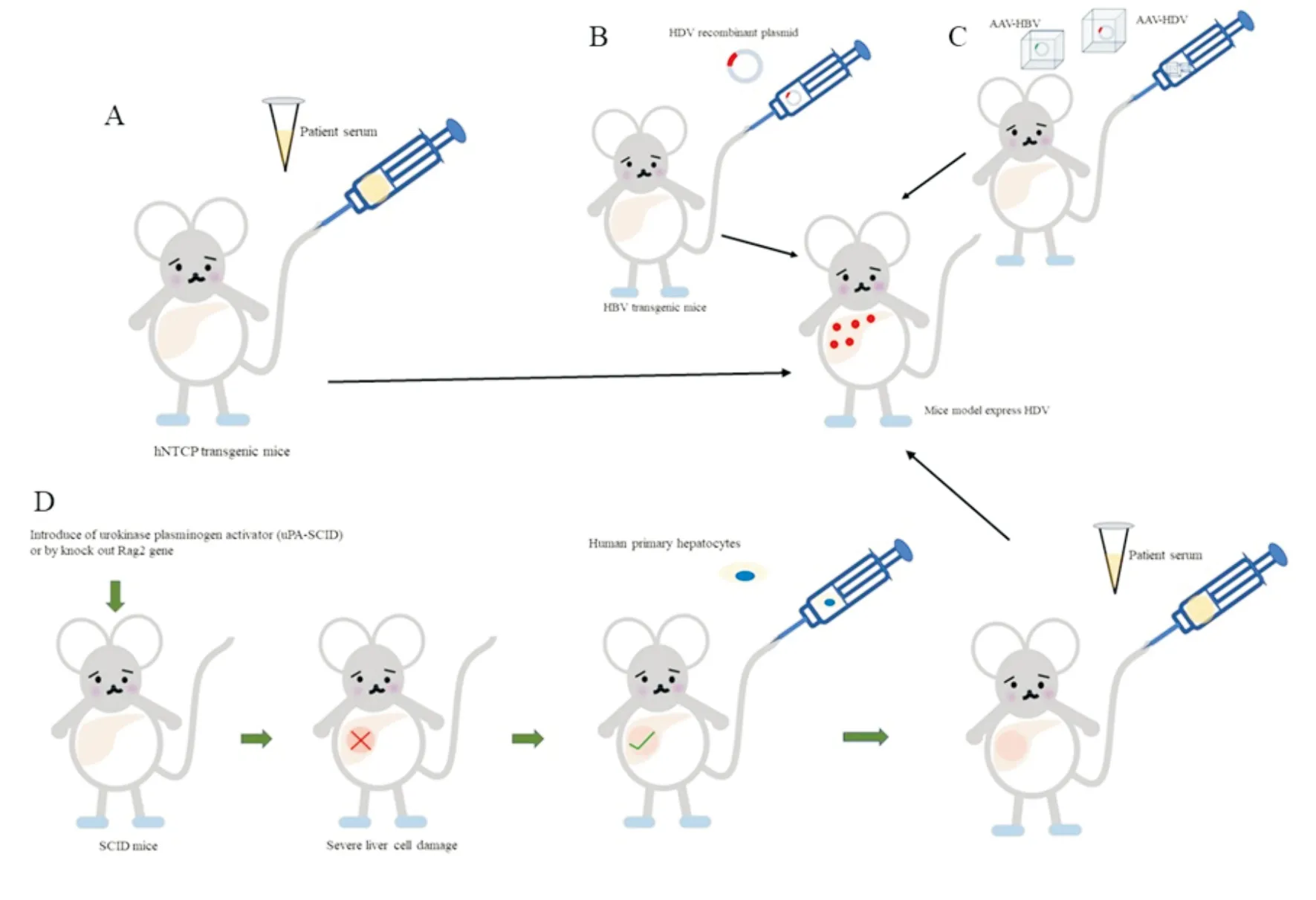
图2 各HDV模型的构造示意图

表1 HDV感染模型特点比较
三、前景与展望
HDV动物模型为研究HDV的复制过程、病理机制、药物研究及疫苗的研发等领域提供了重要研究平台,但是迄今为止开发的模型尚不能完全呈现HDV感染的所有特征,而且利用鼠类进行研究存在物种差异性等问题。寻找理想的HDV感染动物模型可为丁型肝炎发病机制研究及药物研发提供新的思路与平台。

