应用高通量测序分析常温贮藏吴山贡鹅的细菌多样性
朱东喜 邓洁莹 王志琦 汪洋 李沛军 徐宝才


摘 要:運用传统培养技术结合高通量测序技术对常温贮藏吴山贡鹅的菌群结构进行分析,研究吴山贡鹅微生物群落的变化以及导致吴山贡鹅腐败的微生物分布。结果表明:吴山贡鹅贮藏期间pH值呈现先上升后下降的趋势,菌落总数则呈现上升的趋势,贮藏末期吴山贡鹅中菌落总数、乳酸菌、大肠杆菌和假单胞菌的数量分别达到5.76、5.21、2.13、2.96 (lg(CFU/g));高通量测序分析表明,在门水平上,贮藏初期和中期,吴山贡鹅中的优势菌门均为变形菌门,其相对丰度分别达到88%(初期)和87%(中期),贮藏末期的优势菌门为厚壁菌门,相对丰度84%,在属水平上,吴山贡鹅贮藏初期和中期相对丰度最高的均为假单胞菌属和根瘤菌属,假单胞菌属相对丰度分别达到25%(初期)和34%(中期),根瘤菌属相对丰度分别达到25%(初期)和20%(中期),贮藏末期的优势菌属为副梭菌属(50%)和魏斯氏菌属(31%);同时,吴山贡鹅贮藏期间微生物的多样性分析结果表明,贮藏末期微生物的多样性与前期、中期有显著性差异;对微生物基因功能进行预测,得到吴山贡鹅贮藏初期、中期和末期的菌群功能基因相似,主要涉及包括氨基酸代谢和碳水化合物代谢在内的代谢途径等。
关键词:吴山贡鹅;传统培养;高通量测序;微生物分布;优势腐败微生物
High-Throughput Sequencing Analysis of Bacterial Diversity in Wushan Marinated Goose Stored at Room Temperature
ZHU Dongxi, DENG Jieying, WANG Zhiqi, WANG Yang, LI Peijun, XU Baocai*
(China Light Industry Key Laboratory of Meat Microbial Control and Utilization, School of Food and Bioengineering,
Hefei University of Technology, Hefei 230009, China)
Abstract: In this study, traditional culture method combined with high-throughput sequencing was used to analyze the microbial community structure in Wushan marinated goose stored at room temperature. The aim was to study the change of the microbial community during the storage of Wushan marinated goose and the distribution of microorganisms that caused its spoilage. During storage, the pH of Wushan marinated goose presented a trend of rising firstly and then falling, and the total plate count exhibited a continuous upward trend. At the end of storage, the total plate count, and the numbers of lactic acid bacteria, Escherichia coli and Pseudomonas reached 5.76, 5.21, 2.13 and 2.96 (lg (CFU/g)), respectively. High-throughput sequencing showed that Proteobacteria was the dominant phylum at the early and middle stages of storage with relative abundance of 88% and 87%, respectively, while Firmicutes was dominant at the late stage with relative abundance of 84%. Pseudomonas and Rhizobium were the most abundant genera at the early and middle stages with relative abundance of 25% and 34% for Pseudomonas and of 25% and 20% for Rhizobium, respectively, whereas Paraclostridium (50%) and Weissella (31%) were the dominant bacteria at the late stage. The microbial diversity at the late stage of storage was significantly different from that at the early and middle stages. The gene function prediction of the microbial community indicated that the functional gene profiles at the three stages of storage were similar to each other, mainly involved in the amino acid metabolism and carbohydrate metabolism pathways.
Keywords: Wushan marinated goose; traditional culture method; high-throughput sequencing; microbial distribution; dominant spoilage organism
DOI:10.7506/rlyj1001-8123-20210316-074
中图分类号:TS251.6 文献标志码:A 文章编号:1001-8123(2021)04-0030-07
引文格式:
朱东喜, 邓洁莹, 王志琦, 等. 应用高通量测序分析常温贮藏吴山贡鹅的细菌多样性[J]. 肉类研究, 2021, 35(4): 30-36. DOI:10.7506/rlyj1001-8123-20210316-074. http://www.rlyj.net.cn
ZHU Dongxi, DENG Jieying, WANG Zhiqi, et al. High-throughput sequencing analysis of bacterial diversity in Wushan marinated goose stored at room temperature[J]. Meat Research, 2021, 35(4): 30-36. DOI:10.7506/rlyj1001-8123-20210316-074.
http://www.rlyj.net.cn
鹅肉营养丰富,富含人体必需的多种营养物质,并且脂肪含量很低,不饱和脂肪酸含量较高[1-2],在2002年
被联合国粮农组织列为21世纪重点发展的绿色食品之一。中医理论认为,鹅肉味甘平,有补阴益气、暖胃开津、祛风湿、防衰老之效,是中医食疗的上品,对人体健康十分有益[3]。在国内,鹅肉的市场比较小,现有的鹅肉产品通常只在本地销售,包括风干鹅、盐水鹅、烧鹅等。吴山贡鹅作为安徽地区有名的徽菜,具有色清正、香浓郁、味鲜美等特点,深受消费者的喜爱[4]。但是,由于吴山贡鹅多为未经杀菌的即食产品,贮藏期很短,尤其在常温贮藏的条件下极易腐败变质。因此,研究吴山贡鹅在常温贮藏过程中的微生物多样性是控制细菌繁殖、延长货架期的基础。
目前,国内外对鹅肉贮藏期间的微生物多样性研究较少。Kaban等[5]对干腌鹅的微生物特性和挥发性有机化合物进行分析,结果表明,乳酸菌、微球菌和葡萄球菌是微生物群的重要组成部分且在一定程度上影响产品中挥发性有机化合物的形成。张晓春等[6]研究真空包装后在14~16 ℃条件下贮藏0~4 d的荣昌卤鹅中的菌相变化,得出荣昌卤鹅贮藏后期腐败变质的优势菌主要是肠杆菌与乳酸菌。另外,郑玉玺等[7]研究不同温度贮藏条件下导致广式烧鹅腐败变质及新鲜度急剧下降的微生物,确定葡萄球菌属、乳酸片球菌和芽孢杆菌属为优势腐败菌。以上研究采用传统培养方法对鹅肉中的微生物进行分析研究,但是自然界中可以通过传统培养分离获得的微生物只占极少部分[8],所以传统分离培养方法在微生物群落和多样性分析方面仍具有较大的局限性[9]。近年来,高通量技术在食品微生物群体特性的研究方面具有越来越广阔的前景,相比传统的微生物研究方法具有更高的通量、更高的分辨率及更快的速度等[10],同时,近年来开始被应用于各种肉类和及其产品中的微生物多样性和种群动态研究[11-12],但是对酱卤肉制品研究较少。
本研究以吴山贡鹅为研究对象,采用传统培养和高通量测序相结合的方法研究其在常温贮藏下的细菌分布和多样性的变化,确定常温贮藏条件下的货架期以及优势腐败微生物,为后续酱卤肉制品保鲜和抑菌技术的发展提供理论依据。
1 材料与方法
1.1 材料与试剂
吴山贡鹅均采购于安徽省合肥市吴山贡鹅酒店管理公司。吴山贡鹅通常选用1 年左右的公皖西白鹅,采用秘制卤水先大火煮熟再经微火慢煮得到鹅肉成品。
乳酸菌选择性培养基(MRS)、结晶紫中性红胆盐葡萄糖琼脂(VRBGA)、平板计数琼脂(PCA)、假單胞菌选择性培养基(CFC) 青岛海博生物有限公司;氯化钠、氯化钾、氧化镁、硼酸、溴甲酚绿、甲基红、琼脂糖(均为化学纯) 国药集团化学试剂(上海)有限公司;十六烷基三甲基溴化铵(hexadecyltrimethylammonium bromide,CTAB)、引物、Phusion Master Mix(2×)、TAE电泳缓冲液
生工生物工程(上海)有限公司。
1.2 仪器与设备
SevenCompact pH计 梅特勒-托利多仪器(上海)有限公司;SW-CJ-1FD超净工作台 苏州安泰空气技术有限公司;RSD-250振荡培养箱 上海博迅实业有限公司医疗设备厂;SCIENTZ-09无菌均质器 宁波新芝生物科技股份有限公司;YX280手提式不锈钢压力蒸汽灭菌器 上海三申医疗器械有限公司。
1.3 方法
1.3.1 样品处理
吴山贡鹅卤制完成后1 h内将其放入装有融冰的保温箱中运送到实验室,随后进行真空包装,在室温(20±2) ℃下贮藏,于贮藏0、12、24、36、48 h取样测定各理化指标。取贮藏时间为0、24、48 h的样品分别记为ZM(初期)、FM(中期)和EM(末期),进行高通量测序。每个时间点样品均设3 个平行,独立重复实验3 次(以数字编号1/2/3表示)。
1.3.2 pH值测定
按照GB/T 9695.5—2008《肉与肉制品 pH测定》[13]的方法进行测定。
1.3.3 微生物计数
菌落总数:采用GB 4789.2—2016《食品安全国家标准 食品微生物学检验 菌落总数测定》[14]中的方法计数;乳酸菌:采用GB 4789.35—2016《食品安全国家标准 食品微生物学检验 乳酸菌检验》[15]中的方法计数;大肠菌群:采用GB 4789.3—2016《食品安全国家标准 食品微生物学检验 大肠菌群计数》[16]中的方法计数;假单胞菌:参照张玉华等[17]的方法进行计数。
1.3.4 微生物总DNA的提取
采用CTAB法[18-19]提取细菌基因组DNA,之后利用琼脂糖凝胶电泳检测DNA的純度和浓度。取适量的DNA样品于离心管中,使用无菌水稀释样品至
1 ng/?L。以上述稀释后的DNA为模板,以515F(5-GTTTCGGTGCCAGCMGCCGCGGTAA-3)和806R(GCCAATGGACTACHVGGGTWTCTAAT)为引物,进行聚合酶链式反应(polymerase chain reaction,PCR)扩增。
PCR反应体系(30 ?L):Phusion Master Mix(2×)15 ?L、引物(2 ?mol/L)3 ?L、gDNA(基因组DNA)(1 ng/?L)10 ?L、H2O 2 ?L。
PCR反应程序:98 ℃预变性1 min;98 ℃、10 s,50 ℃、30 s,72 ℃、30 s,30 个循环;72 ℃、5 min。根据PCR产物浓度进行等浓度混样,充分混匀后使用1×TAE浓度2%的琼脂糖凝胶电泳纯化PCR产物,选择主带大小400~450 bp的序列,割胶回收目标条带。以Thermo Scientific公司GeneJET胶回收试剂盒回收产物。Illumina Miseq高通量测序工作由北京诺禾致源生物信息科技有限公司完成。
1.3.5 测序数据处理
首先对原始数据进行拼接、过滤,得到有效数据(Clean Data),基于有效数据进行操作分类单元(operational taxonomic units,OTUs)聚类和物种分类分析。用Mothur方法与SILVA数据库[20]的SSUrRNA数据库[21]
进行物种注释分析(设定阈值为0.8~1.0),获得分类学信息并分别在各分类水平统计各样本的群落组成,使用MUSCLE软件(Version 3.8.31,http://www.drive5.com/muscle/)进行快速多序列比对,得到所有OTUs序列的系统发生关系[22]。以数据量最少的样本作为标准,进行均一化处理,基于均一化处理后数据进行Alpha多样性分析和Beta多样性分析。使用QIIME软件(Version 1.9.1)计算Chao1、Shannon、ACE指数和样本覆盖率。使用R软件(Version 2.15.3)绘制稀释曲线、等级聚类曲线和主坐标分析(principal co-ordinates analysis,PCoA)图,并进行Alpha多样性指数组间差异分析和PCoA。用QIIME软件(Version 1.9.1)计算UniFrac距离,然后,利用OTUs的丰度信息对Unweighted UniFrac距离进一步构建Weighted UniFrac距离,用Weighted UniFrac距离和Unweighted UniFrac距离2 个指标衡量2 个样本间的相异系数。最后,通过基于最小16S rRNA序列相似度的最近邻法实现Tax4Fun功能预测。
1.4 数据处理
理化实验和微生物实验数据经3 次平行实验后得到,结果表示为平均值±标准差。SPSS 17.0和Microsoft Excel 2010软件用于数据分析,使用GraphPad Prism 8.4.2软件绘图。使用单因素方差分析确定2 组数据的差异显著性,P<0.05为差异显著。
2 结果与分析
2.1 吴山贡鹅贮藏过程中pH值和微生物数量变化
肉制品贮藏过程中由于微生物的分解代谢作用造成有机营养物质的降解,监测pH值的变化能够表征肉制品的腐败程度。由表1可知,吴山贡鹅贮藏过程中,pH值首先由6.21(0 h)显著上升到6.46(24 h)(P<0.05),贮藏24~48 h,pH值略有下降,从6.46降低到6.12。贮藏前期升高的原因可能是氨基酸被分解为相应的碱性物质,而在贮藏后期可能是由于优势微生物(乳酸菌等)的生长与分解导致pH值降低。贮藏期间,吴山贡鹅的pH值呈先上升后下降的趋势,此结果与常温贮藏牛肉pH值的变化结果一致[23]。
贮藏0 h时,吴山贡鹅的菌落总数和乳酸菌数分别为3.38、3.20 (lg(CFU/g)),大肠杆菌未检出(<2(1g(CFU/g)),表明新鲜吴山贡鹅菌落总数未超标,符合安全标准。在整个贮藏期内,菌落总数和乳酸菌总数皆呈现上升趋势,贮藏48 h后,菌落总数和乳酸菌总数分别达到5.76、5.21 (1g(CFU/g)),已经超过国家标准规定的菌落总数范围(5 (1g(CFU/g)))[24]。
大肠杆菌在贮藏48 h时被检出,达到2.13 (1g(CFU/g)),另外假单胞菌数在贮藏期也呈现缓慢上升的趋势,在贮藏末期达到2.96 (1g(CFU/g))。这些结果表明,贮藏期间乳酸菌和假单胞菌存在于新鲜的吴山贡鹅中,随着贮藏时间的延长其数量逐渐增长;至贮藏后期,乳酸菌数量最多,其次是假单胞菌,大肠杆菌最少。
2.2 高通量测序结果分析
2.2.1 细菌丰富性和多样性分析
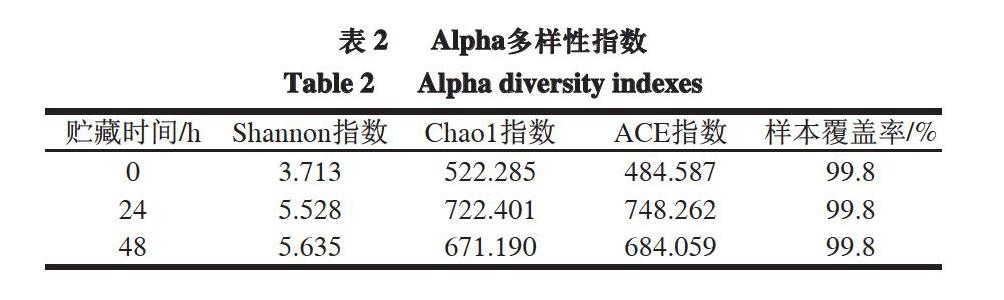
为了研究贮藏期间细菌丰富性和多样性的变化,通过高通量测序分析得到Alpha多样性指数。由表2可知,所有样品的样本覆盖率至少为99%,这表明鹅肉样品中几乎所有细菌都可以被检测到,增加测序数据已无法找到更多的OTU。Chao1指数和ACE指数反映样品微生物种群的丰富度,Shannon指数反映样品微生物种群的多样性,表现微生物种群的均匀度。高通量测序结果表明,吴山贡鹅中细菌的Chao1指数、ACE指数、Shannon指数均在贮藏0 h时最低,分别为522.285、484.587和3.713。Chao1指数和ACE指数在贮藏24 h时最高,分别达到722.401和748.262,而Shannon指数在贮藏48 h最高,达到5.635。因此,常温贮藏的吴山贡鹅在贮藏初期具有最低的微生物种类、多样性和丰富性,而贮藏中期由于多种微生物共同竞争分解利用肉样中的有机营养物质,导致其具有最高的丰富度。相对来说,贮藏末期吴山贡鹅中竞争力较强的微生物通过一系列拮抗或竞争作用,使自身产生更强的适应性,从而占据主导地位,也导致了微生物种群丰富度的下降。
稀释曲线主要反映测序数据量的合理性,并间接反映样本中物种的丰富程度。由图1A可知,当序列数目>50 000时,曲线上各点的斜率均已趋于零,说明测序数据量渐趋合理,更多的数据量只会产生少量新的物种(OTUs)[25]。而等级聚类曲线可直观反映样本中物种的丰富度和均匀度,曲线越宽,样品的物种丰富度越高,曲线越平滑,样品的均匀度越大[26]。由图1B可知,贮藏时间为48 h时曲线宽度最小,且最平滑。因此可以得出贮藏末期的样品微生物物种丰富度最小,分布最均匀,这同样表明了贮藏末期只有少数细菌占据主要地位且有强致腐能力,在吴山贡鹅腐败过程中起到主要作用。
2.2.2 微生物分布
为了解贮藏期间微生物分布,通过高通量测序分析得到细菌在门和属水平的相对丰度。由图2A可知,在门水平上,贮藏初期和中期最主要的细菌为变形菌门(Proteobacteria),平均相对丰度分别约为88%和87%。而贮藏后期,厚壁菌门(Firmicutes)则占据主导,其次是变形菌门,平均相对丰度分别为84%和15%。由图2B可知,在属水平上,贮藏初期和中期假单胞菌属(Pseudomonas)平均相对丰度约为25%和34%,而到贮藏末期则骤减到2%,假单胞菌是严格好氧微生物,在真空环境下生长会受到抑制,通常出现在生鲜肉及水产品贮藏过程中[27-29]。另外,在贮藏初期和中期还观察到含量较高的未经鉴定的根瘤菌(unidentified_Rhizobiaceae),分别占25%和20%,根瘤菌主要存在于土壤及环境中,在食品体系中相关研究很少[30],所以鹅肉中出现这种细菌可能来自包装前土壤或环境的污染。不动杆菌属(Acinetobacter)在贮藏前、中期同样相对丰度较高,分别达到20%和18%,它可利用氨基酸作为生长基质产生酯、酸等物质,在多种食品基质中都有出现,包括泡菜、鱼类、肉类等[31-34]。贮藏后期,优势菌门为厚壁菌门,平均相对丰度达到84%,在属水平上,副梭菌属(Paraclostridium)和魏斯氏菌属(Weissella)占据主导地位,平均相对丰度分别为50%和31%。副梭菌是产芽孢的兼性厌氧菌,可以通过异型发酵产乳酸[35-36],魏斯氏菌是兼性厌氧菌,会导致肉制品表面产生黏液、胀袋等感官劣变,是低温肉制品特定的腐败菌之一。
为了更清楚、直观了解细菌在属水平上的微生物分布,对所有样本的种类和丰度进行分析得到菌群分布热图。由图3可知,在属水平上,不同贮藏时期微生物差异性较大。unidentified_Ruminococcaceae、unidentified_Corynebacteriaceae、罗姆布茨菌(Romboutsia)等为贮藏初期相对丰度较高的菌属,由于其多存在于环境、土壤及动物肠道中[37-39],食品体系较少出现,因此推测它们可能来源于加工污染。贮藏中期,优势菌则变为戈登氏菌(Gordonia)、短杆菌(Brevibacterium)、双歧杆菌(Bifidobacterium)等。贮藏末期,芽孢杆菌属(Bacillus)、魏斯氏菌属、副梭菌属则生长迅速,占据主导地位。其中魏斯氏菌是真空包装低温肉制品中的特定腐败菌之一,能导致产品黏液的产生[40-41],吴山贡鹅在到达贮藏终点时,感官表现为表面有黏液产生,所以魏斯氏菌属可能是导致这种现象的主要原因之一。同样,芽孢杆菌也是肉制品中常见的腐败菌,彭先杰等[42]发现,在37 ℃贮藏条件下腐败的香辣仔鹅,其主要腐败菌为枯草芽孢杆菌。李其轩等[43]的研究表明,肉粉肠在20 ℃条件下贮藏时,托盘包装组的主要腐败菌为贝莱斯芽孢杆菌。Wang Zhaoming等[44]研究得出,德州扒鸡在84 ℃处理条件下货架期结束时芽孢杆菌和梭状芽孢杆菌是其主要腐败菌。这些研究结果都与本研究的菌相结论相似,而且也说明不同肉制品中芽孢杆菌的种类可能存在差异。
2.2.3 微生物差异性分析
为比较不同贮藏期的菌群多样性差异,对吴山贡鹅微生物进行Beta多样性分析。在PCoA图中,各样本点之间的距离可以代表样本的差异大小,距离越近,差异越小。在Beta多样性指数热图中,样本的多样性差异则通过2 个样本之间的相异系数来表示,相异系数越小,差异则越小。
由图4A可知,在PCoA图中,ZM、FM和EM的样本集中在不同区域,ZM和FM距离较近,ZM与EM以及FM与EM的距离较远。因此可以推断出微生物多样性在贮藏初期和中期差别较小,然而贮藏末期与贮藏初期和中期差异较大。由图4B可知,在Beta多样性指数热图中,EM与ZM和FM的相异系数都在0.5左右,而ZM和FM之间的相异系数在0.1左右。因此可以清楚地反映出贮藏后期的细菌多样性与贮藏初期和中期的细菌多样性有较大差距。综合两图可得,在贮藏过程中细菌的多样性是逐渐变化的,尤其到贮藏后期,细菌多样性的变化非常显著,通常表现为多样性变小,物种变集中[45]。
2.2.4 细菌群落的功能预测
在不同贮藏时间吴山贡鹅核心菌群的多样性和分布分析基础上,预测整个贮藏期间微生物的基因功能。依据KEGG(Kyoto encyclopedia of genes and genomes)数据库进行基因功能注释,由图5可知,通过与KEGG数据库进行比对可以看出,吴山贡鹅贮藏过程中菌群高效表达的代谢通路中,与碳水化合物代谢、氨基酸代谢和能量代谢相关的通路最多,注释基因比例分别达到1.93%、1.65%和0.79%。新陈代谢通路是微生物获得营养进行生长繁殖的主要代谢途径,同时也是影响食品品质和风味的主要途径。此外,涉及细菌细胞的膜运输、翻译、复制和修复等的代谢通路也较多,可能是因为这些代谢通路与细菌的生长活动有关。
对已注释基因中的功能基因作进一步分析,由图6可知,不同贮藏时间样品,其预测的菌群功能基因相似,忽略未知功能基因后,主要存在与膜运输、碳水化合物代谢、复制和修复、氨基酸代谢及翻译相关的功能基因。其中的碳水化合物代谢和氨基酸代謝与腐败有较密切的联系,这些代谢活动主要来源于贮藏期间大量存在的乳酸菌、芽孢杆菌等细菌。尤其对于乳酸菌,它可以通过碳水化合物代谢和氨基酸代谢降低pH值[46],产生异味[47],从而导致产品的品质劣变。
3 結 论
通过传统培养与高通量测序相结合的方式研究吴山贡鹅常温贮藏期间的优势腐败菌及微生物群落变化规律。结果表明:在贮藏期间,各种微生物数量均呈现逐渐上升的趋势,乳酸菌在贮藏末期占据主导地位,而菌落总数在贮藏48 h后超过国家标准熟肉微生物限量;此外,pH值则呈现总体下降的趋势,可能是由于乳酸菌的大量生长繁殖使pH值降低;由Illumina MiSeq高通量测序结果结合Alpha和Beta多样性指数可知,随着贮藏时间的延长,微生物群落多样性发生了较大变化,贮藏初期和中期最主要的细菌为假单胞菌、根瘤菌及不动杆菌,到贮藏后期则变为副梭菌、魏斯氏菌属和芽孢杆菌属,均具有较强的代谢能力,从而更有利于对肉的分解利用。由于不动杆菌和根瘤菌多出现在环境中,因此贮藏初期存在这2 种细菌可能是由于生产加工环境的污染,所以企业在生产过程中应当提高卫生标准,减少环境污染。本研究揭示了吴山贡鹅在常温贮藏期间细菌群落的演替,为吴山贡鹅相应抑菌保鲜方法的研究提供了理论依据。
参考文献:
[1] 唐霄, 孙杨赢, 江雪婷, 等. 不同蛋白酶制备鹅肉呈味肽的对比分析[J].
食品科学, 2019, 40(22): 141-146. DOI:10.7506/spkx1002-6630-20181023-272.
[2] ORKUSZ A, HARAF G, OKRUSZEK A, et al. Lipid oxidation and color changes of goose meat stored under vacuum and modified atmosphere conditions[J]. Poultry Science, 2016, 96(3): 731-737. DOI:10.3382/ps/pew325.
[3] 陈藏器. 《本草拾遗》辑释[M]. 尚志钧辑释. 合肥: 安徽科学技术出版社, 2002.
[4] 付萧逸, 熊国远, 谢亮, 等. 吴山贡鹅在卤制过程中的肉品质变化规律研究[J]. 肉类工业, 2018(3): 15-20.
[5] KABAN G, KZLKAYA P, BREKI B S, et al. Microbiological properties and volatile compounds of salted-dried goose[J]. Poultry Science, 2020, 99(4): 2293-2299. DOI:10.1016/j.psj.2019.11.057.
[6] 张晓春, 李星, 解华东, 等. 卤鹅贮藏过程中菌相变化研究[J]. 农产品加工学刊, 2019(11): 61-63. DOI:10.16693/j.cnki.1671-9646(X).2019.11.017.
[7] 郑玉玺, 阮征, 韩明, 等. 不同保藏条件下广式烧鹅新鲜度变化及优势腐败菌的鉴定[J]. 安徽农业科学, 2017, 45(29): 68-71. DOI:10.13989/j.cnki.0517-6611.2017.29.021.
[8] HUGENHOLTZ P, GOEBELl B M, PACE N R. Impact of culture-independent studies on the emerging phylogenetic view of bacterial diversity[J]. Journal of Bacteriology, 1998, 180(24): 4765-4774. DOI:10.1007/BF02672962.
[9] ANGEL A, SZCZESNY P, MAYO B, et al. Biodiversity in oscypek, a traditional polish cheese, determined by culture-dependent and-
independent approaches[J]. Applied and Environmental Microbiology, 2012, 78(6): 1890-1898. DOI:10.1128/AEM.06081-11.
[10] PARK E J, CHUN J, CHA C J, et al. Bacterial community analysis during fermentation of ten representative kinds of kimchi with barcoded pyrosequencing[J]. Food Microbiology, 2012, 30(1):
197-204. DOI:10.1016/j.fm.2011.10.011.
[11] JUAREZ-CASTELAN C, GARCIA-CANO I, ESCOBAR-ZEPEDA A,
et al. Evaluation of the bacterial diversity of Spanish-type chorizo during the ripening process using high-throughput sequencing and physicochemical characterization[J]. Meat Science, 2019, 150: 7-13. DOI:10.1016/j.meatsci.2018.09.001.
[12] PATTERSON M F, MCKAY A M, CONNOLLY M, et al. Effect of high pressure on the microbiological quality of cooked chicken during storage at normal and abuse refrigeration temperatures[J]. Food Microbiology, 2010, 27(2): 266-273. DOI:10.1016/j.fm.2009.10.007.
[13] 中国商业联合会商业标准中心, 国家加工食品质量监督检验中心(广州), 广州市产品质量监督检验所. 肉与肉制品 pH测定: GB/T 9695.5—2008[S]. 北京: 中国标准出版社, 2008: 1-4.
[14] 中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准 食品微生物学检验 菌落总数测定: GB 4789.2—2016[S]. 北京: 中国标准出版社, 2016: 1-4.
[15] 中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准 食品微生物学检验 乳酸菌检验:
GB 4789.35—2016[S]. 北京: 中国标准出版社, 2016: 1-6.
[16] 中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准 食品微生物学检验 大肠菌群计数: GB 4789.3—2016[S]. 北京: 中国标准出版社, 2016: 1-6.
[17] 张玉华, 孟一, 王顺意, 等. 外源AHLs信号分子对假单胞菌(Pseudomonas)致腐能力的影响[J]. 食品与发酵工业, 2020, 46(18): 78-84.
[18] STEWART C, VIA L E. A rapid CTAB DNA isolation technique useful for RAPD fingerprinting and other PCR applications[J]. Biotechniques, 1993, 14(5): 748-750.
[19] VIA L E, FALKINHAM III J O. Comparison of methods for isolation of Mycobacterium avium complex DNA for use in PCR and RAPD fingerprinting[J]. Journal of Microbiological Methods, 1995, 21(2): 151-161. DOI:10.1016/0167-7012(94)00045-9.
[20] EDGAR R C. UPARSE: highly accurate OTU sequences from microbial amplicon reads[J]. Nature Methods, 2013, 10(10): 996-998. DOI:10.1038/NMETH.2604.
[21] WANG Q, GARRITY G M, TIEDJE J M, et al. Naive Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy[J]. Apply Environment Microbioloy, 2007, 73(16): 5261-5267. DOI:10.1128/AEM.00062-07.
[22] QUAST C, PRUESSE E, YILMAZ P, et al. The SILVA ribosomal RNA gene database project: improved data processing and web-based tools[J]. Nucleic Acids Research, 2012, 41(D1): D590-D596. DOI:10.1093/nar/gks1219.
[23] MANSUR A R, SEO D H, SONG E J, et al. Identifying potential spoilage markers in beef stored in chilled air or vacuum packaging by HS-SPME-GC-TOF/MS coupled with multivariate analysis[J]. LWT-Food Science and Technology, 2019, 112: 108256. DOI:10.1016/j.lwt.2019.108256.
[24] 中華人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准 熟肉制品: GB 2726—2016[S]. 北京: 中国标准出版社, 2016.
[25] 王伟, 冷凯良, 刘均忠, 等. 微生物扩增子高通量测序技术在水产品加工与贮藏中的应用[J]. 食品与发酵工业, 2017, 43(10): 263-268. DOI:10.13995/j.cnki.11-1802/ts.014760.
[26] CHAN F T, BRADIE J, BRISKI E, et al. Assessing introduction risk using species rank-abundance distributions[J]. Proceedings of the Royal Society B: Biological Sciences, 2015, 282: 1517. DOI:10.1098/rspb.2014.1517.
[27] NYCHAS G J E, SKANDAMIS P N, TASSOU C C, et al. Meat spoilage during distribution[J]. Meat Science, 2008, 78(1/2): 77-89. DOI:10.1016/j.meatsci.2007.06.020.
[28] ERCOLINI D, FERROCINO I, NASI A, et al. Monitoring of microbial metabolites and bacterial diversity in beef stored under different packaging conditions[J]. Applied and Environmental Microbiology, 2011, 77(20): 7372-7381. DOI:10.1128/AEM.05521-11.
[29] ZHANG Jingbin, LI Yan, LIU Xiaochang, et al. Characterization of the microbial composition and quality of lightly salted grass carp (Ctenopharyngodon idellus) fillets with vacuum or modified atmosphere packaging[J]. International Journal of Food Microbiology, 2018, 293: 87-93. DOI:10.1016/j.ijfoodmicro.2018.12.022.
[30] 陳文峰. 根瘤菌系统学研究进展与展望[J]. 微生物学通报, 2016, 43(5): 1095-1100. DOI:10.13344/j.microbiol.china.150994.
[31] 邹毅辉, 黄红宣, 蔡艺敏, 等. 基于高通量测序分析不同年份闽南腌制萝卜干中细菌多样性[J]. 中国酿造, 2020, 39(5): 40-43. DOI:10.11882/j.issn.0254-5071.2020.05.008.
[32] 史云娇, 刘芳, 孙芝兰, 等. 藏羊肉中优势腐败不动杆菌的分离鉴定及其生物膜形成特性[J]. 江苏农业学报, 2019, 35(1): 195-203. DOI:10.3969/j.issn.1000-4440.2019.01.028.
[33] 刘爱芳, 谢晶, 钱韻芳. 冷藏金枪鱼优势腐败菌致腐败能力[J]. 食品科学, 2018, 39(3): 7-14. DOI:10.7506/spkx1002-6630-201803002.
[34] BEKAERT K, DEVRIESE L, MAES S, et al. Characterization of the dominant bacterial communities during storage of Norway lobster and Norway lobster tails (Nephrops norvegicus) based on 16S rDNA analysis by PCR-DGGE[J]. Food Microbiology, 2015, 46: 132-138. DOI:10.1016/j.fm.2014.06.022.
[35] CHEN Y S, YANAGIDA F, SHINOHARA T. Isolation and identification of lactic acid bacteria from soil using an enrichment procedure[J]. Letters in Applied Microbiology, 2005, 40(3): 195-200. DOI:10.1111/j.1472-765X.2005.01653.x.
[36] LEJA K, MYSZKA K, CZACZYK K. The ability of Clostridium bifermentans strains to lactic acid biosynthesis in various environmental conditions[J]. Springer Plus, 2013, 2(1): 1-8. DOI:10.1186/2193-1801-2-44.
[37] KORSAK N, TAMINIAU B, HUPPERTS C, et al. Assessment of bacterial superficial contamination in classical or ritually slaughtered cattle using metagenetics and microbiological analysis[J]. International Journal of Food Microbiology, 2017, 247: 79-86. DOI:10.1016/j.ijfoodmicro.2016.10.013.
[38] BORTOLUZZI C, SCAPINI L B, RIBEIRO M V, et al. Effects of β-mannanase supplementation on the intestinal microbiota composition of broiler chickens challenged with a coccidiosis vaccine[J]. Livestock Science, 2019, 228: 187-194. DOI:10.1016/j.livsci.2019.09.001.
[39] HUANG Kai, YU Wenwen, LI Sen, et al. Effect of embryo-remaining oat rice on the lipid profile and intestinal microbiota in high-fat diet fed rats[J]. Food Research International, 2019, 129: 108816. DOI:10.1016/j.foodres.2019.108816.
[40] CHENOLL E, MACI?N M, ELIZAQU?VEL P, et al. Lactic acid bacteria associated with vacuum-packed cooked meat product spoilage: population analysis by rDNA-based methods[J]. Journal of Applied Microbiology, 2010, 102(2): 498-508. DOI:10.1111/j.1365-2672.2006.03081.x.
[41] KAMENIK J, DUSKOVA M, ?EDO O, et al. Lactic acid bacteria in hot smoked dry sausage (non-fermented salami): thermal resistance of Weissella viridescens strains isolated from hot smoked dry sausages[J]. LWT-Food Science and Technology, 2015, 61(2):
492-495. DOI:10.1016/j.lwt.2014.12.012.
[42] 彭先杰, 陈崇艳, 袁玉梅, 等. 香辣仔鹅特定腐败菌的分离及鉴定[J]. 中国调味品, 2020, 45(7): 39-43. DOI:10.3969/j.issn.1000-9973.2020.07.010.
[43] 李其轩, 陈倩, 王浩, 等. 不同包装方式对高水分含量肉粉肠微生物菌群及品质特性的影响[J]. 食品科学, 2021, 42(5): 237-245. DOI:10.7506/spkx1002-6630-20200309-142.
[44] WANG Zhaoming, SHI Yuzhu, ZHOU Kai, et al. Effects of different thermal temperatures on the shelf life and microbial diversity of Dezhou-braised chicken[J]. Food Research International, 2020, 136: 109471. DOI:10.1016/j.foodres.2020.109471.
[45] LI Ning, ZHANG Youxiong, WU Qingping, et al. High-throughput sequencing analysis of bacterial community composition and quality characteristics in refrigerated pork during storage[J]. Food Microbiology, 2019, 83: 86-94. DOI:10.1016/j.fm.2019.04.013.
[46] 湯敏, 黄俊逸, 李聪, 等. 冷藏过程中不同包装德州扒鸡的微生物及理化特性[J]. 食品科技, 2020, 45(6): 122-129.
[47] 杨啸吟, 张一敏, 梁荣蓉, 等. 包装冷却肉中微生物腐败及其挥发性气味的研究进展[J]. 食品科学, 2021, 42(1): 285-293. DOI:10.7506/spkx1002-6630-20200207-046.

