基于微滴数字PCR技术建立HBV共价闭合环状DNA的检测方法
田 原, 徐 玲, 范子豪, 曹亚玲, 张向颖, 陈 煜, 段钟平, 任 锋
1 首都医科大学附属北京佑安医院, 北京市肝病研究所, 北京 100069; 2 首都医科大学附属北京佑安医院肝病中心四科, 肝衰竭与人工肝治疗研究北京市重点实验室, 北京 100069
HBV感染是影响全世界人民健康的主要公共卫生问题,有超过2.5亿的HBV感染者,每年因HBV感染所导致的死亡人数大约有88.7万[1-3]。目前,主要的抗病毒药物如核苷(酸)类似物和干扰素α等都不能完全治愈HBV,根本原因在于不能彻底清除共价闭合环状DNA(cccDNA)[4]。HBV cccDNA是病毒RNA复制转录的模板,它能以微染色体的形式长期稳定的存在于肝细胞核内[5]。因此,建立一种有效的检测HBV cccDNA方法,对于临床抗病毒治疗效果的评价和治疗策略的调整都具有重要意义[6]。本研究建立了检测HBV cccDNA的微滴数字PCR(droplet digital PCR,ddPCR)方法。
1 资料与方法
1.1 研究对象 收集2017年6月—2020年10月在本院就诊的20例临床诊断为HBV感染者的肝组织样本。质粒为本实验室构建的pUC-HBV质粒。
1.2 试剂与仪器 QIAamp DNA Mini Kit(50)购自德国QIA-GEN公司;Plasmid-safe ATP-dependent DNase购自美国Lucigen公司;TaqMan Fast Advanced Master Mix购自美国Applied Biosystems公司。新羿TD-1微滴式数字PCR仪购自新羿生物公司。ViiATM7 Real-Time PCR System荧光定量PCR仪购自美国Applied Biosystems公司。
1.3 引物和探针的设计与合成 因为HBV cccDNA是完整的闭合环状DNA,而HBV松弛环状DNA(relaxed circular DNA,rcDNA)存在缺口,所以通过跨越HBV DNA负链缺口设计HBV cccDNA的上下游引物及探针(图1)。引物及探针序列,HBV cccDNA-F:5′-GGGGCGCACCTCTCTTTA-3′;HBV cccDNA-R:5′-AGGCACAGCTTGGAGGC-3′;HBV cccDNA-P:5′-FAM-TCACCTCTGCCTAATCATCTC-TAMRA-3′。

图1 HBV cccDNA与rcDNA结构示意图
根据Gene Bank中提供的β-actin基因序列设计上下游引物和探针,并在PubMed上进行引物序列的比对。引物及探针序列:β-actin-F:5′-ACTGTGCCCATCTACGAGG-3′;β-actin-R:5′-CAGGCAGCTCGTAGCTCTT-3′; β-actin-P:5′-FAM-CGGGAAATCGTGCGTGAC-TAMRA-3′。引物和探针由生工生物工程(上海)股份有限公司合成。
1.4 HBV cccDNA阳性对照质粒的建立 利用设计好的HBV cccDNA引物对HBV质粒扩增,然后纯化回收目的片段,用目的片段与T载体连接,转入JM109大肠杆菌中,再把大肠杆菌放入LB培养基中进行扩增,最后提取质粒。由此得到了HBV cccDNA阳性对照质粒。
1.5 肝组织HBV cccDNA模板的制备 先用QIAamp DNA Mini Kit提取患者肝组织DNA,然后用质粒安全性ATP依赖的DNA酶(plasmid-safe ATP-dependent DNase,PSAD)进行酶切,去除rcDNA等其他形式的DNA。PSAD酶切体系:肝组织DNA产物 8.5 μl、PSAD(10 U/L)0.4 μl、25 mmol/L ATP 0.8 μl、10×Buffer 2 μl,总体积为11.7 μl。反应条件:先在37 ℃水浴中放置12 h,然后在70 ℃水浴中放置30 min。终产物作为肝组织cccDNA的检测模板。
1.6 ddPCR反应体系和条件 按照新羿生物公司提供的Probe dPCR SuperMix (with UNG)说明书配制反应体系为30 μl:2×SuperMix 15 μl、上游引物(10 μmol/L)0.6 μl、下游引物(10 μmol/L)0.6 μl、探针(10 μmol/L)0.6 μl、模板3 μl、ddH2O 10.2 μl。然后进行PCR反应,PCR反应条件:95 ℃ 10 min;94 ℃ 30 s,60 ℃ 1 min,40个循环;12 ℃ 5 min。
1.7 荧光定量PCR反应体系和条件 利用设计的引物和探针建立荧光定量PCR检测方法,配制反应体系为20 μl:TaqMan Fast Advanced Master Mix 10 μl、上游引物0.5 μl、下游引物0.5 μl、探针0.5 μl、模板2 μl、ddH2O 6.5 μl。扩增条件为:94 ℃ 3 min;94 ℃ 30 s,58 ℃ 45 s,共30个循环。
1.8 标准曲线和检出限分析 利用构建好的阳性对照质粒换算出拷贝数后进行梯度稀释,稀释的浓度分别为:1×104、1×103、1×102、1×101、1×100拷贝/μl。以稀释后的产物为模板对该方法的准确度和灵敏度进行评价。根据阳性对照质粒的拷贝数和检测结果的拷贝数计算出线性相关系数r2值。
1.9 重复性试验 分别选取1×103、1×102、1×101拷贝/μl的阳性对照质粒为模板,进行3次ddPCR重复检测,统计重复检测结果,计算出变异系数。
1.10 两种检测方法对比试验 提取20例患者肝组织DNA样本,并利用PSAD酶切得到HBV cccDNA模板。对模板同时进行荧光定量PCR检测和ddPCR检测,检测结果转变为拷贝数进行对比。
1.11 伦理学审查 本研究方案经由首都医科大学附属北京佑安医院伦理委员会审批,批号:京佑科伦字(2020)132号。患者均签署知情同意书。
1.12 统计学方法 所有数据采用SPSS 18.0软件进行统计分析。计数资料两组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 标准曲线和检出限分析 用梯度稀释的阳性对照质粒绘制标准曲线(图2),用ddPCR检出阳性对照质粒浓度的对数与其梯度稀释浓度的对数作图,线性方程为y=0.971 3x+0.318 5,r2值为0.989 6,具有较好的线性关系。表明ddPCR检测HBV cccDNA的检出限为1拷贝/μl,线性范围为1×100~1×104拷贝/μl,见表1和图3。

图2 ddPCR标准曲线

图3 梯度稀释阳性质粒ddPCR微滴荧光分布

表1 梯度稀释阳性质粒ddPCR检测结果
经过对1×100拷贝/μl和阴性样本多次重复检测后,利用公式:LoB=μB+1.645σB (LoB为空白限,μB和σB为空白样本检测的均值和标准差)[7],得到本研究方法的空白限为0.35 拷贝/μl。
2.2 重复性分析 选取浓度为1×103、1×102、1×101拷贝/μl的阳性对照质粒进行3次重复检测,结果见表2。变异系数分别为4.41%、3.98%、5.09%,说明建立ddPCR检测方法重复性较好,检测结果可靠。
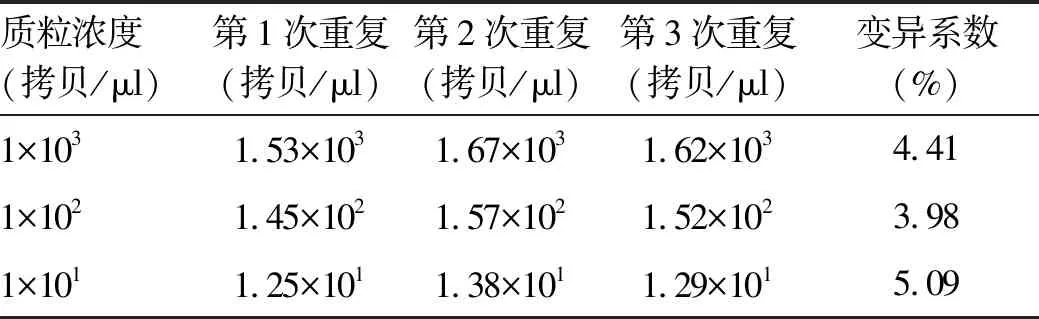
表2 重复性试验结果分析
2.3 荧光定量PCR和ddPCR检测方法对比 提取20例临床HBV感染者的肝组织DNA样本,进行PSAD酶切后得到HBV cccDNA模板。ddPCR方法能检测出17例阳性样本,阳性率为85%,而荧光定量PCR方法只能检出11例,阳性率为55%,两种方法比较差异有统计学意义(χ2=4.286,P=0.038)(表3)。

表3 荧光定量PCR和ddPCR检测结果比较
3 讨论
HBV cccDNA作为病毒复制和转录的模板,能够长期稳定的存在于细胞核中。目前,用于治疗HBV的药物长期使用可有效降低肝内cccDNA的水平,但是不能完全清除[8-9]。因此研发靶向清除HBV cccDNA的药物是治愈HBV的关键,同时也需要能够精准检测HBV cccDNA的方法,对治疗效果做出及时的评价。由于HBV cccDNA在肝细胞内的拷贝数较低,每个细胞仅有5~50拷贝,所以就需要更加灵敏的检测方法[10]。
现有的HBV cccDNA检测方法主要是滚环扩增(rolling circle amplification, RCA)、荧光定量PCR和巢式PCR等。科研人员利用RCA和荧光定量PCR结合的方法,检测了石蜡包埋的肝组织切片中的HBV cccDNA,通过RCA有效提高了检测的灵敏度,但是该方法步骤繁琐,耗费时间较长[11]。Xu等[12]利用巢式实时荧光定量PCR的方法,对外周血单核细胞和骨髓单核细胞中的HBV cccDNA进行检测,灵敏度达到了3.0×102拷贝/μl,并能准确检测出临床的阳性和阴性样本。Guo等[13]开发了一种磁珠捕获杂交的方法检测血清中的HBV cccDNA,通过制备捕获cccDNA的特异性纳米粒子,从而有效区分rcDNA和cccDNA,提高了检测的特异性,但是此方法需要特殊的材料,价格昂贵。
ddPCR是新一代的PCR技术,能对目标核酸进行绝对的定量分析而不依赖标准品和标准曲线[14]。ddPCR采用微滴式方法,将核酸溶液分散到微滴中,每个微滴不含或者含有一个至数个核酸模板数。经PCR扩增后,有核酸分子模板的微滴会出现荧光信号,没有核酸分子模板的则无荧光信号。再根据泊松分布原理及阳性微滴的个数与比例计算出目标核酸的原始拷贝数[14-16]。ddPCR相比于荧光定量PCR具有更高的灵敏度和特异度,已经被广泛用于病原微生物检测、基因多重定量检测和罕见的生物变异检测等许多领域[17-20]。
本研究建立了一种ddPCR检测HBV cccDNA的方法,提高了检出率,并具有较好的重复性。使用PSAD对样本DNA进行处理,最大限度的降低单链DNA和线性双链DNA对检测的影响[21]。又通过对跨越HBV基因组负链的缺口区设计引物和探针,提高了HBV cccDNA扩增的特异性。对梯度稀释后的HBV cccDNA阳性对照质粒进行检测,发现ddPCR方法检测阳性对照质粒的检出限为1 拷贝/μl。把20例临床肝组织DNA样本经PSAD消化后的产物作为扩增的模板,用ddPCR方法和荧光定量PCR方法进行对比,结果显示,ddPCR方法能准确检出17例,阳性率为85%,而荧光定量PCR方法只能检出11例,阳性率为55%,并具有统计学差异。表明ddPCR检测方法优于于荧光定量PCR方法。
总之,本研究所建立的ddPCR检测方法能够准确、灵敏的对肝组织中的HBV cccDNA进行定量分析和检测,提高了HBV cccDNA检出率,对更好的评价HBV治疗效果有较好的临床应用价值。
利益冲突说明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:田原、徐玲负责资料分析,论文撰写;范子豪、曹亚玲、张向颖负责收集和分析数据;陈煜、段钟平、任锋负责拟定写作思路,指导撰写并最后定稿。
——一道江苏高考题的奥秘解读和拓展

