青光安Ⅱ号方对诱导损伤的RGC-5细胞中NF-κB/HIF-1α通路相关细胞因子的影响
姚小磊 时健 刘倩宏 陈立浩 侯念婷


〔摘要〕 目的 觀察青光安Ⅱ号方对谷氨酸诱导损伤的RGC-5细胞中核因子κB(nuclear factor kappa-B, NF-κB)、低氧诱导因子-1α(hypoxia inducible factor-1,HIF-1α)、BCL2/腺病毒E1B相互作用蛋白3(BCL2/adenovirus E1B 19kDa interacting protein 3, BNIP3)、超氧化物歧化酶(superoxide dismutase, SOD)及丙二醛(malondialdehyde, MDA)的影响。方法 体外培养RGC-5细胞,分为4组:空白组、模型组、含药血清组和阻断剂组。模型组、含药血清组和阻断剂组予以谷氨酸诱导细胞损伤,模拟青光眼对神经节细胞的损伤,含药血清组加入青光安Ⅱ号方含药血清,阻断剂组加入KC7F2进行HIF-1α通路的阻断。以CCK-8法摸索含药血浆以及谷氨酸的最佳干预浓度;采用Hoechst法检测各组细胞的凋亡情况;Western blot检测NF-κB、HIF-1α、BNIP3蛋白表达情况;比色法检测SOD、MDA的表达情况。结果 CCK8法确定青光安Ⅱ号方5倍组含药血清为实验量,确定谷氨酸的最佳干预浓度为200 μM。与空白组比较,模型组NF-κB、HIF-1α、BNIP3、SOD、MDA表达显著升高(P<0.05);与模型组比较,含药血清组、阻断剂组NF-κB、HIF-1α、BNIP3和SOD的表达显著降低(P<0.05);含药血清组与阻断剂组的NF-κB、HIF-1α、BNIP3、SOD及MDA差异均无统计学意义(P>0.05)。结论 青光安Ⅱ号方对NF-κB具有抑制作用,进而抑制了HIF-1α相关通路的激活,减弱了由于氧化应激所致RGC-5细胞的凋亡,对RGC具有保护作用。
〔关键词〕 青光眼;青光安Ⅱ号方;视网膜神经节细胞;核因子κB;低氧诱导因子-1α;BCL2/腺病毒E1B相互作用蛋白3;超氧化物歧化酶;丙二醛
〔中图分类号〕R276.7 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2021.07.004
〔Abstract〕 Objective To observe the effects of Qingguangan Ⅱ Formula on nuclear factor kappa-B (NF-κB), hypoxia inducible factor-1 (HIF-1α), BCL2/adenovirus E1B 19kDa interacting protein 3 (BNIP3), superoxide dismutase (SOD) and malondialdehyde (MDA) in RGC-5 cells injury induced by glutamate. Methods The RGC-5 cells cultured in vitro were divided into 4 groups: blank group, model group, drug-containing serum group and blocker group. Glutamic acid was added to model group, drug-containing serum group and blocker group to simulate retinal ganglion cell damage caused by glaucoma, and Qingguangan Ⅱ Formula serum was added to drug-containing serum group, and the blocker group was added with KC7F2 to block the HIF-1α pathway. The CCK-8 method was used to find optimal intervention concentration of drug-containing plasma and glutamate; Hoechst method was used to detect the apoptosis of cells in each group; Western blot was used to detect the expression of NF-κB, HIF-1α, BNIP3; colorimetry was used to detect the expression of SOD and MDA. Results CCK8 method determined 5 times serum content as the Qingguangan Ⅱ Formula experimental amount, and the optimal intervention concentration of glutamate was 200 μM. Compared with blank group, the expression of NF-κB, HIF-1α, BNIP3, SOD and MDA increased significantly in the model group (P<0.05); compared with the model group, the expression of NF-κB, HIF-1α, BNIP3 and SOD in the drug-containing serum group and blocker group significantly decreased (P<0.05) ; there was no statistically significant difference between NF-κB, HIF-1α, BNIP3, SOD and MDA in drug-containing serum group and blocker group (P>0.05). Conclusion Qingguangan II Formula has an inhibitory effect on NF-κB, thereby inhibiting the activation of HIF-1α related pathways, reducing the apoptosis of RGC-5 cells caused by oxidative stress, it also has a protective effect on RGC.
〔Keywords〕 Qingguangan Ⅱ Formula; retinal ganglion cell; nuclear factor kappa-B; hypoxia inducible factor-1; BCL2/adenovirus E1B 19 kDa interacting protein 3; superoxide dismutase; malondialdehyde
青光眼為导致人类失明的三大眼类疾病之一。调查显示,2020年全球青光眼患病人数高达7 600万,其中我国占2 100万,位居世界之首[1],目前,超过40岁以上人群青光眼的总患病康复率仅有1.5%~3.6%[2],治疗方案主要以控制眼压来保存视力,但是青光眼导致的视神经损伤却不可逆,且没有较好的视神经保护方案。彭清华教授通过多年临床经验总结出“青光安Ⅱ号方”,研究表明其有较好的临床疗效,尤其对青光眼术后仍存在视力下降的患者,有较好的视神经保护效应[3],但其具体的机制并不清楚。动物实验中发现青光安Ⅱ号方对于Caspase-3有影响,可减少视网膜神经细胞的凋亡[4]。有研究表明,青光眼的视神经损伤可能与氧化应激有关[5-6],活性氧的增加是小胶质细胞在高眼压过程中死亡的主要原因[7]。因此,本研究通过实验的方法探讨青光安Ⅱ号方对RGC-5细胞模型[8]中核因子κB(nuclear factor kappa-B, NF-κB)/低氧诱导因子-1α(hypoxia inducible factor-1, HIF-1α)通路中相关因子的影响,以期明确其视神经保护的相关机制。
1 材料与方法
1.1 动物及细胞
取健康SPF级雄性和雌性SD大鼠各30只,由湖南省斯莱克景达实验动物有限公司提供,许可证号:SCXK(湘)2019-2004,体质量0.17~0.28 kg。动物实验伦理合格证号:LL2019121901。RGC-5细胞株(批号:CP-M122,武汉普诺赛生命科技有限公司)。
1.2 药物
中药配方:黄芪(批号:CK19111807)、枸杞子(批号:SL19112203)、灯盏细辛(批号:2019011616)、牛膝(批号:CK19101401)、川芎(批号:SL19111503)、女贞子(批号:2019011201)均购自湖南中医药大学第一附属医院。
1.3 试剂与仪器
CCK-8试剂盒(批号:CA1210)、30%制胶液(批号:A1010)均购自索莱宝公司;总超氧化物歧化酶(superoxide dismutase, SOD)测定试剂盒(批号:A001-3-2)、丙二醛(malondialdehyde, MDA)测定试剂盒(批号:A003-1)均购自南京建成公司;Tris(中国医药集团有限公司,批号:30188216);5×SDS-PAGE蛋白上样缓冲液(批号:P0015L)、ECL发光液(批号:P0018S-2)均购自上海碧云天生物技术有限公司;蛋白Marker(赛默飞世尔科技公司,批号:26617);PVDF膜(美国密理博公司,批号:IPVH00010);膜再生液(北京普利莱基因技术有限公司,批号:P1650);HIF-1α(批号:ab1)、BCL2/腺病毒E1B相互作用蛋白3(BCL2/adenovirus E1B 19kDa interacting protein 3,BNIP3)(批号:ab109362)、NF-κB(批号:ab16502)均购自上海Abcam生物技术有限公司;GAPDH(美国proteintech公司,批号:10494-1-AP);羊抗兔-HRP(北京博奥森生物技术有限公司,批号:bs-0295G-HRP);KC7F2(上海浩洋生物科技有限公司,批号:S7946)。
酶标仪(上海碧云天生物技术有限公司,型号:Synergy H4);KHB洗板机(上海科华实验系统有限公司,型号:ST-36WT);电泳仪(伯乐生命医学产品有限公司,型号:1645070);电转仪(伯乐生命医学产品有限公司,型号:BE6085);全自动化学发光图像分析系统(上海天能科技有限公司,型号:5200)。
1.4 含药血清的获取
将60只SD大鼠随机分成青光安Ⅱ号方10倍组、青光安Ⅱ号方5倍组、青光安Ⅱ号方2.5倍组和空白组。按体表面积换算的方法计算出每只大鼠的灌药量,灌药大鼠均按照10倍成人等效剂量灌胃。适应性饲养1 d后开始灌胃,空白对照组灌同等剂量的生理盐水,每日1次。灌胃7 d后,提取血清。取血方法:每只大鼠麻醉前1 h灌胃,大鼠麻醉、固定,颈总动脉采血,离心提取含药血清和空白血清。青光安Ⅱ号方10倍组:所取血清即为高剂量血清;青光安Ⅱ号方5倍组:所取血清加入1倍体积DMEM低糖培养基,设为中剂量血清;青光安Ⅱ号方2.5倍组:所取血清加入3倍体积DMEM低糖培养基,设为低剂量血清。收集的血清56 ℃下灭活补体30 min,按组别混合后放-80 ℃冰箱保存。
1.5 含药血清加入量及谷氨酸加入量的摸索
采用CCK-8法确定含药血清及谷氨酸加入量。将细胞以2×104个/mL、200 μL/孔的密度接种在96孔板中,在37 ℃、5% CO2箱中培养24 h,移出孔板,分别加入0、25、100、200 μM的谷氨酸;继续放回37 ℃、5% CO2箱进行培养;24 h干预后取出96孔板;向每个孔中添加10 μL CCK-8反应溶液;在37 ℃、5% CO2箱中继续孵育2 h;用酶标仪测量450 nm处的吸光度(OD),并通过存活率判定各种浓度下的细胞增殖活性,由此选择适当的谷氨酸浓度。同时按照上述方法分别加入3种不同浓度的24 μL含药血清,通过存活率OD判定各种浓度下的细胞增殖活性。选择适当的含药血清浓度。
1.6 细胞模型建立及分组、干预
使用RGC-5细胞株,培养至状态良好,体外培养的RGC-5细胞分为4组。空白组:10%胎牛血清的DMEM低糖培养基加空白血清进行培养。模型组:细胞培养基中加入谷氨酸,以此模拟RGC-5细胞损伤[8],10%胎牛血清的DMEM低糖培養基加空白血清进行培养。含药血清组:细胞培养基中加入谷氨酸,以此模拟RGC-5细胞损伤[8],10%胎牛血清的DMEM低糖培养基加含药血清进行培养。阻断剂组:细胞培养基中加入谷氨酸,以此模拟RGC-5细胞损伤[8],10%胎牛血清的DMEM低糖培养基加含药血清进行培养,合并使用阻断剂KC7F2[9]2 μM处理。
1.7 Hoechst染色法检测细胞凋亡
将细胞以2×104个/mL、2 mL/孔密度接种于6孔板爬片中,在37 ℃、5% CO2箱中培养24 h;取出孔板,按以上分组进行处理,先加入200 μM谷氨酸;继续在37 ℃、5% CO2箱中培养24 h;取出孔板,按以上分组换入空白对照血清、5倍青光安血清、以及5倍青光安血清和KC7F2;继续在37 ℃、5% CO2箱中培养24 h;取出孔板,吸去上清液,每孔加入1 mL Hochest染色剂,继续在37 ℃、5% CO2箱中培养30 min;取出孔板,观察是否出现荧光;如果出现荧光,首先吸去上清液,PBS清洗2次,封片。每组拍摄3次。
1.8 四氮唑蓝(tetrazolium blue, NBT)核黄素比色法检测SOD含量
样品6倍稀释后种于6孔板中培养至最佳状态,加入底物、酶,测定孔、测定空白孔加样品20 μL,对照孔、对照空白孔加超纯水20 μL。对照孔、测定孔加酶工作液20 μL;对照空白孔、测定空白孔加酶稀释液20 μL。每孔加底物应用液200 μL,混匀后37 ℃加热20 min,450 nm处酶标仪读数。结果计算公式:SOD抑制率=[(对照孔OD值-对照空白孔OD值)-(测定孔OD值-测定空白孔OD值)]/(对照孔OD值-对照空白孔OD值)×100%;SOD活力(U/mL)=SOD抑制率/50%×反应体系稀释倍数×样本测试前稀释倍数。
1.9 硫代巴比妥酸(thiobarbituric acid,TBA)比色法检测MDA含量
MDA试剂盒准备完毕后,配置相关试剂:(1)试剂一:37 ℃加热溶解至透明;(2)试剂二:加170 mL超纯水配制;(3)试剂三:加30 mL超纯水后加热95 ℃充分溶解,再加30 mL冰醋酸,混匀。空白管加无水乙醇20 μL,标准管加10 nmol/mL标准品20 μL,测定管加样品20 μL。每管加试剂一20 μL,混匀。每管加试剂二3 mL,加试剂三1 mL。用针在离心管盖上扎1个小孔,混匀后95 ℃加热40 min,取出后流水冷却,3 500 r/min离心10 min,离心半径20 cm,取上清200 μL加入到酶标板中,532 nm处测各管吸光度值。结果计算公式:MDA含量(nmol/mL)=(测定管OD值-空白管OD值)/(标准管OD值-空白管OD值)×标准品浓度×稀释倍数。
1.10 Western blot检测NF-κB、HIF-1α、BNIP3蛋白的表达
RGC-5细胞长至90%铺满时再消化传代。将细胞以5×104个/mL密度接种于6孔板中,2 mL/孔;按以上分组进行处理,37 ℃、5% CO2箱中继续培养24 h;吸去上清液,PBS清洗1次;吸去PBS,每孔加入100 μL蛋白裂解液;细胞刮刀将细胞刮下后吸进1.5 mL离心管中,-80 ℃保存;从-80 ℃冰箱中取出样本,置于冰上解冻,4 ℃下12 000 r/min离心20 min,离心半径20 cm,取上清。采用BCA蛋白浓度测定试剂盒测定蛋白质浓度;根据浓度测定结果对蛋白浓度进行调整,保证不同组别之间蛋白浓度一致,每孔上样量为30 μg,与适量5×loading buffer混匀,95 ℃、5 min后进行上样,剩余样本于
-80 ℃保存。制备电泳胶、上样电泳、转膜、封闭、孵一抗[用含2% BSA的TBST稀释相应的一抗,NF-κB(1∶2 000)、HIF-1α(1∶500)、BNIP3(1∶2 000)];孵二抗[用封闭液稀释HRP标记二抗(1∶5 000)]、显色曝光、膜洗脱再生,再次进行封闭。内参孵育,加入二抗,曝光。曝光结果使用Image J软件分析灰度值。
1.11 统计学分析
用SPSS 26.0软件进行统计学分析,双侧检验,P<0.05为差异有统计学意义。计量资料用“x±s”表示。先进行正态性及方差齐性检验,若数据呈正态分布,且方差齐,则进行单因素方差分析。若分析结果显示,各组间存在差异,则采用Tukey法进行多组比较。若不满足正态性要求,则采用非参数检验,若分布正态但方差不齐者,则采用单因素方差分析。
2 结果
2.1 含药血清和谷氨酸加入量的确定
含药血清中空白组细胞存活率为100%,2.5倍组为89.05%,5倍组为88.96%,10倍组为74.93%。为确保含药量,选用5倍组作为实验量。细胞培养24 h后,谷氨酸加入量为0 μM时细胞存活率为100%、25 μM时为95.85%、100 μM时为84.87%、200 μM时为64.20%,最终选用200 μM的谷氨酸为加入量。
2.2 各组细胞凋亡情况
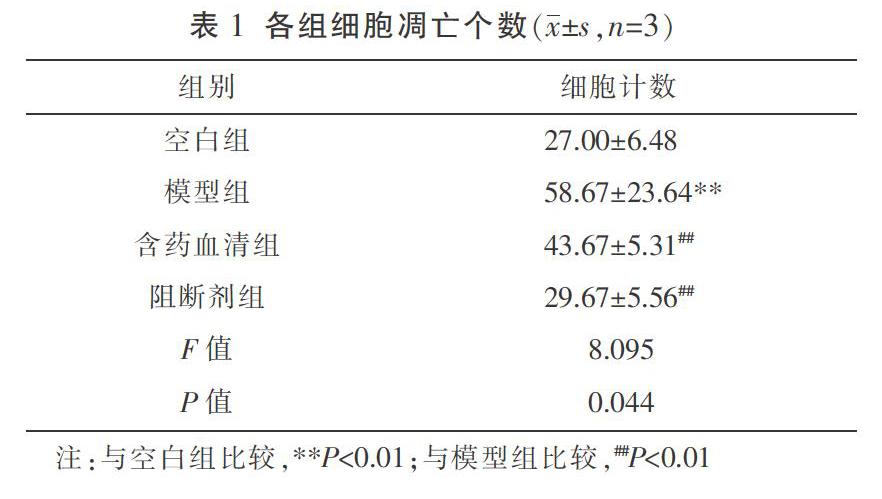
与空白组比较,模型组凋亡细胞个数明显增多,差异有统计学意义(P<0.01);与模型组比较,含药血清组和阻断剂组凋亡细胞个数明显减少,差异均有统计学意义(P<0.01);与含药血清组比较,阻断剂组凋亡细胞个数减少,但差异无统计学意义(P>0.05)。见表1、图1。
2.3 各组NF-κB、HIF-1α、BNIP3蛋白表达情况
与空白组比较,模型组NF-κB、HIF-1α、BNIP3蛋白的表达明显增加,差异有统计学意义(P<0.05,P<0.01);与模型组比较,含药血清组及阻断剂组NF-κB、HIF-1α、BNIP3蛋白的表达明显减少,差异有统计学意义(P<0.05,P<0.01);与含药血清组比较,阻断剂组NF-κB、HIF-1α、BNIP3蛋白的表达差异无统计学意义(P>0.05);但与空白组比较,阻断剂组HIF-1α蛋白的表达量明显增加,而BNIP3蛋白的表达量明显减少,差异有统计学意义(P<0.01)。见表2、图2。
2.4 各组SOD和MDA含量表达情况
与空白组比较,模型组SOD及MDA的含量明显增加,差异有统计学意义(P<0.01);与模型组比较,含药血清组SOD及MDA的含量明显减少、阻断剂组SOD明显减少,差异均有统计学意义(P<0.01);与含药血清组比较,阻断剂组SOD含量明显减少,差异有统计学意义(P<0.01),MDA的含量差异无统计学意义(P>0.05);但与空白组比较,阻断剂组MDA的含量明显增加,差异有统计学意义(P<0.01)。见表3。
3 讨论
青光眼在控制眼压后仍然可引起RGC的凋亡,目前对于视神经的挽救方式较少,神经生长因子的效果并不具有优势[10-11],而干细胞移植仍处于实验室阶段[12-13]。中医药因其具有庞大的药物组分库,具备从中进行创新药物挖掘的潜力,越来越受到学者的重视。彭清华教授所创制的“青光安Ⅱ号方”对RGC的Caspase-3表达有抑制作用,能有效抑制RGC的凋亡[4],但青光安Ⅱ号方抑制凋亡的具体机制并不清楚。
氧化应激可能与青光眼的视神经损伤有关[14-15],研究[7]表明活性氧的增加是小胶质细胞在高眼压过程中死亡的主要原因,而抑制氧化应激损伤则可以保护胶质细胞[16]。目前,关于中医药的研究中,细胞黄素、银杏叶提取物对于缺氧损伤的RGC具有保护作用[17-18];枸杞子、丹参、川芎、灯盏细辛等,也具有视神经保护效应[19]。所以本研究从氧化应激的相关细胞因子进行研究,来验证青光安Ⅱ号方对于RGC的保护作用是否是通过调控氧化应激相关因子来实现的。
研究表明,HIF-1α和NF-кB均是氧化应激相关通路中的核心因子,且两者之间还有密切联系:HIF-1α可诱导缺氧细胞中的NF-кB的活化[20];而NF-кB也可与HIF-1α启动子结合,上调缺氧反应中HIF-1α的表达[21]。缺氧反应发生后,细胞内氧自由基的大量生成会引发SOD的上调,其最终产物MDA也会大量生成;同时引发BNIP-3的激活,诱导RGC发生线粒体自噬[22-23]。为了观察青光安Ⅱ号方含药血清是否是通过调控HIF-1α发挥作用,本实验中加入HIF-1α的阻断剂KC7F2,它是一种选择性HIF-1α蛋白翻译抑制剂,可抑制HIF-1α的蛋白合成,进一步抑制BNIP-3和SOD的激活。
中医学认为青光眼的病理机制是气虚血瘀,脉络阻滞,目系失养,玄府闭塞,神水瘀积[24],中医治疗宜采用益气活血利水的治法,“青光安Ⅱ号方”在此思想指导下应运而生[25]。其组方由黄芪、枸杞子、灯盏细辛、牛膝、川芎、女贞子组成,重用枸杞子、女贞子、牛膝三味,归肝肾经,为滋补肝肾之品,其中以枸杞子、女贞子补肝肾明目为君,另加黄芪补气健脾,四药补益正气取其“正气存内,邪不可干”之意,扶助正气以驱邪外出。故本方以补为主,侧重补肝肾之阴,同时在补益基础上,用牛膝及灯盏细辛活血。黄芪利水,川芎行气,一使气行则血行、气行亦水行,二使全方补而不滞。全方补通兼施,使目窍通畅、气血调和,则诸症俱解。
本次研究中,我们使用谷氨酸诱导RGC-5细胞损伤,模拟青光眼所造成的RGC凋亡[5,26-27]。本次研究结果中,模型组的NF-κB、HIF-1α均出现高表达,与空白组、含药血清组和阻断剂组比较,差异有统计学意义(P<0.05,P<0.01),說明当RGC-5细胞损伤出现时,会激活其中NF-κB表达,进一步激活HIF-1α表达,两者可能形成正反馈的调节。SOD、MDA在模型组中表达升高(P<0.01),说明在视神经损伤后,细胞内活性氧增加,引发了SOD上调以及代谢产生MDA的集聚;另外,BNIP-3在模型组中高表达(P<0.01),说明在激活HIF-1α后,引发了BNIP-3途径的线粒体自噬反应,有可能进而形成细胞凋亡。Hoechst法检测到模型组细胞凋亡数量明显多于其他各组(P<0.01),也验证了这一点,且与前期研究的结果一致[4]。而与模型组相比,含药血清组与阻断剂组在谷氨酸致损后,其NF-κB表达均得到了一定的抑制,与模型组比较,差异有统计学意义(P<0.05);同时此两组的HIF-1α表达也受到明显抑制(P<0.01);而含药血清组与阻断剂组之间并无明显差异(P>0.05),表明含药血清对RGC-5细胞产生了 组的BNIP-3蛋白表达和SOD含量均明显受到抑制,表明含药血清在抑制NF-κB和HIF-1α蛋白表达的基础上,进一步抑制了BNIP-3和SOD的表达,前者可以减弱RGC-5细胞的线粒体自噬,对抑制RGC的凋亡有正向作用;而后者将导致MDA的减少,与本次实验的结果吻合,最终形成了对细胞凋亡的抑制作用,表现为含药血清组与阻断剂组的细胞凋亡数量明显减少(P<0.01)。
综上所述,青光安Ⅱ号方含药血清对谷氨酸诱导损伤的RGC-5细胞中NF-кB具有抑制作用,进而抑制了HIF-1α通路的激活,减弱了由于氧化应激所致的细胞凋亡。
参考文献
[1] 梁远波,江俊宏.我国青光眼防治问题与展望[J].浙江医学,2020, 42(22):2377-2382.
[2] 梁遠波,江俊宏,王宁利.中国青光眼流行病学调查研究回顾[J].中华眼科杂志,2019,55(8):634-640.
[3] 李银鑫,欧 晨,周亚莎,等.彭清华教授采用青光安Ⅱ号方治疗青光眼中晚期视神经损害[J].亚太传统医药,2020,16(12):113-116.
[4] 李银鑫,蒋鹏飞,曾志成,等.青光安Ⅱ号方有效组分对青光眼模型DBA/2J小鼠视网膜中RhoA、ROCK及Caspase-3蛋白表达的影响[J].湖南中医药大学学报,2020,40(6):673-678.
[5] LIU Y, LEE R K. Cell transplantation to replace retinal ganglion cells faces challenges - the Switchboard Dilemma[J]. Neural Regeneration Research, 2021, 16(6): 1138-1143.
[6] AHMAD A, AHSAN H. Biomarkers of inflammation and oxidative stress in ophthalmic disorders[J]. Journal of Immunoassay and Immunochemistry, 2020, 41(3): 257-271.
[7] AIRES I D, BOIA R, RODRIGUES-NEVES A C, et al. Blockade of microglial adenosine A2A receptor suppresses elevated pressure-induced inflammation, oxidative stress, and cell death in retinal cells[J]. Glia, 2019, 67(5): 896-914.
[8] HU X X, DAI Y, SUN X H. Parkin overexpression protects retinal ganglion cells against glutamate excitotoxicity[J]. Molecular Vision, 2017, 23: 447-456.
[9] LI J, JIANG G H, CHEN Y L, et al. Altered expression of hypoxia-Inducible factor-1α participates in the epileptogenesis in animal models[J]. Synapse, 2014, 68(9): 402-409.
[10] EFTIMIADI G, SOLIGO M, MANNI L, et al. Topical delivery of nerve growth factor for treatment of ocular and brain disorders[J]. Neural Regeneration Research, 2021, 16(9): 1740-1750.
[11] LAMBIASE A, MANTELLI F, BONINI S. Nerve growth factor eye drops to treat Glaucoma[J]. Drug News & Perspectives, 2010, 23(6): 361-367.
[12] HARADA C, NORO T, KIMURA A, et al. Suppression of oxidative stress as potential therapeutic approach for normal tension Glaucoma[J]. Antioxidants (Basel, Switzerland), 2020, 9(9): 874-886.
[13] XIONG S, KUMAR A, TIAN S, et, al. Stem cell transplantation rescued a primary open-angle glaucoma mouse model[J]. Elife. 2021, 10: e63677.
[14] LIU Y, LEE R K. Cell transplantation to replace retinal ganglion cells faces challenges-the Switchboard Dilemma[J]. Neural Regeneration Research, 2021, 16(6): 1138-1143.
[15] AHMAD A, AHSAN H. Biomarkers of inflammation and oxidative stress in ophthalmic disorders[J]. Journal of Immunoassay & Immunochemistry, 2020, 41(3): 257-271.
[16] MEANS J C, LOPEZ A A, KOULEN P. Estrogen protects optic nerve head astrocytes against oxidative stress by preventing caspase-3 activation, tau dephosphorylation at Ser422 and the formation of tau protein aggregates[J]. Cellular and Molecular Neurobiology, 2021, 41(3): 449-458.
[17] CHO H K, KIM S, LEE E J, et al. Neuroprotective effect of Ginkgo biloba extract against hypoxic retinal ganglion cell degeneration in vitro and in vivo[J]. Journal of Medicinal Food, 2019, 22(8): 771-778.
[18] MALISHEVSKAYA T N, YUSUPOV A R, SHATSKIKH S V, et al. Efficacy and safety of neuroprotection in patients with primary open-angle Glaucoma[J]. Vestnik Oftalmologii, 2019, 135(2): 83-92.
[19] 周亞莎,廖林丽,覃艮艳,等.不同中药对青光眼小鼠视网膜TRPV4及TRAAK蛋白影响的比较研究[J].湖南中医杂志,2020,36(12):153-157.
[20] LEE S H, LEE Y J, HAN H J. Effect of arachidonic acid on hypoxia-induced IL-6 production in mouse ES cells: Involvement of MAPKs, NF-kappaB, and HIF-1alpha[J]. Journal of Cellular Physiology, 2010, 222(3): 574-585.
[21] BELAIBA R S, BONELLO S, Z HRINGER C, et al. Hypoxia up-regulates hypoxia-inducible factor-1alpha transcription by involving phosphatidylinositol 3-kinase and nuclear factor kappaB in pulmonary artery smooth muscle cells[J]. Molecular Biology of the Cell, 2007, 18(12): 4691-4697.
[22] ZENG C, ZOU T T, QU J Y, et al. Cyclovirobuxine D induced-mitophagy through the p65/BNIP3/LC3 axis potentiates its apoptosis-inducing effects in lung cancer cells[J]. International Journal of Molecular Sciences, 2021, 22(11): 5820.
[23] HUANG Y N, WEN Q L, HUANG J F, et al. Manganese (II) chloride leads to dopaminergic neurotoxicity by promoting mitophagy through BNIP3-mediated oxidative stress in SH-SY5Y cells[J]. Cellular & Molecular Biology Letters, 2021, 26(1): 23.
[24] 秦裕辉.问目哪得清如许,唯有活血利水来——评《眼科活血利水法的研究》[J]. 湖南中医药大学学报,2020,40(3):381-382.
[25] 彭 俊,曾志成,谭涵宇,等.眼科活血利水法的基础研究进展[J].眼科新进展,2010,30(6):585-589,593.
[26] SUCHER N J, LIPTON S A, DREYER E B. Molecular basis of glutamate toxicity in retinal ganglion cells[J]. Vision Research, 1997, 37(24): 3483-3493.
[27] KRITIS A A, STAMOULA E G, PANISKAKI K A, et al. Researching glutamate-induced cytotoxicity in different cell lines: A comparative/collective analysis/study[J]. Frontiers in Cellular Neuroscience, 2015, 9: 91.

