石榴皮多酚乳膏抑制NLRP3炎性小体抗炎抗痤疮的机制研究
高凡 朱明芳 杨逸璇 吴淑辉 李翠 张娟娟


〔摘要〕 目的 探究石榴皮多酚乳膏抑制NOD樣受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3, NLRP3)炎性小体抗炎抗痤疮的机制。方法 将42只雌雄各半SPF级SD大鼠随机分为空白组、模型组、基质组、石榴皮多酚低中高浓度组、克林霉素组,每组6只。除空白组外,其余各组构建大鼠耳廓痤疮模型。造模完成后于大鼠耳廓予各被试因素干预,2次/d,连续用药2周,末次用药24 h后取材。肉眼观察皮损变化;HE染色观察组织病理改变;免疫组化法检测皮损中NLRP3、凋亡相关的斑点样蛋白(apoptosis-associated speck-like protein containing a CARD, ASC)、半胱氨酸天冬氨酸蛋白酶1(Caspase-1)、基质金属蛋白酶2(matrix metallo proteinase-2, MMP-2)的表达情况;ELISA法检测血清样本中白细胞介素-1β(interleukin-1 beta, IL-1β)和白细胞介素18(interleukin-18, IL-18)的水平。结果 肉眼观察可见空白组耳廓表面正常,模型组和基质组有皮肤暗红、肿胀、变硬、痂皮及丘疹等炎症表现,石榴皮多酚各浓度组及克林霉素组较模型组皮损可见不同程度改善。病理结果显示,空白组组织正常,模型组及基质组表皮角化、真皮内炎症细胞浸润、皮脂腺增生,各治疗组上述表现不同程度减轻。免疫组化示,与空白组相比,模型组和基质组大鼠NLRP3、ASC、Caspase-1、MMP-2表达升高(P<0.05);与模型组相比,石榴皮多酚各浓度组及克林霉素组NLRP3、Caspase-1水平明显降低(P<0.05),石榴皮多酚中、高浓度组ASC表达降低(P<0.05),石榴皮多酚低、高浓度组MMP-2表达下降(P<0.05)。ELISA结果显示,模型组较空白组大鼠血清IL-1β、IL-18含量明显升高;石榴皮多酚各组及克林霉素组较模型组明显下降(P<0.05)。结论 石榴皮多酚乳膏能有效改善SD大鼠痤疮模型的炎症反应,可能与其抑制NLRP3炎性小体抗炎抗痤疮的机制有关。
〔关键词〕 痤疮;石榴皮多酚;炎症反应;NLRP3炎性小体;白细胞介素-1β;白细胞介素-18
〔中图分类号〕R275.9 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2021.07.006
〔Abstract〕 Objective To explore the anti-inflammatory and anti-acne mechanism of pomegranate peel polyphenol cream inhibiting NOD-like receptor thermal protein domain associated protein 3 (NLRP3) inflammatory corpuscle. Methods 42 male and female SPF SD rats were randomly divided into blank group, model group, matrix group, pomegranate peel polyphenol low-medium-high concentration group and clindamycin group, with 6 rats in each group. Except the blank group, the other groups established rat auricle acne model. After the completion of the model, the rats were intervened by various factors, twice a day, for 2 weeks, and the samples were taken 24 hours after the last administration. The changes of skin lesions were observed with naked eyes; histopathological changes were observed by HE staining; the expression levels of NLRP3, apoptosis-associated speck-like protein containing a card (ASC), Caspase-1, matrix metalloproteinase-2 (MMP-2) were detected by immunohistochemistry; the levels of interleukin-1β (IL-1β) and interleukin-18 (IL-18) in serum samples were detected by ELISA. Results The auricle surface of blank group was normal, and the skin of model group and matrix group was dark red, swollen, hardened, scab and papule. Compared with model group, the skin lesions of pomegranate peel polyphenols and clindamycin group were improved in different degrees. Pathological results showed that the blank group was normal, while the model group and matrix group had keratinization of epidermis, infiltration of inflammatory cells in dermis and hyperplasia of sebaceous glands, which were alleviated in different degrees in each treatment group. Immunohistochemistry showed that compared with the blank group, the expression levels of NLRP3, ASC, Caspase-1 and MMP-2 in model group and matrix group were higher (P<0.05); compared with the model group, the levels of NLRP3 and Caspase-1 in pomegranate peel polyphenol concentration groups and clindamycin group were significantly decreased (P<0.05), ASC expression in pomegranate peel polyphenol middle and high concentration groups was decreased (P<0.05), MMP-2 expression in pomegranate peel polyphenol low and high concentration groups was decreased (P<0.05). The results of ELISA showed that the content of serum IL-1β and IL-18 in model group was significantly higher than those in blank group; compared with the model group, pomegranate peel polyphenol concentration groups and clindamycin groups decreased significantly (P<0.05). Conclusion Pomegranate peel polyphenol cream can effectively improve the inflammatory response of SD rat acne model, which may be related to its anti-inflammatory and anti-acne mechanism of inhibiting NLRP3 inflammatory corpuscle.
〔Keywords〕 acne; pomegranate peel polyphenols; inflammatory reaction; NLRP3 inflammasome; interleukin-1β; interleukin-18
痤疮是一种常见的毛囊及皮脂腺的慢性炎症性皮肤病[1]。近年来痤疮的发病率呈逐年上升的趋势,面部痤疮影响容貌,对患者工作生活造成严重的困扰,痤疮的防治显得尤为重要[2]。
炎性反应是痤疮最原始的反应之一,而痤疮丙酸杆菌(Propionibacterium acnes, P. acnes)则在痤疮炎症维持过程中起主要作用[3]。研究发现,P. acnes在转录水平提高人真皮成纤维细胞基质金属蛋白酶(matrix metallo proteinase-2, MMP-2)的表达,其过量繁殖促进MMP-2分泌,可能使毛囊壁更易破裂,炎症扩散入真皮层。李晓娟等[3]研究发现P. acnes可通过依赖NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3, NLRP3)炎性小体的方式介导痤疮患者单核细胞,通过分泌白介素-1β(interleukin-1 beta, IL-1β)来诱导痤疮炎性反应的发生及发展。NLRP3炎性小体由NOD样受体(NOD-like receptor, NLRs)凋亡相关的斑点样蛋白(apoptosis-associated speck-like protein containing a CARD, ASC)和半胱氨酸天冬氨酸蛋白酶1(Caspase-1)组成,其能够识别多种内外源性刺激,通过招募并激活Caspase-1,促进促炎因子IL-1β和IL-18的剪切成熟与分泌,抑制细胞自噬,引起炎症性凋亡等免疫效应[4]。
朱明芳教授基于中医“以皮治皮”的“取类比象”思想,选用石榴皮治疗痤疮取得了较为显著临床疗效。课题组前期研究证实了石榴皮的有效成分石榴皮多酚能在体外有效抗P. acnes[5]、抗疤痕[6]、调脂[7]等。基于此,本研究以SD大鼠构建痤疮复合模型,外用石榴皮多酚乳膏进行干预,探讨石榴皮多酚对NLRP3炎性小体及其相关通路的影响,初步阐明其抑制NLRP3炎性小体抗炎抗痤疮的机制,为其临床应用提供新的依据。
1 材料
1.1 实验动物
SPF级成年SD大鼠42只,雌雄各半,体质量180~220 g,购于湖南斯莱克景达实验动物有限公司,合格证号:SCXK(湘)2016-0002。动物饲养于中南大学实验动物学部,实验单位使用许可证号:SYXK(湘)2015-0017。饲养环境:室温(24±2) ℃,相对湿度50%左右,通风,雌雄大鼠分笼饲养,自由摄水进食。本研究取得中南大学实验动物福利伦理审查批准(编号:2019SYDW0134)。
1.2 药品及试剂
石榴皮多酚提取物(浓度60%,批号:RY151119,西安瑞盈生物科技有限公司);P. acnes标准菌株冻干粉(货号:BNCC336443,北京北纳创联生物技术研究院);100%油酸(批号:20190430,天津市富宇精细化工有限公司);盐酸克林霉素乳膏(货号:H20040314,金日制药有限公司);MMP2兔多克隆抗体、NLRP3兔多克隆抗体、Caspase-1多克隆抗体(货号:10373-2-AP、19771-1-AP、22915-1-AP,Proteintech公司);ASC兔多克隆抗體(货号:bs-6741R,北京博澳森生物技术有限公司);IL-1β、IL-18的ELISA试剂盒(批号:200617R、200609R,江苏菲亚生物科技有限公司)。
石榴皮多酚乳膏:按照参考文献[6]制备乳膏基质,根据黄继汉《药理试验中动物间和动物与人体间的等效剂量换算》[8],计算大鼠低、中、高浓度石榴皮多酚用量分别为0.07 g/(d·kg)、0.14 g/(d·kg)、0.28 g/(d·kg),自制浓度分别为1.4%、2.8%、5.6%的低、中、高浓度石榴皮多酚乳膏。
P. acnes菌悬液:P. acnes冻干管于4 ℃下保存,打管后注入适量无菌水,多次吹打,充分溶解成菌悬液。涂布于硫乙醇钠培养基中,于厌氧培养箱中37 ℃培养48 h后进行转种活化。增殖后肉眼可见针尖至粟米大小、灰白色、表面光滑的菌落,进行革兰染色检查,于光学显微镜下可见微弯、呈棒状、一端钝圆、另一端尖细的G+杆菌,无芽孢,无荚膜,无鞭毛。收集菌落后洗涤、过滤,在细菌浊度仪下调整浓度为6×107 cfu/mL。
1.3 主要仪器
轮转石蜡切片机(型号:RM2235,徕卡贸易有限公司);正置荧光显微镜(型号:MoticPro285B,麦克奥迪实业集团有限公司);双目生物显微镜(型号:MoticBA410,麦克奥迪实业集团有限公司);医用低速离心机(型号:TD4-II,长沙平凡仪器仪表有限公司);细菌浊度仪(编号:20161581,上海昕瑞仪器仪表有限公司)。
2 方法
2.1 分组及造模
大鼠适应性喂养1周后,按随机数字表法分为空白组、模型组、基质组、石榴皮多酚低/中/高浓度组、克林霉素组,每组6只。除空白组外,其余各组按照参考文献[9]建立大鼠耳廓痤疮模型:于大鼠双耳廓内侧耳导管开口处均匀涂抹100%油酸,0.5 mL/次,1次/d,并于涂抹油酸的第21天开始在大鼠耳廓同一部位皮下注射P. acnes液(6×107 cfu/mL)50 μL,1次/d,连续3 d。末次注射P. acnes菌液24 h后,肉眼观察耳廓皮肤状态并记录,各组随机选择一只大鼠取耳廓皮损部位组织进行病理观察。参照痤疮模型判定分级标准[10]进行造模评价,本实验的造模评价为+++,见表1。
2.2 给药方法
判断造模成功后开始外用药物,各组按被试因素分别于大鼠耳廓造模处连续用药14 d,2次/d。空白组及模型组:予0.5 g蒸馏水;基质组:予基质乳膏0.5 g;石榴皮多酚低浓度组:予0.5 g 1.4%石榴皮多酚乳膏;石榴皮多酚中浓度组:予0.5 g 2.8%石榴皮多酚乳膏;石榴皮多酚高浓度组:予0.5 g 5.6%石榴皮多酚乳膏;克林霉素组:予0.5 g盐酸克林霉素乳膏。
2.3 肉眼观察皮损情况
自造模之日起,每日观察大鼠耳廓皮肤,记录其颜色,有无红肿、表皮增厚、变硬、脱屑、痂皮、丘疹、囊肿及毛细血管扩张等炎症表现,拍照记录皮损的变化情况。
2.4 ELISA检测血清IL-1β、IL-18水平
末次给药24 h后,用10%水合氯醛腹腔注射麻醉后,迅速采集腹主动脉血约5 mL,1 h静置,3 000 r/min、半径13.5 cm、离心15 min,取上清液后,-20 ℃冰箱内保存备用,ELISA法检测外周血IL-1β、IL-18水平。
2.5 HE染色观察病理组织结构
剪取大鼠耳廓组织,用磷酸盐缓冲液冲洗数次后,用4%多聚甲醛固定,石蜡包埋、切片、HE染色,95%乙醇快速清洗,脱水透明封片后,于显微镜下观察。
2.6 免疫组化法检测NLRP3、ASC、Caspase-1、MMP-2表达水平
石蜡切片脱蜡水化,加入适量内源性过氧化物酶阻滞剂,室温下孵育10 min后,滴加适量稀释的NLRP3兔多克隆抗体(1∶80),ASC兔多克隆抗体(1∶100),Caspase-1兔多克隆抗体(1∶100),MMP2兔多克隆抗体(1∶100),室温放置1 h;PBS缓冲液冲洗3次后滴加适量反应增强液,室温孵育20 min,PBS缓冲液冲洗3次后滴加適量增强酶标山羊抗鼠/兔IgG聚合物,室温下孵育30 min;PBS缓冲液冲洗后再滴加DAB显色剂,室温下孵育5 min;复染、脱水、透明、封片、镜检,对测定组织中NLRP3、ASC、Caspase-1、MMP-2的平均光密度值进行比较分析。
2.7 统计学方法
应用SPSS 21.0软件进行统计分析,若数据满足正态性及方差齐性,则用单因素方差分析,进一步采用LSD法对各组间有统计学意义的数据进行组间比较,否则用秩和检验。计量资料以“x±s”表示,以P<0.05表示差异有统计学意义。
3 结果
3.1 各组大鼠耳廓皮损情况
外用药物14 d后,肉眼观察大鼠耳廓皮损形态发现,空白组皮肤外观呈淡粉色,耳廓轻薄,触感柔软,表面正常,无脱屑、肿胀;模型组和基质组大鼠耳廓皮肤暗红、肿胀,表皮粗糙,有脱屑、痂皮、脓肿和小丘疹,触感明显变硬变厚;石榴皮多酚低、中、高浓度组红肿、粗糙、脱屑及丘疹等情况均有不同程度减轻,以石榴皮多酚中、高浓度疗效较明显;克林霉素组炎症明显减轻,耳廓充血、脓肿和丘疹等大部分消退,可见少量脱屑。
3.2 各组大鼠耳廓病理改变
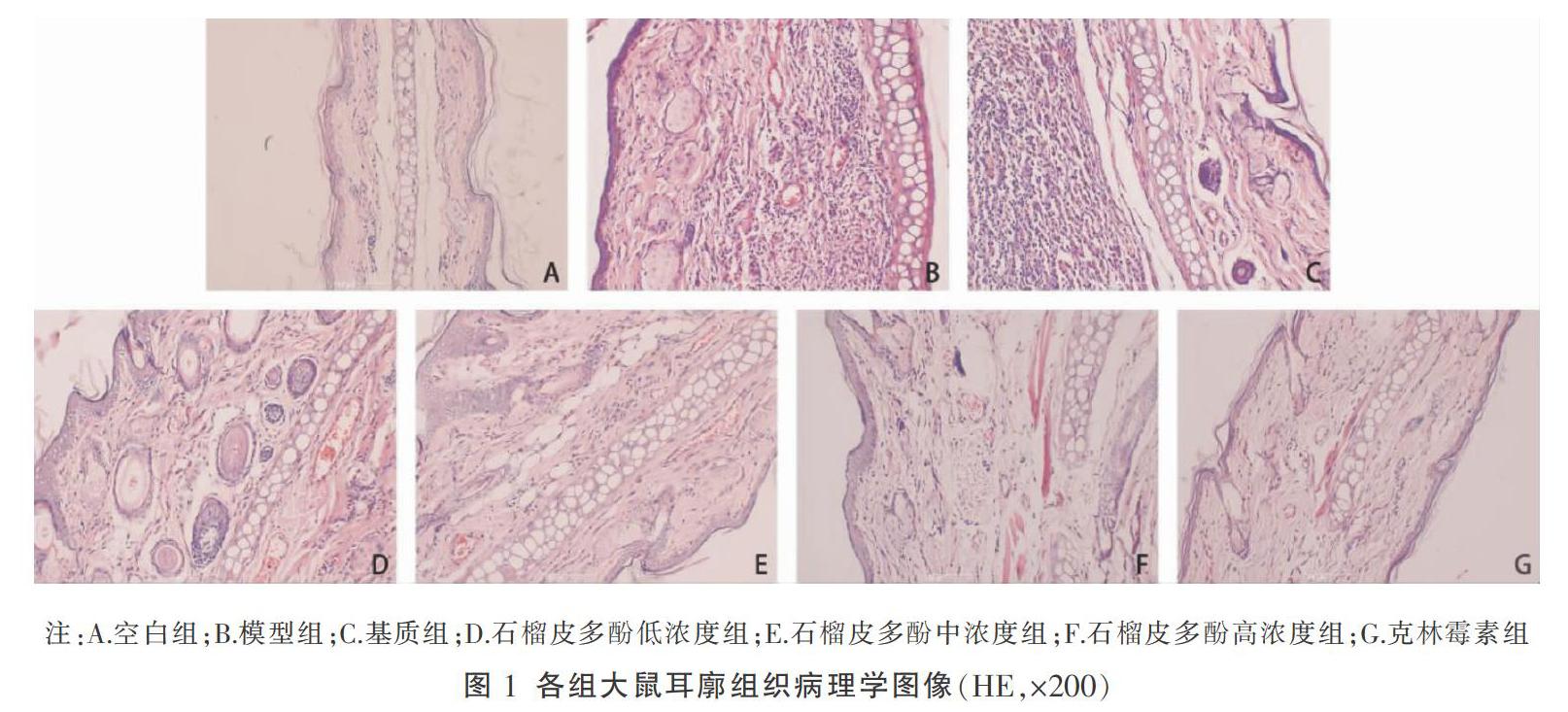
空白组大鼠耳廓镜检可见表皮细胞正常,皮脂腺无明显增生,无明显炎性细胞浸润;模型组及基质组可见真皮内炎症细胞弥漫性浸润,皮脂腺增生明显,毛囊口扩大,局部出血;石榴皮多酚低、中、高浓度组炎症浸润、皮脂腺增生、毛囊口扩大均有不同程度减轻,以中、高浓度最明显;克林霉素组无明显炎症细胞浸润,无明显皮脂腺增生、扩大。见图1。
3.3 各组大鼠NLRP3、ASC、Caspase-1、MMP-2表达情况
NLRP3、ASC、Caspase-1、MMP-2主要分布在细胞质、细胞核、细胞间质上,见图2。与空白组比较,模型组及基质组NLRP3、ASC、Caspase-1、MMP-2的表达均明显升高(P<0.05)。与模型组比较,石榴皮多酚各组、克林霉素组NLRP3表达明显下降(P<0.05),其中石榴皮多酚中浓度组下降最显著(P<0.05);石榴皮多酚低浓度组、克林霉素组ASC的表达差异无统计学意义(P>0.05),石榴皮多酚中、高浓度组ASC表达均有下降(P<0.05),其中石榴皮多酚高浓度组表达下降更为显著(P<0.05);石榴皮多酚各组、克林霉素组Caspase-1的表达明显下降(P<0.05),其中克林霉素组下降最为显著,其次为石榴皮多酚中、高浓度组(P<0.05),中、高浓度组间比较无明显差异(P>0.05);石榴皮多酚低、高浓度组MMP-2表达均有下降(P<0.05),石榴皮多酚中浓度组的表达差异无统计学意义(P>0.05),克林霉素组表达升高(P<0.05)。见表2。
3.4 各组大鼠IL-1β、IL-18表达水平
与空白组比较,模型组大鼠血清IL-1β、IL-18炎症因子水平明显升高,差异具有统计学意义(P<0.05)。与模型组比较,石榴皮多酚各组、克林霉素组大鼠血清IL-1β炎症因子水平明显下降(P<0.05),其中克林霉素组下降最为显著(P<0.05),其次为石榴皮多酚高浓度组(P<0.05),中、低浓度组组间无明显差异(P>0.05);石榴皮多酚各组、克林霉素组大鼠血清IL-18炎症因子水平明显下降(P<0.05),其中石榴皮多酚高浓度组及克林霉素组下降最明显(P<0.05),高浓度组与克林霉素组组间无明显差异(P>0.05),石榴皮多酚中、低浓度组组间无明显差异(P>0.05)。见表3。
4 讨论
痤疮的病因复杂,其中P. acnes增殖引起的炎症及免疫反应,是痤疮的重要发病因素之一。研究[11-12]发现,P. acnes刺激的巨噬细胞、皮脂腺细胞及角质形成细胞显著增加了IL-1β的释放。李晓娟等[3]通过对痤疮皮损中的炎性体的类型进行分型,并对暴露于P. acnes中的单核细胞分泌IL-1β的过程进行检测,发现参与这一过程的是NLRP3炎性小体。NLRP3作为NLRP3炎症体的传感器成分,在先天免疫和炎症中起着至关重要的作用,其可响应病原体和其他损伤的相关信号,启动由NLRP3、ASC和Caspase-1组成的炎症体聚合复合物的形成。ASC作为NLRP3炎性小体衔接蛋白,其磷酸化对炎症激活起重要作用。Caspase-1在NLRP3炎性小体促炎作用中也尤为重要,NLRP3通过招募并激活Caspase-1,促进细胞外环境中IL-1β和IL-18的剪切成熟与分泌。IL-1β和IL-18与多种细胞因子协同作用,可抑制细胞自噬,引起炎症性凋亡等免疫效应[13-14]。P. acnes增殖还可以促进基质金属蛋白酶MMP-2分泌,MMP-2可以在P. acnes在组织中扩散的过程中造成细胞溶解和组织损伤,进一步介导痤疮炎性反应的发生及发展[15]。一项对中国人群中NLRP3基因多态性与寻常型痤疮的相关性研究[16]表明,NLRP3SNP rs10754558与寻常型痤疮的发病显著相关。由此推测,抑制NLRP3炎症体介导的免疫炎症反应或许是治疗痤疮的重要途径。
“以皮治皮”是一种在中医辨证论治指导下的思维方法,是指将经过加工处理过的动物或植物的皮作为药物来治疗皮肤病的方式。本课题组前期以“以皮治皮”理论为核心着重研究了石榴皮治疗痤疮的疗效,研究发现其可显著减少痤疮患者丘疹的发生,改善皮肤红肿及干燥脱屑等情况,并能长久保持皮肤水润美白[17-18],且患者满意度高。石榴皮多酚是石榴皮中的主要有效成分,大量研究已证实石榴皮多酚具有抗氧化、抗菌、抗过敏、促进皮肤愈合等功效,其在其他疾病中的应用也已得到广泛研究[19-22]。课题组前期研究还证实了石榴皮多酚能在体外抗P. acnes、抗疤痕、调脂、保湿等功效[5-7]。现进一步探索其是否可以通过调节NLRP3炎性小体相关的通路抑制炎症免疫反应来治疗痤疮。
本研究表明,石榴皮多酚乳膏的局部应用可以减少NLRP3炎性体的激活有效抑制P. acnes增殖引起的痤疮。经石榴皮多酚干预后,与模型组相比,石榴皮多酚各组及克林霉素组大鼠耳部表皮粗糙、发红、肿胀、丘疹等炎症表现减轻,炎性细胞浸润及皮脂腺增生减少,血清促炎因子IL-1β、IL-18水平也明显下降,说明石榴皮多酚乳膏具有良好的抗炎效果。免疫组化结果提示,与模型组相比,石榴皮多酚各组及克林霉素组NLRP3、Caspase-1表达明显降低,中、高浓度组ASC水平明显下降(P<0.05),低、高浓度组MMP-2表达下降(P<0.05),说明石榴皮多酚乳膏治疗作用可能与降低痤疮组织中NLRP3、ASC、Caspase-1、MMP-2表达量有关。由此推测,石榴皮多酚乳膏可以通过抑制NLRP3炎性小体及其相关通路达到抗炎抗痤疮的作用。
本研究探讨了石榴皮多酚对NLRP3、ASC、Caspase-1、MMP-2、IL-1β及IL-18的影响,为阐明石榴皮多酚乳膏治疗痤疮的作用机制奠定了基础,为痤疮的非抗生素治疗提供了新思路及实验依据。痤疮的发病机制复杂,石榴皮多酚是否还对痤疮发病过程的其他环节有干预作用有待进一步的研究。
参考文献
[1] ZAENGLEIN A L, PATHY A L, SCHLOSSER B J, et al. Guidelines of care for the management of acne vulgaris[J]. Journal of the American Academy of Dermatology, 2016, 74(5): 945-973.e33.
[2] 鞠 强.中国痤疮治疗指南(2019修订版)[J].临床皮肤科杂志, 2019,48(9):583-588.
[3] 李晓娟,林新瑜.痤疮丙酸杆菌与痤疮炎性反应关系的研究进展[J].临床皮肤科杂志,2017,46(2):142-145.
[4] DE TORRE-MINGUELA C, MESA DEL CASTILLO P, PELEGRíN P. The NLRP3 and pyrin inflammasomes: Implications in the pathophysiology of autoinflammatory diseases[J]. Frontiers in Immunology, 2017, 8: 43.
[5] 张晓玲,朱明芳,杨 柳,等.石榴皮多酚对痤疮丙酸杆菌体外抑菌活性的研究[J].湖南中医药大学学报,2015,35(9):23-25.
[6] 杨逸璇,朱明芳,王 峰,等.石榴皮多酚软膏通过介导TGF-β/smad信号通路以抗痤疮瘢痕形成的机制研究[J].湖南中医药大学学报,2019,39(5):596-599.
[7] 魏 露,吳淑辉,张 曦,等.石榴皮多酚乳膏对金黄地鼠皮脂腺斑LXRα/SREBP-1信号通路的影响[J].中国皮肤性病学杂志,2020,34(10):1134-1138.
[8] 黄继汉,黄晓晖,陈志扬,等.药理试验中动物间和动物与人体间的等效剂量换算[J].中国临床药理学与治疗学,2004,9(9):1069-1072.
[9] 李秀玉.玉容消痤颗粒抗实验性兔耳痤疮研究[J].北京中医药大学学报,2008,31(5):320-322,361.
[10] 林姗姗,金 鑫,黄 炜,等.复方颠倒凝胶对大鼠耳廓痤疮模型治疗研究[J].天津中医药大学学报,2017,36(5):392-395.
[11] 李晓娟,林新瑜,沈 柱,等.白介素-1β及NOD样受体蛋白3在痤疮炎性反应中的作用[J].中南大学学报(医学版),2019,44(4):413-418.
[12] 李晓娟,林新瑜,沈 柱,等.白介素-18及NOD样受体蛋白3炎性小体在痤疮发病中的作用研究[J].四川大学学报(医学版),2019,50(1):66-70.
[13] LIU P H, HUANG G J, WEI T, et al. Sirtuin 3-induced macrophage autophagy in regulating NLRP3 inflammasome activation[J]. Biochimica et Biophysica Acta Molecular Basis of Disease, 2018, 1864(3): 764-777.
[14] DUPONT N, JIANG S Y, PILLI M, et al. Autophagy-based unconventional secretory pathway for extracellular delivery of IL-1β[J]. The EMBO Journal, 2011, 30(23): 4701-4711.
[15] KWON H H, SUH D H. Recent progress in the research about Propionibacterium acnes strain diversity and acne: Pathogen or bystander?[J]. International Journal of Dermatology, 2016, 55(11): 1196-1204.
[16] SHEN C, WANG Q Z, SHEN Z Y, et al. Genetic association between the NLRP3 gene and acne vulgaris in a Chinese population[J]. Clinical and Experimental Dermatology, 2019, 44(2): 184-189.
[17] 杨 柳,谢 遥,胡 彬,等.朱明芳治疗痤疮经验[J].湖南中医杂志,2016,32(2):39-40,47.
[18] 謝 遥,胡 彬,杨 柳,等.朱明芳教授从肺胃论治痤疮[J].光明中医,2016,31(21):3100-3101.
[19] FU L, XU J, BAO X W, et al. Study on antioxidation effect of polyphenols from pomegranate peel in vivo[J]. Agricultural Science & Technology, 2016, 17(1): 164-167.
[20] 陆雪莹,热依木古丽·阿布都拉,李艳红,等.新疆石榴皮总多酚有效部位的抗氧化、抗菌及抗肿瘤活性[J].食品科学,2012,33(9):26-30.
[21] 史李娜.石榴皮多酚有效部位抗消化性溃疡的药效学研究[D].乌鲁木齐:新疆医科大学,2015:1-4.
[22] 冯 甜,刘 盟,程路峰,等.基于凋亡和自噬途径的石榴皮多酚对人前列腺癌PC3细胞的抑制作用机制研究[J].中国药房,2020,31(16):1978-1983.

