乳酸菌诱导线粒体生物发生对绵羊肌纤维特性和肉品质的影响
白艳苹,侯艳茹,苏 琳,孙 冰,窦 露,赵丽华,刘瑞军,敖特恒格日乐,靳 烨
乳酸菌诱导线粒体生物发生对绵羊肌纤维特性和肉品质的影响
白艳苹1,侯艳茹1,苏 琳1,孙 冰1,窦 露1,赵丽华1,刘瑞军2,敖特恒格日乐3,靳 烨1※
(1. 内蒙古农业大学食品科学与工程学院,呼和浩特 010018;2. 内蒙古富川饲料科技股份有限公司,巴彦淖尔 015000;3. 乌拉特中旗农牧和科技局,巴彦淖尔 015000)
为了研究乳酸菌对苏尼特羊肌纤维特性和肉品质的影响及其作用机理,选择12只、3月龄健康无病的纯种苏尼特羊,随机分为2组:对照组(基础日粮)和乳酸菌组(基础日粮、2 g/只(植物乳杆菌添加量为3×1010cfu/g)),进行为期90 d的饲喂试验。屠宰后取其背最长肌,利用ATPase组织化学染色法和实时荧光定量技术对肌纤维特性、肌球蛋白重链(Myosin Heavy Chains,)和线粒体生物发生相关基因的mRNA表达量进行测定,此外测定代谢酶活力、生长性能和肉品质,探究肌纤维特性存在差异的原因。结果表明:乳酸菌显著提高了肌肉排酸24 h的pH值(<0.01),降低肉的黄度值(<0.05)和蒸煮损失(<0.01)。肌纤维分析结果显示乳酸菌显著提高了ⅡA型肌纤维的数量比例(<0.01),降低了ⅡB型肌纤维的数量比例(<0.01),同时(<0.05)、(<0.01)、(<0.01)mRNA表达量均显著提高。乳酸菌显著提高了琥珀酸脱氢酶(Succinate Dehydrogenase,SDH)的酶活力(<0.05),降低了乳酸脱氢酶(Lactic Dehydrogenase,LDH)的酶活力(<0.05)。此外,乳酸菌显著提高了腺苷酸活化蛋白激酶1(AMP-activated protein kinase1,1)(<0.01)、沉默信息调节因子1(Sirtuin1,1)(<0.01)和细胞色素C氧化酶Ⅳ(Cytochrome c oxidase,)(<0.05)mRNA表达量。综上所述,日粮添加乳酸菌可能通过提高11和mRNA表达量促进骨骼肌线粒体生物发生,增强肌肉的氧化代谢能力,促进苏尼特羊的肌纤维类型发生转化,进而改善肉品质,研究结果为改善绵羊的肉用品质提供参考。
肉;品质控制;乳酸菌;线粒体生物发生;肌纤维特性;苏尼特羊
0 引 言
基于国家限牧政策的实施,内蒙古地区苏尼特羊出现不同程度的肉品质劣化现象,由此引发的肉品质改善问题成为亟待解决的重点问题[1]。肌纤维是骨骼肌的基本结构单位,成年骨骼肌显示出很好的可塑性,可以响应无数外部刺激并按照以下顺序在不同肌纤维类型之间进行转化:I↔IIa↔IIx↔IIb[2]。不同类型肌纤维的功能特性截然不同,会直接影响到畜禽肉品质,所以调控肌纤维类型转化成为提高肉品质的重要手段。
日粮中的营养物质经消化吸收后参与到机体能量和蛋白质代谢中,进而影响肌肉发育和肌纤维类型的转化和组成。乳酸菌作为畜禽饲料添加剂,在提高饲料的营养价值、动物的生长性能以及改善肉品质方面均显示出良好特性[3-4]。近年来也有研究显示,乳酸菌在促进肌纤维类型转化、改善肌肉力量和肌肉抗疲劳能力方面表现出很好的作用潜力,但其机制仍不明确[5],且少有关于乳酸菌对绵羊肌肉微观结构影响的研究,因此利用组织化学法分析乳酸菌与肌纤维类型转化信号分子之间的关系至关重要。
线粒体是骨骼肌细胞中主要的ATP合成和能量转换细胞器,其生物发生过程与肌纤维的氧化能力和类型转化密切相关[6-7]。最近一项研究表明,给老年大鼠饲喂乳杆菌后会增强大鼠的运动能力,降低葡萄糖和胰岛素水平,从而激活腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)[8]。AMPK是调控线粒体生物发生的关键因子,对线粒体生物发生有促进作用。基于此本试验认为乳酸菌可能通过激活AMPK信号通路促进骨骼肌线粒体生物发生,进而改变肌纤维特性。
因此,本研究以苏尼特羊为试验动物,通过测定肌纤维特性、肌肉相关代谢酶的活力和肉品质指标,旨在研究日粮添加乳酸菌对肌纤维特性和肉品质的影响,同时测定线粒体生物发生中关键基因表达量,进一步探究乳酸菌调节肌纤维类型转化的内在机理,为提高绵羊的生产效率提供技术参考。
1 材料与方法
1.1 试验设计
选取3月龄,平均体质量为(19.77±4.05)kg,健康无病的纯种苏尼特羊共12只(产自内蒙古巴彦淖尔市乌拉特中旗),采用单因素完全随机化试验,将苏尼特羊随机分为对照组和乳酸菌组,每组6只。对照组饲喂基础日粮(以玉米、精饲料为主),不含任何抗生素,基础日粮组成及营养水平见表1。乳酸菌组在对照组日粮的基础上补充植物乳杆菌(3×1010cfu/g),根据张天阳[9]的研究确定其添加水平为2 g/只,每日饲喂1次。试验期自由活动、饮水,预试验期7 d,试验期90 d。
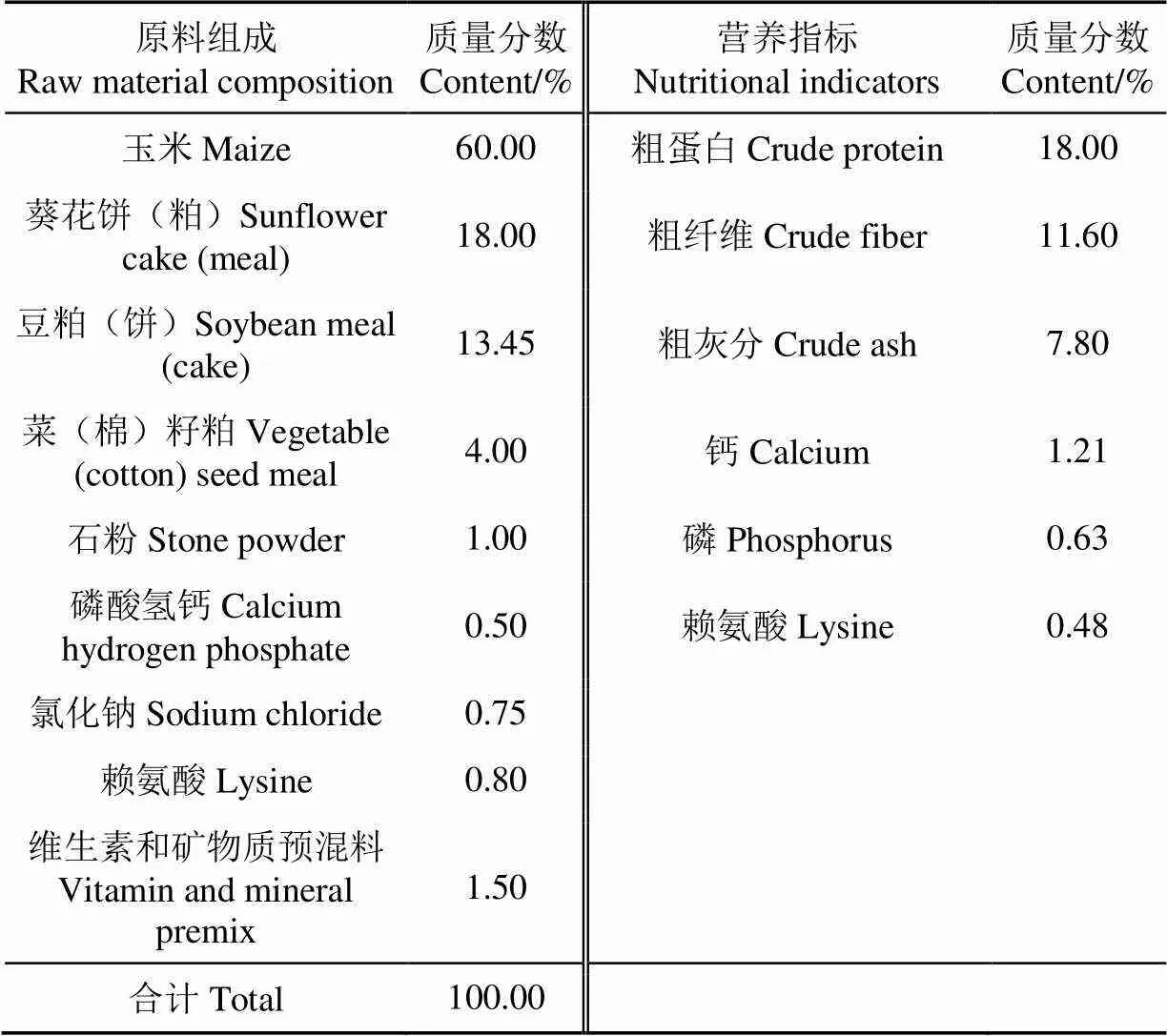
表1 基础日粮组成及营养水平
注:维生素和矿物质预混料中包括维生素A、维生素D3、维生素E、维生素K3、维生素B12、硫酸亚铁、硫酸锌、硫酸铜、硫酸锰等。
Note: Vitamin and mineral premix includes vitamin A, vitamin D3, vitamin E, vitamin K3, vitamin B12, ferrous sulfate, zinc sulfate, copper sulfate, manganese sulfate, etc.
1.2 试验试剂
植物乳杆菌,山东宝来利来生物工程股份有限公司;Trizma®base,上海百研生物科技有限公司;三磷酸腺苷二钠盐,北京酷来搏科技有限公司;异戊烷,阿法埃莎(天津)化学有限公司;RNAiso Plus、PrimeScriptTM RT reagent Kit with gDNA Eraser、TB GreenTM Premix Ex TaqTM Ⅱ,大连宝生物工程有限公司;乳酸脱氢酶(Lactate Dehydrogenase,LDH)、苹果酸脱氢酶(Malate Dehydrogenase,MDH)、琥珀酸脱氢酶(Succinate Dehydrogenase,SDH)试剂盒,南京建成生物工程研究所。
1.3 仪器与设备
MEV冰冻切片机,德国SLEE公司;Leica 4000B显微镜,德国徕卡公司;Eppendorf 5417冷冻离心机,德国Eppendorf生物公司;Biometra PCR扩增仪,北京北方华奥贸易有限责任公司;LightCycler®96实时荧光定量PCR仪,罗氏诊断产品(上海)有限公司;SYNERGY H1多功能微孔板检测仪,美国Bio-Tek Instruments公司;UV-1800型紫外/可见分光光度计,上海美谱达仪器有限公司。
1.4 测定指标与方法
1.4.1 肉品质的测定
屠宰45 min和静置排酸24 h后分别测定苏尼特羊的pH值,记为pH0和pH24。同时在屠宰1 h内测定肌肉的亮度值()、红度值()、黄度值()、剪切力值和蒸煮损失。
1.4.2 肌纤维组织学特性的测定
屠宰后迅速取其背最长肌,沿肌纤维方向进行切割,经脱水、速冻,制成肌纤维样品。将样品包埋后进行冰冻切片(厚度为10m),利用ATPase染色法进行染色[10]。晾干后在显微镜下观察,选取清晰视野进行采片,保证每只羊统计的肌纤维总数达到1 000根。使用Leica Qwin V3纤维彩图分析软件统计分析不同类型肌纤维的数量、直径和横截面积。
1.4.3 基因表达量的测定
样品的采集:宰后45 min内,在苏尼特羊背最长肌上取约100 mg肌肉放入无酶无菌冻存管中,保存于-80 ℃条件下,用于总RNA的提取。
RNA的提取:采用Trizol法提取肌肉中的总RNA,并用质量分数1%的琼脂糖凝胶电泳和微量分光光度计检测其完整性、浓度和纯度。
反转录:将提取的总RNA按照PrimeScriptTM RT reagent Kit with gDNA Eraser指导说明书进行反转录,合成cDNA。
实时荧光定量PCR(Real Time PCR):以cDNA为模板,利用实时荧光定量PCR试剂盒进行Real Time PCR反应。PCR 程序为:95 ℃预变性30 s;95 ℃变性5 s,57 ℃退火30 s,72 ℃延伸30 s,共40个循环;72 ℃延伸10 min。扩增结束后根据溶解曲线评估引物特异性,以甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-Phosphate Dehydrogenase,)作为内参基因,采用2-ΔΔCt法对数据进行处理。引物均由上海生工公司合成,引物序列见表2。
1.4.4 代谢酶活力的测定
取0.5 g背最长肌样品,加入生理盐水制成10%的匀浆液,冰浴匀浆(3 500 r/min,30 s)后4 ℃离心(4 000 r/min,10 min),取上清液,按照试剂盒说明书对LDH、MDH和SDH活力进行测定。
1.5 数据统计分析
利用SPASS19.0软件对数据进行单因素方差分析(ANOVA)。所有数据均用平均值±标准差表示,以<0.05和<0.01为显著和极显著性检验标准。

表2 目的基因及内参基因引物
2 结果与分析
2.1 日粮添加乳酸菌对苏尼特羊肌纤维组织学特性的影响
2.1.1 肌纤维ATPase染色结果
根据不同肌纤维内ATPase的酸碱稳定性的差异,利用ATPase组织化学染色法对苏尼特羊背最长肌的肌纤维进行染色,可以将肌纤维可分为Ⅰ型(慢速氧化型,黑色)、ⅡA型(快速氧化型,白色)和ⅡB型(快速酵解型,棕色),结果如图1所示。
2.1.2 日粮添加乳酸菌对苏尼特羊肌纤维数量比例的影响
由图2可知,苏尼特羊背最长肌中肌纤维以ⅡB型为主,氧化型肌纤维占40%以上,日粮添加乳酸菌后不同类型肌纤维的数量比例在两组间存在差异,其中乳酸菌组ⅡA型肌纤维的数量比例极显著高于对照组(<0.01),ⅡB型肌纤维的数量比例极显著低于对照组(<0.01),而Ⅰ型肌纤维在两组间无显著性差异(>0.05),说明肌纤维的数量比例受到乳酸菌的影响。据报道植物源乳酸菌可以显著提高生长育肥猪背最长肌中氧化型肌纤维数量比,相应地降低酵解型肌纤维数量比例[11]。Chen等[5]研究也发现长期补充植物乳杆菌TWK10可以增加小鼠的肌肉质量和腓肠肌中氧化型肌纤维的数量,且具有剂量依赖性。由此可知日粮添加乳酸菌对改变苏尼特羊背最长肌的肌纤维组成有显著作用,可以促进肌纤维由酵解型向氧化型转化。
2.1.3 日粮添加乳酸菌对苏尼特羊肌纤维直径和横截面积的影响
肌纤维的数量在动物出生前基本确定,出生后肌肉组织的发育主要体现在现有肌纤维的增粗和延长。由图3所示,苏尼特羊的平均肌纤维直径和横截面积在两组间均无显著性差异(>0.05),说明日粮添加乳酸菌对背最长肌的肌纤维特性无显著影响。张应汉等[12]研究显示,给小鼠灌胃鼠李糖乳杆菌没有改变其股四头肌的肌纤维横截面积,对小鼠的生长发育没有显著影响,然而,还有试验表明长期日粮补充罗伊氏乳杆菌可以显著降低猪背最长肌的肌纤维直径和横截面积[13]。可见乳酸菌对肌纤维特性的影响各不相同,这取决于所使用的乳酸菌的种类、使用剂量和时间、试验动物、日粮组成及与其他膳食补充剂的相互作用[14]。
2.2 日粮添加乳酸菌对苏尼特羊MyHC mRNA相对表达量的影响
免疫组织化学研究表明,根据肌球蛋白重链(Myosin Heavy Chains,)的类型可将肌纤维分为Ⅰ型(慢速氧化型),Ⅱa型(快速氧化型),Ⅱx型(中间型)和Ⅱb型(快速酵解型)[15]。由图4可知,乳酸菌组和mRNA表达量极显著高于对照组(<0.01),mRNA表达量显著高于对照组(<0.05),而mRNA表达量无显著差异(>0.05)。这说明mRNA表达量对肌纤维的分型结果与ATPase染色法基本一致,日粮添加乳酸菌对提高苏尼特羊背最长肌中氧化型肌纤维的比例有显著作用。李敏华[16]的研究也显示,乳酸菌可以显著增加育肥猪背最长肌中mRNA表达量,与本文结果一致。
2.3 日粮添加乳酸菌对苏尼特羊代谢酶活力的影响
肌肉的代谢类型可大致分为氧化型、酵解型和中间型,相同条件下,肌肉处于何种代谢类型与肌肉自身状况有关。肌肉中LDH、MDH和SDH活力能在一定程度上反映肌肉能量代谢情况。LDH是参与糖酵解途径的重要酶类,其活力可反映肌肉无氧酵解的活跃程度[17]。MDH是合成苹果酸的关键酶之一,也是三羧酸循环中的一种酶,广泛存在于线粒体上[18]。与参与三羧酸循环的其他酶类不同,SDH是唯一结合到线粒体内膜的多亚基酶,可为真核细胞线粒体呼吸链提供电子[19]。MDH和SDH均为有氧代谢途径关键酶,其活力可反映肌肉的有氧代谢程度。
如表3所示,日粮添加乳酸菌可以显著降低苏尼特羊背最长肌的LDH活力(<0.05),显著提高SDH活力(<0.05),但对MDH活力无显著影响(>0.05)。该试验结果说明乳酸菌能够提高肌肉的氧化代谢水平,这与乳酸菌组氧化型肌纤维比例较高,酵解型肌纤维比例较低一致。

表3 日粮添加乳酸菌对苏尼特羊代谢酶活力的影响
2.4 日粮添加乳酸菌对苏尼特羊生长性能和肉品质的影响
从表4可以看出,两组苏尼特羊的初始体质量无显著差异(>0.05),饲喂90 d后,与对照组相比,日粮添加乳酸菌对苏尼特羊的末体质量、平均日增质量均无显著影响(>0.05),说明日粮添加乳酸菌对苏尼特羊的生长性能无明显作用。
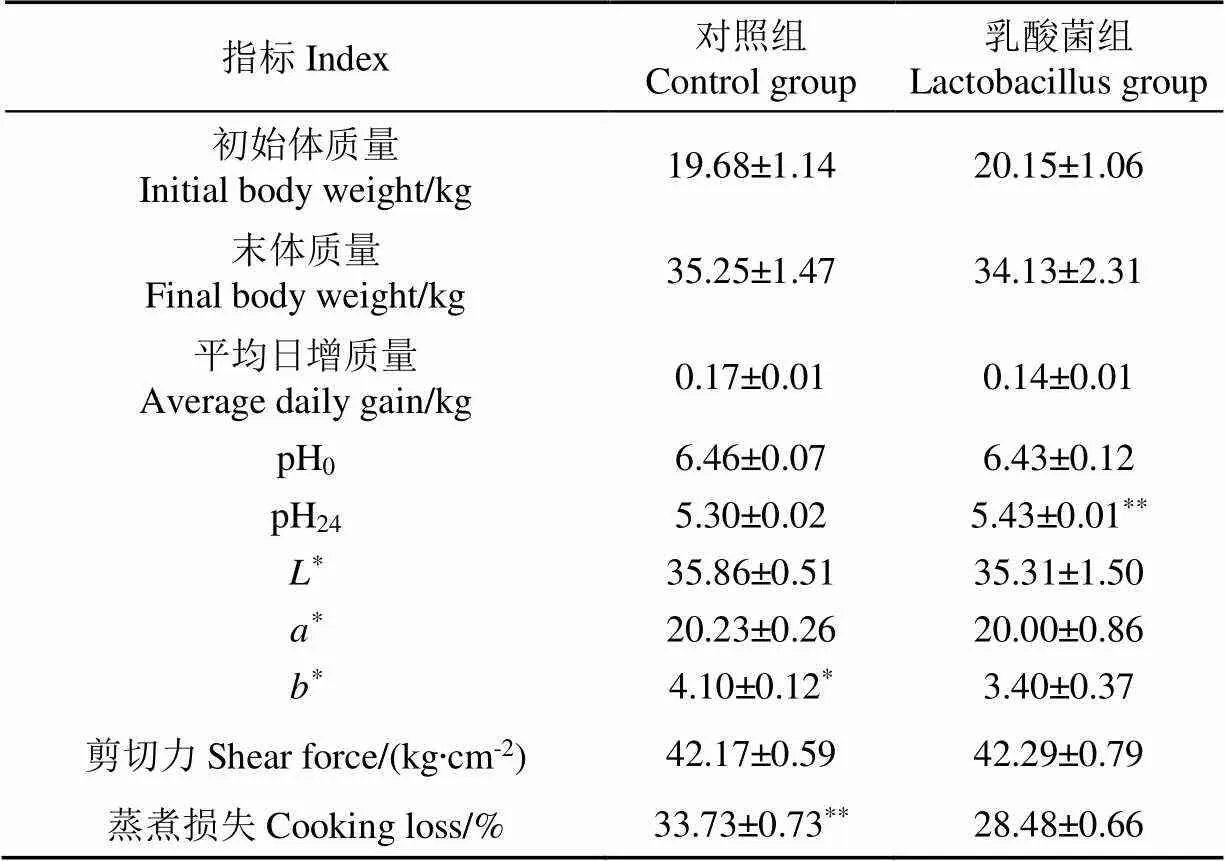
表4 日粮添加乳酸菌对苏尼特羊生长性能和肉品质的影响
pH值是评价肉品质的重要指标,宰后肌肉pH值的下降不仅会破坏水与蛋白质的结合,而且还会影响肌肉蛋白特性进而对肉质产生不利影响[20]。由表4可知,两组的初始pH值无显著差异(>0.05),经静置排酸24 h后,乳酸菌组的pH24值极显著高于对照组(<0.01),这说明日粮添加乳酸菌可以降低宰后肌肉pH值的下降速率。色泽是直接影响消费者购买意愿的重要指标,乳酸菌组的b值显著低于对照组(<0.05),而L值和a值在两组间无统计学差异(>0.05)。这与Rabelo等[21]试验结果一致,即用乳酸菌接种玉米青贮可以显著降低绵羊肌肉的b值。剪切力值在两组间无显著性差异(>0.05),表明日粮添加乳酸菌对肌肉嫩度无显著影响。乳酸菌组的蒸煮损失极显著低于对照组(<0.01),说明日粮添加乳酸菌可以提高苏尼特羊肌肉的系水力,增加肉的多汁性。Dowarah等[22]同样研究发现,饲粮中添加乳酸菌能提高宰后猪肉的系水力。
肌纤维的特性和类型对肉品质形成的重要性不言而喻[23]。乳酸菌组的pH24值极显著高于对照组(<0.01),这可能是因为乳酸菌组的氧化型肌纤维比例较高。氧化型肌纤维由于糖原含量低,糖酵解速率慢,因此宰后乳酸的积累慢,导致pH值下降速率也较慢[24]。动物屠宰后,肌红蛋白成为肉的主要呈色物质,其含量和所处的化学状态决定着肉的色泽[25]。由于氧化型肌纤维的细胞色素和肌红蛋白含量较高,因此氧化型肌纤维越多肌肉色泽越好[26]。本试验中乳酸菌组b值显著低于对照组(<0.05),这可能与乳酸菌组Ⅱa型肌纤维比例较高有关。同时肌肉氧化后导致氧合肌红蛋白变为高铁肌红蛋白,肉色变差,而植物乳杆菌具有抗氧化作用,因此能在一定程度上抑制该氧化进程,从而发挥护色作用。研究显示,Ⅰ型肌纤维的数量与滴水损失呈负相关[27]。本试验中乳酸菌组蒸煮损失极显著低于对照组(<0.01),同时mRNA表达量显著高于对照组(<0.05),与上述结果相似。
2.5 日粮添加乳酸菌对苏尼特羊骨骼肌线粒体生物发生的影响
线粒体是半自主遗传细胞器,其生物发生受到线粒体DNA和核DNA的双重调控。当细胞核接收到外部环境刺激的信号时,以AMPK为传递者,与沉默信息调节因子1(Sirtuin1,SIRT1)进行正反馈循环[28],进而激活过氧化物酶体增殖物激活受体共激活因子1-(Peroxisome proliferator-activated receptor gamma co-activator 1-alpha,PGC-1),促进线粒体生物发生[29]。此外,AMPK也可直接调控细胞核的PGC-1基因产生第一种生物发生反应的控制蛋白质PGC-1,PGC-1蛋白继续调控细胞核基因制造各种核呼吸因子(Nuclear Respiratory Factors,NRFs),刺激线粒体转录因子A(Mitochondrial Transcription Factor A,TFAM)的表达,TFAM作为调控因子,调控线粒体自身DNA的复制和基因转录,从而启动线粒体蛋白的协同表达[30]。因此,本试验对AMPK-SIRT1-PGC-l信号轴上基因的mRNA表达量进行测定,研究乳酸菌对苏尼特羊骨骼肌线粒体生物发生的影响。
如图5所示,与对照组相比,乳酸菌组1、1mRNA表达量极显著升高(<0.01),mRNA表达量显著升高(<0.05),其他线粒体生物发生的关键调节因子差异不显著(>0.05)。AMPK是介导线粒体生物发生的一个关键因素,Hor等[8]研究发现,给老年大鼠饲喂乳酸杆菌可以通过降低葡萄糖和胰岛素水平激活AMPK,与本试验研究结果一致。这说明乳酸菌有望成为AMPK磷酸化的诱导因子。SIRT1是机体内另一重要能量感受器,当骨骼肌中SIRT1表达量升高时线粒体生物发生增加,肌纤维类型发生转变[31]。相关研究表明,短乳杆菌T2102可以促进SIRT1表达[32]。Jang等[33]研究也发现,给雄性小鼠饲喂清酒乳杆菌可以诱导AMPK磷酸化,促进SIRT1、PGC-1的表达。PGC-1是衔接线粒体生物发生和肌纤维类型转化的关键枢纽。本试验中对照组-1mRNA表达量为1.18,乳酸菌组为1.81,差异虽不显著但有增高趋势(=0.061)。可见,乳酸菌可能作用于AMPK-SIRT1-PGC-l信号通路。此外,细胞色素C氧化酶Ⅳ(Cytochrome c oxidase,COXⅣ)是反映组织有氧氧化能力的标志酶,位于线粒体内膜上,其活力的高低决定了线粒体生物发生水平,因此本试验对该基因进行了测定,结果显示,对照组mRNA表达量为1.44,乳酸菌组为2.27,显著高于对照组(<0.05),该结果说明日粮添加乳酸菌对提高苏尼特羊骨骼肌的线粒体生物发生水平有积极作用。综上所述,乳酸菌介导AMPK-SIRT1-PGC-l信号通路,刺激TFAM的表达,促进mtDNA的复制和基因转录,进而激活线粒体内膜上的COXⅣ,增强骨骼肌的线粒体生物发生。
骨骼肌的线粒体生物发生与肌纤维的氧化能力和类型转化密切相关。在氧化代谢较活跃的氧化型肌纤维中线粒体的含量相对较高,通过增加肌肉线粒体DNA含量可以促进-1和mRNA的表达,提高线粒体生物发生,同时增加Ⅰ型肌纤维比例,降低Ⅱb型肌纤维的比例[6]。说明氧化型肌纤维所占比例较高的肌肉其线粒体生物发生程度也较高,通过增加线粒体生物发生促进肌纤维类型转化有望成为改善肉品质的新方法。据报道每日给大鼠饲喂短双歧杆菌B-3可以增加比目鱼肌的肌肉质量并激活AMPK,促使PGC-l和COX高表达,诱导骨骼肌线粒体生物发生,同时增加线粒体能量代谢率和氧化型肌纤维比例[34]。该结论与本试验结果相似,即乳酸菌通过提高AMPK、SIRT1和COXⅣ的基因表达量,促进线粒体生物发生,提高肌肉的氧化代谢能力,进而促进氧化型肌纤维的形成。乳酸菌作为一种肠道益生菌,对维持肠道微生态平衡至关重要,近年来也逐渐有研究表明肠肌轴可能存在,最佳的肠道微生物群组成可能会影响肌肉蛋白质的合成,线粒体的生物发生和功能以及肌肉糖原的储存,甚至改变肌纤维组成,因此未来可以对该方向展开深入研究[35-36]。
3 结 论
日粮添加乳酸菌提高了苏尼特羊背最长肌的氧化代谢水平,使肌纤维由酵解型向氧化型转化,降低肉的蒸煮损失(<0.01),影响色泽(<0.05),延缓宰后pH值的下降(<0.01),对肉品质有明显改善作用。进一步测定骨骼肌线粒体生物发生水平发现,日粮添加乳酸菌使1、1、mRNA表达量升高(<0.05),这可能是导致肌纤维类型的转化原因。通过激活线粒体生物发生促进肌纤维类型转化是未来改善肉品质的重要研究方向,亦具有广阔的应用前景。
[1] 永勇,刘兴能,邓卫东. 浅析山区山羊“放牧+圈养”的饲养模式[J]. 中国畜禽种业,2019,15(4):136-137.
[2] Duan Y, Li F, Tan B, et al. Metabolic control of myofibers: Promising therapeutic target for obesity and type 2 diabetes[J]. Obesity Reviews, 2017, 18(6): 647-659.
[3] Rabelo C, Basso F, Mcallister T, et al. Influence of Lactobacillus buchneri as silage additive and forage: Concentrate ratio on the growth performance, fatty acid profile in longissimus muscle, and meat quality of beef cattle[J]. Canadian Journal of Animal Science, 2016, 96(4): 550-562.
[4] Vieco-Saiz N, Belguesmia Y, Raspoet R, et al. Benefits and inputs from lactic acid bacteria and their bacteriocins as alternatives to antibiotic growth promoters during food-animal production[J/OL]. Frontiers in Microbiology, 2019, 10. [2019-06-01]. https://schlr.cnki.net/zn/Detail/index/ SJPD_03/SJPDFB6F2FBCCF942F154206515E9E113D70
[5] Chen Y, Wei L, Chiu Y, et al. Lactobacillus plantarum TWK10 supplementation improves exercise performance and increases muscle mass in mice[J/OL]. Nutrients, 2016, 8(4). [2016-04-07]. https://schlr.cnki.net/zn/Detail/index/SJPD_03/ SJPDB522176C3F9DBCE31A4DAA2384F76606
[6] Zhang Y, Yu B, Yu J, et al. Butyrate promotes slow-twitch myofiber formation and mitochondrial biogenesis in finishing pigs via inducing specific microRNAs and PGC-1 alpha expression[J]. Journal of Animal Science, 2019, 97(8): 3180-3192.
[7] Chen X, Xiang L, Jia G, et al. Leucine regulates slow-twitch muscle fibers expression and mitochondrial function by Sirt1/AMPK signaling in porcine skeletal muscle satellite cells[J]. Animal Science Journal, 2019, 90(2): 255-263.
[8] Hor Y, Ooi C, Khoo B, et al. Lactobacillus strain alleviated aging symptoms and aging-induced metabolic disorders in aged rats[J]. Journal of Medicinal Food, 2019, 22(1): 1-13.
[9] 张天阳,徐海鹏,曾勇庆,等. 饲喂不同剂量乳酸菌液对肥育猪肉质特性及抗氧化性的影响[J]. 养猪,2014(1):41-43.
[10] Brooke M H, Kaiser K K. Three “myosin adenosine triphosphatase” systems: The nature of their pH lability and sulfhydryl dependence[J]. Journal of Histochemistry & Cytochemistry, 1970, 18(9): 670-672.
[11] 梁雅妍. 植物源乳酸菌对生长肥育猪肌纤维组织特性及肉品质的影响[D]. 广州:华南农业大学,2008.
Liang Yayan. Research on Meat Quality and Myofibers Characteristics of Growing Pigs with the Treatment of Lactobacilli[D]. Guangzhou: South China Agricultural University, 2008. (in Chinese with English abstract)
[12] 张应汉,冯旭红,刘文花,等. 猪肌抑素前肽联合乳酸菌对小鼠肌肉发育和免疫性能影响[J]. 山西农业大学学报:自然科学版,2021,41(2):50-58.
Zhang Yinghan, Feng Xuhong, Liu Wenhua, et al. Effects of porcine MSTN propeptide combined with lactobacillus on muscle development and immune function in mice[J]. Journal of Shanxi Agricultural University Natural Science Edition, 2021, 41(2): 50-58. (in Chinese with English abstract)
[13] Tian Z, Cui Y, Lu H, et al. Effect of long-term dietary probiotic Lactobacillus reuteri 1 or antibiotics on meat quality, muscular amino acids and fatty acids in pigs[J/OL]. Meat Science, 2021, 171. [2020-10-19]. https://schlr.cnki.net/ zn/Detail/index/SJESLAST/SJES7126E8C5CEA92088E78E8C5F4A271D39.
[14] Meng Q, Yan L, Ao X, et al. Influence of probiotics in different energy and nutrient density diets on growth performance, nutrient digestibility, meat quality, and blood characteristics in growing-finishing pigs[J]. Journal of Animal Science, 2010, 88(10): 3320-3326.
[15] Nakazato K, Tsutaki A. Regulatory mechanisms of muscle fiber types and their possible interactions with external nutritional stimuli[J/OL]. Journal of Physical Fitness & Sports Medicine, 2012, 1(4). [2012-06-15]. https://schlr.cnki.net/zn/Detail/index/SJJSLAST/SJJSFFB3B8464C99A58F749BD863326700A4
[16] 李敏华. 微生态制剂对育肥猪生长性能及肉品质的影响[D]. 太谷:山西农业大学,2016.
Li Minhua. Effect of Probiotics on Growth Performance and Meat Quality of Finishing Pigs[D]. Taigu: Shanxi Agricultural University, 2016. (in Chinese with English abstract)
[17] Tokinoya K, Ishikura K, Yoshida Y, et al. LDH isoenzyme 5 is an index of early onset muscle soreness during prolonged running[J]. The Journal of sports medicine and physical fitness, 2020, 60(7): 1020-1026.
[18] Naseri N, Bonica J, Xu H, et al. Novel metabolic abnormalities in the tricarboxylic acid cycle in peripheral cells from Huntington's disease patients[J/OL]. Plos One, 2016, 11(9). [2016-09-04]. https://schlr.cnki.net/zn/Detail/ index/SJPD_03/SJPDFCF9F0B098F63C8301104EC020E0AB39
[19] Wang Z, Ren X, Gao B, et al. Comparison of carbohydrate metabolism key enzymes in different generations of growth-selected Portunus trituberculatus families[J]. Aquaculture, 2017, 477: 6-14.
[20] 侯旭,张一敏,毛衍伟,等. 宰后盆骨吊挂方式及成熟时间对黄牛牛肉品质的影响[J]. 农业工程学报,2014,30(8):251-256.
Hou Xu, Zhang Yimin, Mao Yanwei, et al. Effect of pelvic suspension and aging time on meat quality of Chinese yellow cattle[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2014, 30(8): 251-256. (in Chinese with English abstract)
[21] Rabelo C, Lara E, Basso F, et al. Growth performance of finishing feedlot lambs fed maize silage inoculated with bacillus subtilis and lactic acid bacteria[J]. Journal of Agricultural Science, 2018, 156(6): 839-847.
[22] Dowarah R, Verma A K, Agarwal N, et al. Efficacy of species-specific probiotic pediococcus acidilactici FT28 on blood biochemical profile, carcass traits and physicochemical properties of meat in fattening pigs[J]. Research in Veterinary Science, 2018, 117: 60-64.
[23] Choi Y M, Hwang S, Lee K. Comparison of muscle fiber and meat quality characteristics in different Japanese quail lines[J]. Asian Australasian Journal of Animal Sciences, 2016, 29(9): 1331-1337.
[24] Wicks J, Beline M, Gomez J, et al. Muscle energy metabolism, growth, and meat quality in beef cattle[J/OL]. Agriculture-Basel, 2019, 9(9). [2019-09-07]. https://schlr. cnki.net/zn/Detail/index/WWMERGEJ03/SJMDCAE4900CCB6B0EA935594DEBF6313657
[25] 梁荣蓉,许宝琛,张一敏,等. 蛋白质组学在生鲜肉肉色变化机制研究中的应用[J]. 农业工程学报,2020,36(16):283-292.
Liang Rongrong, Xu Baochen, Zhang Yimin, et al. Application of proteomics in mechanism research of fresh meat color changes[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(16): 283-292. (in Chinese with English abstract)
[26] 王乐,郭月英,靳烨,等. 叉头转录因子1(FoxO1)与肌球蛋白重链基因(MyHC)的相关性及其对肉品质的影响[J]. 食品与发酵工业,2016,42(4):233-237.
Wang Le, Guo Yueying, Jin Ye, et al. Correlation study of FoxO1 and MyHC and their affection to meat quality[J]. Food and Fermentation Industry, 2016, 42(4): 233-237. (in Chinese with English abstract)
[27] Ryu Y, Kim B. Comparison of histochemical characteristics in various pork groups categorized by postmortem metabolic rate and pork quality[J]. Journal of Animal Science, 2006, 84(4): 894-901.
[28] Canto C, Gerhart-Hines Z, Feige J, et al. AMPK regulates energy expenditure by modulating NAD+metabolism and SIRT1 activity[J]. Nature, 2009, 458(7241): 1056-1060.
[29] Herzig S, Shaw R. AMPK: guardian of metabolism and mitochondrial homeostasis[J]. Nature Reviews Molecular Cell Biology, 2018, 19(2): 121-135.
[30] Rahmel T, Marko B, Nowak H, et al. Mitochondrial dysfunction in sepsis is associated with diminished intramitochondrial TFAM despite its increased cellular expression[J/OL]. Scientific Reports, 2020, 10(1). [2020-12-03]. https://schlr.cnki.net/ zn/Detail/index/SJPDLAST/SJPD806056C2639559E2052736C394E10471
[31] Chalkiadaki A, Igarashi M, Nasamu A, et al. Muscle-specific SIRT1 gain-of-function increases slow-twitch fibers and ameliorates pathophysiology in a mouse model of duchenne muscular dystrophy[J/OL]. PLoS Genetics, 2014, 10(7): e1004490. [2014-07-29]. https://schlr.cnki.net/zn/Detail/index/ SJPD_02/SJPD65E783328997D6DE621835979253F31D
[32] Harada G, Pattarawat P, Ito K, et al. Lactobacillus brevis T2102 suppresses the growth of colorectal cancer cells by activating SIRT1[J]. Journal of Functional Foods, 2016, 23: 444-452.
[33] Jang H, Han S, Kim J, et al. Lactobacillus sakei alleviates high-fat-diet-induced obesity and anxiety in mice by inducing AMPK activation and SIRT1 expression and inhibiting gut microbiota-mediated NF-kappa B activation[J/OL]. Molecular Nutrition & Food Research, 2019, 63(6). [2019-03-30]. https://schlr.cnki.net/zn/Detail/index/ SJPDLAST/SJPD4BD01119F6E9032F0AE0049E834CD129
[34] Toda K, Yamauchi Y, Tanaka A, et al. Heat-killed bifidobacterium breve B-3 enhances muscle functions: possible involvement of increases in muscle mass and mitochondrial biogenesis[J]. Nutrients, 2020, 12(1): 219.
[35] Przewłócka K, Folwarski M, Kaźmierczak-Siedlecka K, et al. Gut-muscle axis exists and may affect skeletal muscle adaptation to training[J/OL]. Nutrients, 2020, 12(5). [2020-05-18]. https://schlr.cnki.net/zn/Detail/index/ WWMERGEJ03/SJMD1752425898A572DB0CBF936C408BE65B
[36] Yan H, Diao H, Xiao Y, et al. Gut microbiota can transfer fiber characteristics and lipid metabolic profiles of skeletal muscle from pigs to germ-free mice[J/OL]. Scientific Reports, 2016, 6(1). [2016-08-22]. https://schlr.cnki.net/zn/Detail/ index/SSJD_01/SSJD15CB0373CD1ACB2F324DD510A98284E3
Effects of lactobacillus induced mitochondrial biogenesis on muscle fiber properties and meat quality of sheep
Bai Yanping1, Hou Yanru1, Su Lin1, Sun Bing1, Dou Lu1, Zhao Lihua1, Liu Ruijun2, Aoteheng Gerile3, Jin Ye1※
(1.,,010018,; 2..,.,015000,; 3.,,015000,)
The present study aimed to investigate the influence of dietary supplementation with lactobacilluson muscle fiber properties and meat quality in Sunit sheep. Totally 12 Sunit sheep aged 3 months with good body condition were selected, and then two groups were randomly divided. The control group was fed a basal diet (a typical corn-soybean diet) without any antibiotics, drugs, or growth promoters. Lactobacillus group was supplemented with lactobacillus plantarum at 3×1010cfu/g based on the diet of the control group, where the feeding period lasted for 90 days. After slaughter, the longissimus dorsi muscle was taken for subsequent test. An ATPase histochemical staining and a real-time fluorescence quantitative technique were utilized to determine the muscle fiber properties, the mRNA expression of myosin heavy chains () and genes related to mitochondrial biogenesis. In addition, the activity of metabolic enzymes, growth performance, and meat quality were measured to explore the relationship between muscle fiber properties and meat quality. The results showed that the dietary supplementation with lactobacillus significantly increased the value of pH24(<0.01), while reduced the value of* (<0.05) and cooking loss (<0.01) of meat. There was no significant effect on the growth performance and other meat quality indicators (>0.05). The analysis of muscle fiber showed that the dietary supplementation with the lactobacillus increased the number ratio of type IIA muscle fibers (<0.01), but decreased the number ratio of type IIB muscle fibers (<0.01), where there was no significant effect on the diameter and cross-sectional area of muscle fibers. At the same time,(<0.05),(<0.01), and(<0.01) mRNA expression were significantly higher than those of the control group. The enzyme activity of Succinate Dehydrogenase (SDH) in the lactobacillus group was significantly higher than that in the control group(<0.05), whereas, the enzyme activity of Lactic Dehydrogenase (LDH) became significantly lower(<0.05). In addition, the dietary supplementation with the lactobacillus increased the mRNA expression of AMP-activated protein kinase α1(1) (<0.01), Sirtuin1 (1) (<0.01), and Cytochrome c oxidaseⅣ () (<0.05) in the longissimus dorsi muscle of Sunit sheep. There was no significant difference (>0.05) in the mRNA expression levels of AMP-activated protein kinase2 (2), Peroxisome proliferator-activated receptor gamma co-activator 1-alpha (1), and Mitochondrial transcription factor A () in the control group, particularly similar to that of lactobacillus group. Consequently, the lactobacillusincreased the oxidative metabolism of muscle, thereby promoting the transformation of muscle fiber types to more oxidation type of longissimus dorsi muscle in Sunit sheep, indicating much better meat quality than before. In any way, the dietary supplementation with lactobacillus significantly promoted the generation of more oxidative muscle types, which can be associated with the AMPK1- SIRT1- PGC-1axis and mitochondrial biogenesis.
meat; quality control; lactobacillus; mitochondrial biogenesis; muscle fiber properties; Sunit sheep
10.11975/j.issn.1002-6819.2021.10.032
TS251.1
A
1002-6819(2021)-10-0269-08
白艳苹,侯艳茹,苏琳,等. 乳酸菌诱导线粒体生物发生对绵羊肌纤维特性和肉品质的影响[J]. 农业工程学报,2021,37(10):269-276.doi:10.11975/j.issn.1002-6819.2021.10.032 http://www.tcsae.org
Bai Yanping, Hou Yanru, Su Lin, et al. Effects of lactobacillus induced mitochondrial biogenesis on muscle fiber properties and meat quality of sheep[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2021, 37(10): 269-276. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2021.10.032 http://www.tcsae.org
2020-12-10
2021-04-07
国家自然科学基金资助项目(31660439);内蒙古自治区科技成果转化专项项目(2019CG066);内蒙古自治区自然科学基金重大专项项目(2020ZD11);内蒙古自治区自然科学面上项目(2018MS03050);地区科学基金项目(32060519)
白艳苹,研究方向为肉品科学与技术。Email:BYP1757017234@163.com
靳烨,博士,教授,研究方向为畜产品加工。Email:jinyeyc@sohu.com

