虎地肠溶胶囊对葡聚糖硫酸钠诱导的溃疡性结肠炎小鼠黏液屏障损伤修复的作用研究*
丁庞华 史利卿 石 磊 郭 一 路琼琼寇富舜 赵兴杰 毛堂友 孙中美 李军祥△
(1.北京中医药大学,北京 100029;2.北京中医药大学东方医院,北京 100078;3.北京中医药大学东直门医院,北京 100700)
溃疡性结肠炎(UC)是发生在结直肠、原因不明的非特异性炎症性疾病[1]。本病好发于中青年,临床主要表现为腹泻、黏液脓血便及腹痛等症状,严重影响患者生活质量。近10年来我国UC患病率(11.6/10万人)逐年上升,发病人数增加了7倍[2-3],成为当前消化领域的研究热点。当前UC的临床治疗药物主要包括5-氨基水杨酸制剂、糖皮质激素、免疫抑制剂和生物制剂。但以上药物可能出现临床疗效不稳定、停药后易复发或不同程度的毒副作用。随着对UC研究的不断深入,人们逐渐认识到黏液屏障作为肠道黏膜屏障的第一道防线,在UC的发生发展中发挥重要作用[4-5]。肠黏液屏障结构减弱是UC发病的早期关键环节[6]。UC的炎症表现与促炎和抗炎细胞因子之间的失衡有关,其中白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)等促炎因子的上调在此过程中起着重要作用[7]。在UC的发生发展过程中,IL-6的信号转导导致T细胞过多堆积,加重肠黏膜的慢性炎症,出现UC的临床炎症表现[8]。TNF-α在UC的发生发展过程中起到“枢纽样”作用,已有研究证实TNF-α参与UC发展的许多环节[9]。
虎地肠溶胶囊作为活动期UC治疗的代表方药,在2017年《溃疡性结肠炎中医诊疗专家共识意见》中被推荐使用[10]。在前期评价虎地肠溶胶囊以及联合美沙拉嗪肠溶片治疗活动期UC临床疗效的多中心、随机对照、双盲双模拟的试验研究中发现,其治疗UC疗效显著[11]。因此,本研究采用葡聚糖硫酸钠(DSS)诱导小鼠UC模型,观察虎地肠溶胶囊对UC小鼠肠黏液屏障及相关炎症因子表达水平的影响,探讨虎地肠溶胶囊治疗UC的作用机制,从而为其临床治疗UC提供实验室证据。
1 材料与方法
1.1 实验动物 SPF级C57BL/6雌性小鼠20只,体质量18~20 g,鼠龄7~8周,购自北京维通利华实验动物技术有限公司,动物合格证号:SYXK(京)2019-0013。于北京中医药大学动物实验中心动物房饲养,温度23~27℃,相对湿度40%~60%,室内通风良好,每日光照10~12 h,适应性喂养1周。动物实验方法符合北京中医药大学动物实验伦理规程,伦理编号:BUCM-4-2020082704-3138。
1.2 实验药物 虎地肠溶胶囊由朱砂七、虎杖、白花蛇舌草、北败酱、二色补血草、地榆、白及、甘草组成(安徽九方制药,国药准字Z20020035,批号:14000367653),结合其临床规定使用剂量,进行人-鼠等剂量换算,使用剂量为0.73 g/kg。美沙拉嗪肠溶片(德国福克制药有限公司,规格0.5 g/粒,批号:H20171358),使用剂量为0.46 g/kg。
1.3 试剂与仪器 DSS(美国MP Biomedicals,43 kDa,批号:160110),用100 mL灭菌蒸馏水溶解2.5 g DSS配制2.5%的DSS溶液用于实验;无水乙醇,北京华腾化工有限公司;二甲苯,国药集团化学试剂有限公司;苏木素、伊红,北京鼎国昌盛生物技术有限责任公司;中性树胶,中国上海标本模型厂;阿利新蓝染液套装(AB-PAS),Servicesbio;IL-6、TNF-α酶联免疫吸附测定(ELISA)试剂盒(上海酶联,货号分别为ml06315-J、ml002095-J)。电热恒温培养箱,黄石市恒丰医疗器械有限公司,型号SKP-02.600;病理石蜡包埋机,沈阳市龙首电子仪器有限公司,型号LS-100;石蜡切片机,北京弘泰嘉业科技发展有限公司,型号Finesse 325;显微镜,奥林巴斯株式会社,型号BX60。
1.4 造模与给药 20只小鼠随机分成空白组、模型组、虎地肠溶胶囊组、美沙拉嗪组,每组5只。适应性喂养1周后,予如下处理:空白组普通饲养,每日予灭菌蒸馏水0.2 mL灌胃;模型组予2.5% DSS溶液自由饮用7 d,每日予灭菌蒸馏水0.2 mL灌胃。虎地肠溶胶囊组饮水同DSS组,每日予虎地肠溶胶囊溶液0.73 g/kg灌胃;美沙拉嗪组饮水同DSS组,每日予美沙拉嗪溶液0.46 g/kg灌胃。所有小鼠除饮水和灌胃之外,其他饲养条件一致。
1.5 一般情况与疾病活动指数(DAI)评分 每天观察并记录各组小鼠精神状态、活动情况、皮毛色泽、大便性状、体质量变化、大便潜血情况等。计算每组小鼠DAI评分值,DAI=(体质量评分+大便性状评分+出血情况评分)/3。具体评分准则如下:体质量下降<1%计0分,下降1%~5%计2分,下降10%~15%计3分,下降>15%计4分;大便呈干性颗粒状计0分,松散便计2分,稀便计4分;大便隐血阴性计0分,隐血阳性计2分,肉眼血便计4分。
1.6 标本采集与检测 1)结肠组织形态学观察。末次药物干预结束后,使用二氧化碳麻醉小鼠,眼球取血后断颈处死,分离小鼠结肠,测量从肛门至回盲部的结肠长度,然后取结肠远端约1 cm长度,用4%多聚甲醛溶液固定后,梯度乙醇脱水,石蜡包埋,切片,HE染色,光镜下观察切片组织学变化。2)血清中IL-6和TNF-α含量。采用酶联免疫吸附检测仪按照标准检测流程检测小鼠血清中IL-6和TNF-α的含量。3)结肠黏膜中杯状细胞观察。截取1 cm左右的病变组织,置于4%多聚甲醛溶液中进行固定,用石蜡包埋,切片,用于AB-PAS染色,光镜下观察结肠黏膜中杯状细胞数量、形态。
1.7 统计学处理 应用SPSS24.0统计软件。计量资料以(±s)表示,满足正态分布且方差齐时采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组小鼠一般情况比较 空白组小鼠第1~7天体质量稳中有增,排便正常。模型组小鼠给予DSS溶液自由饮用后的第2~3天开始出现大便不成形、大便潜血(+)或肉眼血便等情况,伴体质量进行性下降。虎地肠溶胶囊组、美沙拉嗪组的小鼠,在给予DSS溶液的第2~3天出现大便不成形、大便潜血(+)或肉眼血便等情况,随着时间的增加,小鼠体质量减轻情况较模型组变缓。
2.2 各组小鼠干预后DAI评分比较 见表1。造模4 d后模型组小鼠体质量开始出现下降,且全部呈现便血症状,大便性状改变,DAI升高。造模7 d后模型组小鼠体质量下降明显且全部呈现便血、大便性状改变症状。造模后与空白组相比,模型组小鼠DAI显著升高(P<0.01),虎地肠溶胶囊组、美沙拉嗪组治疗后能够显著降低UC小鼠DAI(P<0.01)。虎地肠溶胶囊组与美沙拉嗪组之间小鼠DAI无统计学差异(P>0.05)。
表1 各组小鼠DAI评分及结肠长度比较(±s)

表1 各组小鼠DAI评分及结肠长度比较(±s)
注:与空白组比较,*P<0.01;与模型组比较,#P<0.01。
组别空白组模型组虎地肠溶胶囊组美沙拉嗪组结肠长度(cm)9.06±0.56 6.98±0.29*7.50±0.39#7.52±0.21#n 5 5 5 5 DAI评分(分)0.00±0.00 2.83±0.43*2.13±0.45#2.25±0.32#
2.3 各组小鼠结肠长度比较 见表1。与空白组相比,模型组小鼠结肠长度显著缩短(P<0.01);与模型组相比,虎地肠溶胶囊组、美沙拉嗪组治疗后能够改善小鼠结肠长度(P<0.05)。虎地肠溶胶囊组与美沙拉嗪组之间小鼠结肠长度无统计学差异(P>0.05)。
2.4 各组小鼠组织病理学变化比较 由图1可见,空白组结肠组织结构正常,肠黏膜未见病变。模型组可见黏膜下隐窝腺体全部消失,炎症细胞浸润黏膜至上皮,肠黏膜结构明显破坏。虎地肠溶胶囊组结肠组织结构与空白组最为接近。美沙拉嗪组结肠组织结构基本正常,炎症细胞数量减少。
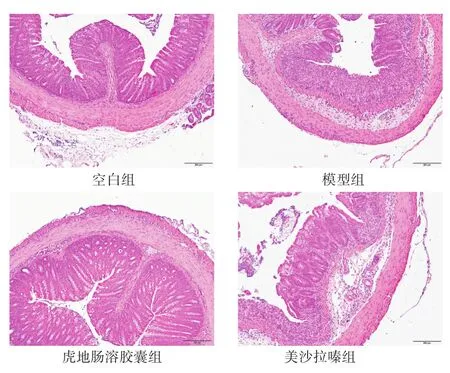
图1 各组UC小鼠结肠组织形态学观察(HE染色,100倍)
2.5 各组小鼠血清中IL-6、TNF-α水平比较 见表2。与空白组比较,模型组IL-6、TNF-α明显升高(P<0.05)。与模型组比较,治疗后虎地肠溶胶囊组、美沙拉嗪组IL-6、TNF-α明显降低,接近于空白组(P<0.05)。虎地肠溶胶囊组与美沙拉嗪组中TNF-α的减低有统计学意义(P<0.05),且虎地肠溶胶囊优于美沙拉嗪组(P<0.05);而IL-6的减低,两组之间无统计学差异(P>0.05)。
表2 各组小鼠血清IL-6、TNF-α水平比较(pg/mL,±s)

表2 各组小鼠血清IL-6、TNF-α水平比较(pg/mL,±s)
注:与空白组比较,*P<0.01;与模型组比较,#P<0.01;与美沙拉嗪组比较,△P<0.05。
TNF-α 63.68±4.19 69.97±4.90*46.16±1.50#△59.92±6.52#组别空白组模型组虎地肠溶胶囊组美沙拉嗪组n 5 555 IL-6 9.62±2.04 16.17±2.15*12.43±2.23#12.78±1.62#
2.6 各组小鼠结肠黏膜中杯状细胞变化比较 见图2。空白组小鼠结肠黏膜的杯状细胞密集分布于隐窝两侧,形态规则饱满。而模型组小鼠结肠黏膜破损,杯状细胞数量减少,大小不均,较之正常组,具有显著差异。虎地肠溶胶囊组的杯状细胞沿着腺体分布,比较密集,数量增多,较之模型组有明显变化。美沙拉嗪组小鼠杯状细胞数量减少,大小不均,较之模型组无明显变化。
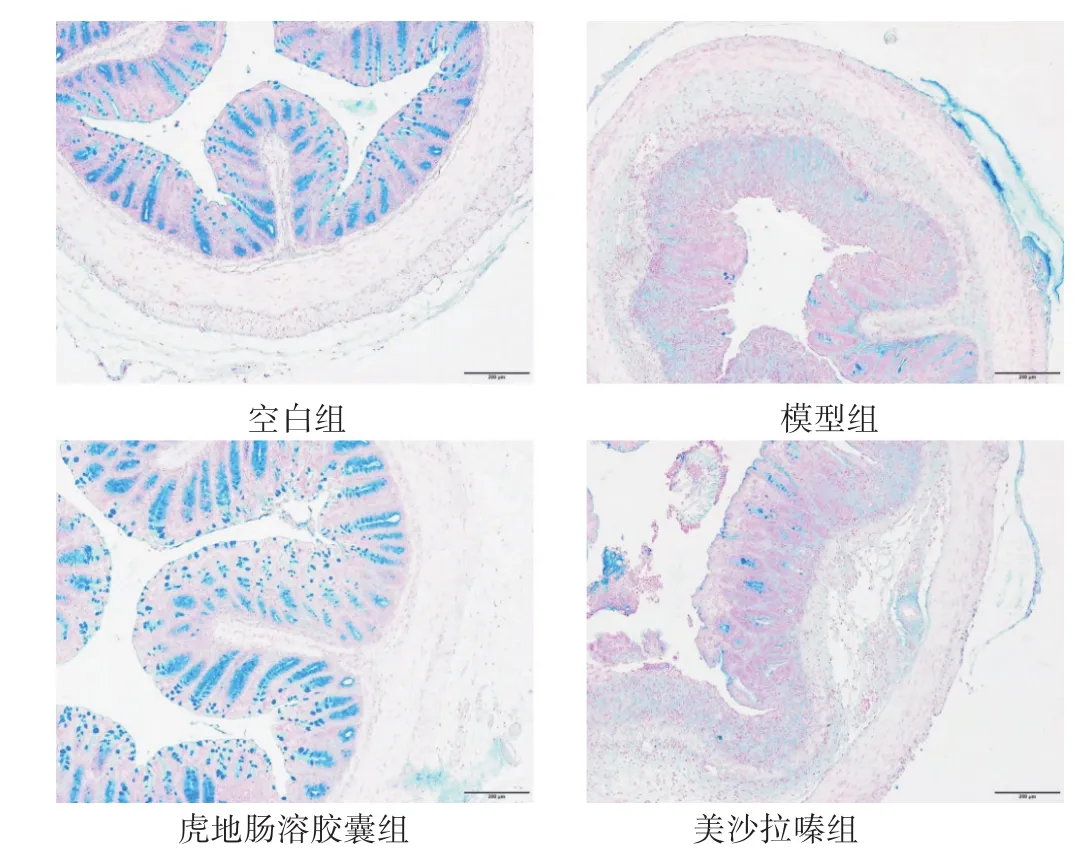
图2 各组UC小鼠结肠黏膜的杯状细胞观察(AB-PAS染色,100倍)
3 讨论
根据UC临床表现,可归属于中医学“久痢”等范畴,其病机多属湿热瘀阻、脾气虚弱。多因外感内伤致脾胃运化失司,水湿内停,郁而化热,湿热下注大肠,与肠道气血相搏结,气血凝滞,化为脓血;故患者出现腹泻,下利黏液脓血便。肠道传导失司,气机阻滞,腑气不通,故见腹痛,里急后重;脾气不足,不能运化水谷精微,表现为神疲乏力、肢体困倦、食少纳差。治疗多以清热化湿、凉血化瘀、健脾益气为主。
虎地肠溶胶囊由朱砂七、虎杖、白花蛇舌草、北败酱、二色补血草、地榆炭、白及和甘草组成。方中朱砂七、虎杖、白花蛇舌草、北败酱合用可清热利湿解毒,且可止痛;地榆、白及合用既可凉血收敛止血,也可解毒消肿生肌。二色补血草具有益气血、散瘀止血之功效,常用于病后体弱、胃脘痛、消化不良、崩漏、带下、尿血、痔血。甘草性味甘平,可缓急止痛、解毒消痈、调和诸药,防止苦寒伤胃,且可补脾胃不足以扶正,二药合用达到健脾益气之功效。虎地肠溶胶囊在临床中治疗轻中度活动期UC疗效显著[11]。美沙拉嗪通过抑制结肠黏膜释放前列腺素、白三烯等损伤性因子,从而减轻炎症因子对肠黏膜的损伤;故选用为本次研究的阳性对照药。本研究结果显示,虎地肠溶胶囊在改善UC模型小鼠DAI、结肠长度等方面疗效与美沙拉嗪相近。
UC发病机制尚未完全明确,但肠黏膜屏障的结构和功能的失衡与其发病密切相关。肠黏膜屏障的完整性依赖于正常的免疫反应、肠黏膜上皮细胞(IECs)的完整性和黏液的产生[12-14]。黏液的正常分泌形成了肠道的黏液屏障,黏液屏障在UC的发生发展过程中发挥重要作用。有文献指出,肠黏液屏障损伤(包括黏液层厚度和通透性异常改变)可导致肠道通透性增加,进而导致肠道致病细菌更易侵犯肠黏膜引起肠道疾病。UC活动期,杯状细胞会明显减少甚至消失,导致黏蛋白分泌减少,黏液层变薄甚至缺失,暴露出来的上皮细胞易受细菌侵袭[15]。有研究者发现DSS诱导的UC模型中,在炎症发生之前,粪便中的细菌会侵入结肠黏液层,由此证明DSS能够直接破坏黏液层,也说明了完整的黏液层对肠道的保护作用[16]。
当肠黏膜屏障第一道防线肠黏液屏障被破坏时,IECs暴露在多种抗原刺激下,产生强烈的免疫反应,炎症介质不断积累,对IECs和自身抗体的毒性作用会刺激自身免疫反应,导致肠损伤的发展并形成恶性循环,这也是UC反复发作的原因之一[17]。IL-6、TNF-α等促炎细胞因子来源于多种免疫和非免疫细胞以及IECs自身产生。IL-6、TNF-α等细胞因子的升高,会促进IECs的凋亡,从而导致屏障功能障碍[18]。UC患者血清中检测到促炎因子IL-6、TNF-α水平的升高,抗IL-6R抗体和TNF-α阻断剂已成为临床中治疗UC的重要替代品[19-20]。
本次研究中,DSS致小鼠出现体质量降低,精神萎靡、腹泻血便等现象,符合UC的表现,属于虎地肠溶胶囊的治疗范围。与模型组相比较,各给药组小鼠体质量逐渐恢复,状态逐渐好转,结肠长度偏长,结肠病理情况有不同程度的改善。各给药组小鼠结肠组织较模型组IL-6、TNF-α的合成和释放减少。模型组小鼠结肠组织中杯状细胞的数量明显减少,虎地肠溶胶囊组能够明显增加杯状细胞的数量,而美沙拉嗪组对杯状细胞数量改善不明显,这可能是虎地肠溶胶囊发挥治疗作用的关键所在。
综上所述,虎地肠溶胶囊能够有效促进UC小鼠的恢复,回复肠道形态,改善其肠道病理损伤。其治疗效果可能是通过促进杯状细胞的生长,修复肠黏液屏障,进而恢复肠黏液及黏液屏障功能,并为其他屏障功能的正常发挥提供基础;同时可能通过下调血清中炎症细胞因子IL-6、TNF-α的水平,减轻因黏液屏障功能损伤或消失引起的炎症因子对肠黏膜直接的炎症刺激,缓解肠道炎症反应,恢复肠黏膜功能。此次研究为临床应用虎地肠溶胶囊治疗活动期UC提供了更多的分子生物学理论依据。

