虎杖对甲型流感病毒FM1感染小鼠肺损伤的干预作用*
刘国星 王成祥 徐红日△ 曹鸿云△ 李 猛刘 畅 于会勇 程 淼 李雅莉 刘 通
(1.北京中医药大学第三附属医院,北京 100029;2.陕西省中医院,陕西 西安 710003;3.北京中医药大学东直门医院,北京 100700)
流行性感冒传染性强、传播速度快,据世界卫生组织统计,全球每年约有29~65万人死于流感[1]。流感病毒主要分为甲、乙、丙3型,其中甲型流感病毒常发生变异,对金刚烷胺、奥司他韦等产生耐药性,限制了抗病毒药物的临床使用。流感属于中医学“外感热病”范畴,数千年来,中医药对外感热病的治疗具有显著的临床效果。
虎杖性微寒,味微苦,具有利湿退黄、清热解毒、散瘀止痛、止咳化痰的功效,并能泻热通腑[2]。课题组前期研究证实,临床效方清肺饮对病毒性肺炎患者发热、咳嗽、咯痰等症状的改善和肺部炎症吸收具有显著的作用[3],其治法以清热解毒、宣肺止咳为核心,虎杖是其中主要药物之一。该药被广泛应用于新型冠状病毒肺炎防治的宣肺败毒方在缩短患者临床症状消失时间、体温复常时间、平均住院天数等方面,具有确切作用,并在阻断轻型、普通型转重型方面具有独特优势[4]。其治法以辛凉解表、清热宣肺为核心,其中以虎杖行解毒利湿、化痰通腑之用。因此,本研究以虎杖作为清热利湿、化痰通腑法的代表药,观察其对小鼠感染流感病毒FM1株后不同时相肺部炎症损伤的干预作用,将为清热利湿、化痰通腑法增添新的内涵。
1 材料与方法
1.1 实验动物
BALB/cAnN 小鼠,SPF级,雄性,16~18 g,共 72只,购自北京维通利华实验技术有限公司,合格证号:SCXK(京)2016-0006。适应性饲养5 d。动物实验通过了中国疾病预防控制中心实验动物福利和伦理委员会审查,中国疾病预防控制中心实验动物中心合格证号:SYXK(京)2017-0021。
1.2 药物与试剂
药物:虎杖颗粒剂(批号:20000761),购自北京康仁堂药业有限公司。试剂:4%多聚甲醛固定液,PBS缓冲液。HE染色试剂盒(索莱宝公司);TRIzol Reagent[赛默飞世尔科技(中国)有限公司,批号:94204],PrimeScriptTM RT reagent Kit(Perfect Real Time)[宝日医生物技术(北京)有限公司,批号:AJ91586A],TB GreenTM Premix Ex TaqTM Ⅱ(Tli RNaseH Plus)[宝日医生物技术(北京)有限公司,批号:AJG1873A],PCR引物由上海生工生物工程有限公司合成。无水乙醇、氯仿(分析纯,北京化工厂)。流感病毒FM1,由中国疾病预防控制中心病毒病预防控制所提供。血凝滴度为1∶512,对小鼠LD50为10-4.8,-80 ℃超低温冰箱冻存。
1.3 主要仪器
显微镜(OLYMPUS-BX51,日本),扫描电子显微镜(日立,S-3400N)。图像采集系统(OLYMPUS,DP controller 3.1.1.267),Biorad CFX96 qPCR 仪(Bio-rad公司),NanoDrop微量分光光度计(Thermo Scientific公司),超纯水仪(Millipore公司),高速冷冻离心机(Eppendorf公司)。生物安全柜(Ⅱ级B2型)(美国NUAIRE公司,型号:NU-425-600E),电子天平(瑞士METTLER公司,型号:PB153-S/FACT),高通量组织研磨仪(德国Qiagen公司,型号:TissuelyserⅡ),实时荧光定量PCR仪(新加坡Applied Biosystems B.V公司,型号:7500 FAST)。
1.4 实验方法
1)感染。将小鼠随机分为空白组、模型组、虎杖组,每组24只。用3%水合氯醛腹腔注射麻醉小鼠后,空白组以PBS滴鼻,每只25 μL。其余各组以25 μL FM1株病毒悬液滴鼻,感染浓度为10-4。各组滴鼻后按照第1、3、5天不同观察点随机分为3个小组,每小组8只。2)给药。根据文献[5],按直接折算法计算小鼠与人的临床等效剂量。虎杖给药剂量为3 g/(kg·d),感染2 h后首次给药,每日灌胃1次,每次给药0.2 mL,空白对照组及模型组予等体积0.9%氯化钠注射液灌胃,每日1次,每次0.2 mL。
1.5 标本采集与检测
1)小鼠肺指数检测。小鼠感染后第1、3、5天取材,计算肺指数,记录肺脏大体病变情况,摘取左肺,在0.9%氯化钠溶液中漂洗干净,浸泡于4%多聚甲醛溶液中。取各组小鼠右肺放入2 mL冻存管中,置液氮中冻存。肺指数=肺质量(g)/体质量(g)×100%。2)小鼠肺组织病理观察。将固定好的肺组织常规脱水、包埋、切片、染色,在光学显微镜下观察各组小鼠肺组织病变情况,采用OLYMPUS图像拍摄系统(OLYMPUSBX51,日本)及OLYMPUS DP controller 3.1.1.267图像采集系统采集图片。3)小鼠气管超微结构观察。实验第5日,剪取小鼠气管5 m,保存于4%戊二醛中,用不锈钢双刃刀片切成2 mm厚、1 mm×1 mm大小的组织块,常规脱水、干燥、喷金,将制作好的标本置于扫描电镜下观察。4)RT-PCR检测小鼠肺脏中肿瘤坏死因子-α(TNF-α)mRNA、白细胞介素-1(IL-1)mRNA、白细胞介素-10(IL-10)mRNA、γ干扰素(IFN-γ)mRNA水平。以GADPH作为内控基因,小鼠引物序列见表1。取2 μL RNA进行逆转录,合成cDNA,将cDNA作为模板进行q-PCR检测,反应条件为初始热激活95 ℃ 2 min,变性 95 ℃ 5 s,退火60 ℃ 30 s,40个循环,72℃延伸8 min。

表1 RT-PCR引物序列
1.6 统计学处理
2 结 果
2.1 各组小鼠的一般情况比较
空白组小鼠麻醉恢复后反应敏捷,毛色有光泽。模型组小鼠感染后第2天开始活动减少、进食减少,扎堆聚集,毛色黯淡,逐渐全部表现出精神不振、蜷缩、消瘦。虎杖组小鼠第3天开始活动减少、进食减少,毛色黯淡,有聚堆倾向,逐渐有个别小鼠出现蜷缩、精神不振。
2.2 各组小鼠肺指数比较
见表2。流感病毒感染后第3日,模型组小鼠的肺指数高于正常组,差异有统计学意义(P<0.05),第5天模型组较空白组肺指数进一步升高,差异有统计学意义(P<0.01)。第3天虎杖组小鼠肺指数较模型组有降低趋势,第5天虎杖组较模型组显著降低,差异有统计学意义(P<0.05)。
表2 各组小鼠滴鼻感染后各时间点肺指数比较(%,±s)
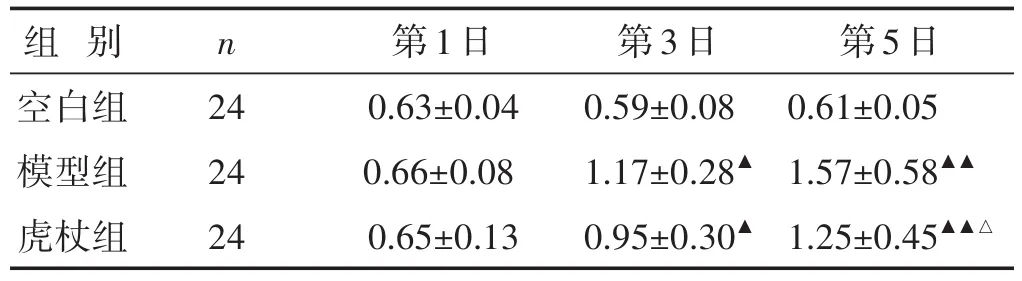
表2 各组小鼠滴鼻感染后各时间点肺指数比较(%,±s)
注:与空白组比较,▲P<0.05,▲▲P<0.01;与模型组比较,△P<0.05,△△P<0.01。下同。
组别空白组模型组虎杖组n 24 24 24第1日0.63±0.04 0.66±0.08 0.65±0.13第3日0.59±0.08 1.17±0.28▲0.95±0.30▲第5日0.61±0.05 1.57±0.58▲▲1.25±0.45▲▲△
2.3 各组小鼠肺组织大体病变比较
空白组肺组织呈现均匀淡粉色,无充血、水肿及实变。模型组感染后第1天肺组织散在斑片充血,肺门附近及肺上叶明显,无明显实变区。感染后第3天,肺门、肺叶交界附近见暗褐色实变区;感染后第5天,肺门及两个肺叶以上出现大片暗褐色实变区。虎杖组小鼠感染后第1天肺组织偶见斑点状充血,感染后第3天肺组织出现暗褐色实变,肺门附近为主,感染后第5天肺组织散见实变区,较模型组实变面积小。
2.4 各组光镜观察小鼠肺组织微观病变比较
空白组,肺泡结构完整,肺泡隔正常,细支气管上皮完整,管腔内未见渗出。模型组感染后第1天细支气管上皮小部分脱落,管腔内见渗出,肺泡隔增厚,有少许中性粒细胞及单核细胞浸润,肺泡隔内充血。感染后第3天细支气管上皮脱落,肺泡间隔增厚,中性粒细胞及单核细胞浸润,肺泡隔内有红细胞。感染后第5天,支气管上皮脱落,周围血管内充血,多见肺泡融合、间隔增厚,中性粒细胞及单核细胞大量浸润。虎杖组,感染后第1天,部分肺泡融合,肺泡隔增厚,细支气管上皮部分脱落,管腔内少许渗出,管壁有少许单核细胞浸润。感染后第3天,肺泡融合加重,肺泡隔增厚;细支气管上皮完整,管腔内少许渗出,血管内充血。感染后第5天,部分肺泡融合、间隔增厚,部分细支气管管腔狭窄,管腔内炎性渗出较模型组减轻。见图2。
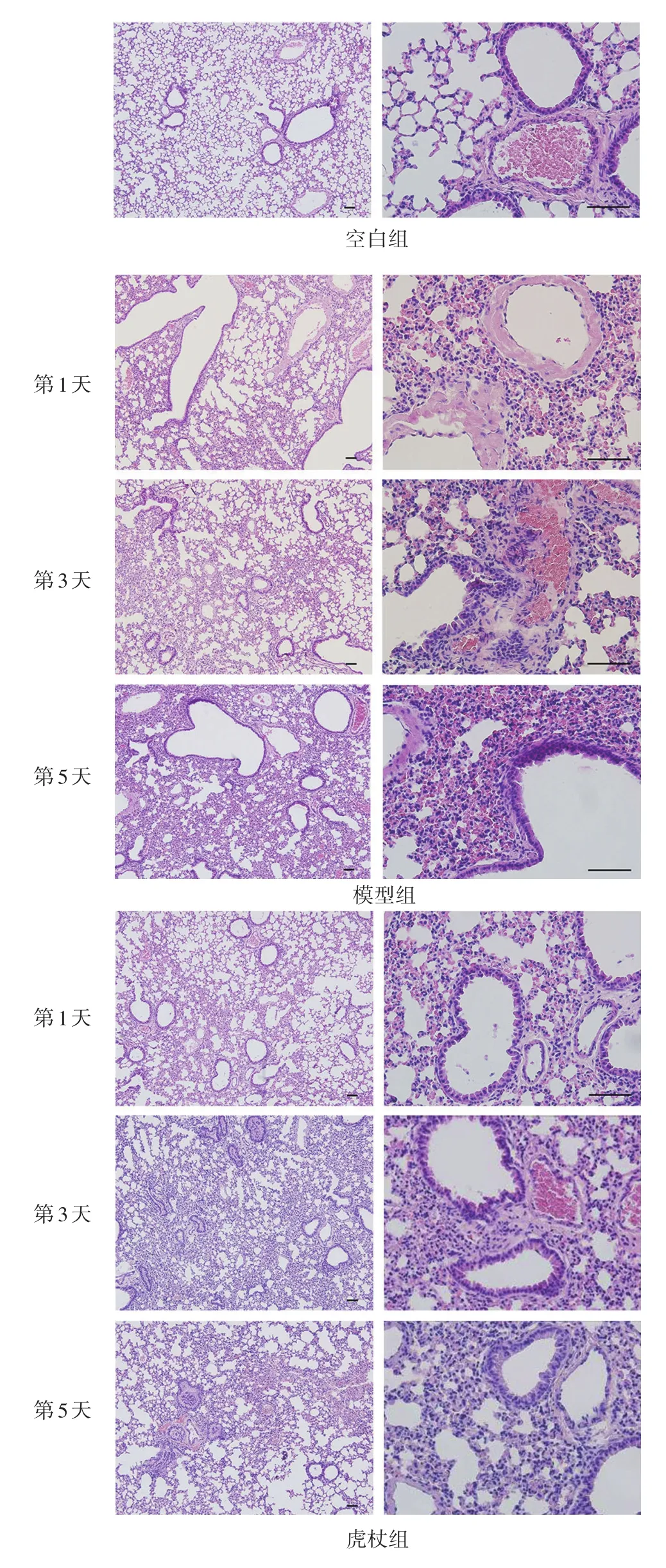
图2 各组小鼠肺组织微观病变(HE染色,100倍和400倍)
2.5 各组小鼠气管超微结构比较
空白组气管内壁黏膜完整,细胞饱满,纤毛密集,纤毛长而粗细均匀,排列整齐,纤毛间分布有微绒毛。模型组气管内壁黏膜不完整,细胞表面扁平,纤毛明显脱落、变短、倒伏,微绒毛大部分脱落。虎杖组纤毛脱落,稀疏,变短,排列紊乱,纤毛间微绒毛片状脱落。见图3。
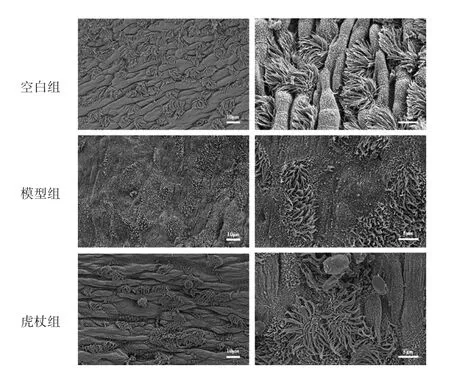
图3 各组小鼠气管超微结构(1000倍和3000倍)
2.6 各组小鼠肺组织中TNF-α mRNA、IL-1 mRNA、IL-10 mRNA、IFN-γ mRNA的表达量比较
2.6.1 各组小鼠肺组织中TNF-α mRNA表达量的比较 见表3。与空白组比较,模型组和虎杖组肺组织中TNF-α mRNA的表达在感染后第1~5天显著增加(第1天P<0.05,第3天P<0.01,模型组第5天P<0.01);与模型组比较,虎杖组肺组织中TNF-α mRNA的表达在感染后第3、5天有降低趋势,但差异无统计学意义(P>0.05)。
表3 各组小鼠肺组织中TNF-α mRNA表达量的比较(pg/mL,±s)
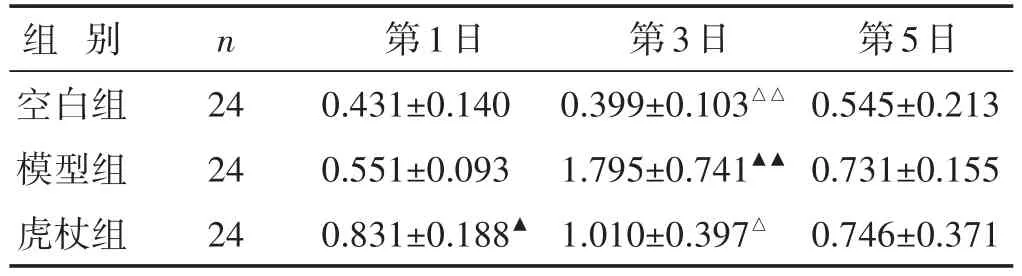
表3 各组小鼠肺组织中TNF-α mRNA表达量的比较(pg/mL,±s)
组别空白组模型组虎杖组n 24 24 24第1日0.431±0.140 0.551±0.093 0.831±0.188▲第3日0.399±0.103△△1.795±0.741▲▲1.010±0.397△第5日0.545±0.213 0.731±0.155 0.746±0.371
2.6.2 各组小鼠肺组织中IL-1 mRNA表达量的比较见表4。与空白组比较,模型组肺组织中IL-1 mRNA的表达在感染后第3天显著增加(P<0.01),虎杖组肺组织中IL-1mRNA的表达在感染后第1天明显增加(P<0.05);与模型组比较,虎杖组肺组织中IL-1 mRNA的表达在感染后第3天显著降低(P<0.05)。
表4 各组小鼠肺组织中IL-1mRNA表达量的比较(pg/mL,±s)

表4 各组小鼠肺组织中IL-1mRNA表达量的比较(pg/mL,±s)
组别空白组模型组虎杖组n 24 24 24第1日0.649±0.129△1.056±0.232▲1.122±0.235▲第3日0.619±0.210△△1.842±0.267▲▲1.799±0.225▲▲第5日0.596±0.105△△1.333±0.363▲▲1.242±0.273
2.6.3 各组小鼠肺组织中IL-10 mRNA表达量的比较 见表5。与空白组比较,模型组在流感病毒感染后第1~3天肺组织中IL-10 mRNA表达有降低趋势,在感染后第5天有升高趋势。虎杖组肺组织中IL-10 mRNA表达在感染后第3~5天与空白对照组比较有增加趋势,感染后第1~3天与模型对照组比较有增加趋势,但差异均无统计学意义(P>0.05)。
表5 各组小鼠肺组织中IL-10mRNA表达量的比较(pg/mL,±s)
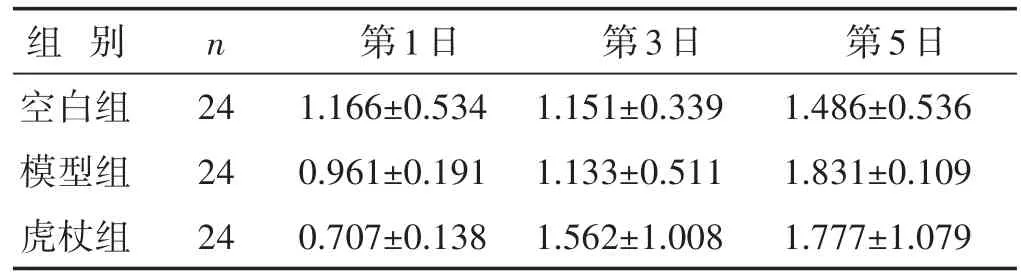
表5 各组小鼠肺组织中IL-10mRNA表达量的比较(pg/mL,±s)
组别空白组模型组虎杖组n 24 24 24第1日1.166±0.534 0.961±0.191 0.707±0.138第3日1.151±0.339 1.133±0.511 1.562±1.008第5日1.486±0.536 1.831±0.109 1.777±1.079
2.6.4 各组小鼠肺组织中IFN-γ mRNA表达量的比较 见表6。与空白组比较,模型组肺组织中IFN-γ mRNA的表达在感染后第5天显著增加(P<0.05),虎杖组肺组织中IFN-γ mRNA的表达在感染后第1、5天显著增加(P<0.01和P<0.05);与模型组比较,虎杖组肺组织中IFN-γ mRNA的表达在感染后第1天显著增加(P<0.05)。
表6 各组小鼠肺组织中IFN-γmRNA表达量的比较(pg/mL,±s)

表6 各组小鼠肺组织中IFN-γmRNA表达量的比较(pg/mL,±s)
组别空白组模型组虎杖组n 24 24 24第1日0.212±0.066 0.613±0.362 1.109±0.332▲▲△第3日0.242±0.155 0.933±0.221 0.945±0.525第5日0.230±0.070△1.356±0.311▲1.487±0.346▲
3 讨 论
重症流感病毒肺炎主要表现为弥漫性肺泡损伤、肺间质和支气管壁大量炎症细胞浸润等病理改变,导致急性呼吸窘迫综合征,继发多脏器损伤,甚至死亡[6]。炎性因子水平大量升高是引起机体免疫损伤的基础,病毒感染能诱导外周血单核细胞产生IL-1、IL-6和TNF-α,使局部血管扩张、通透性增加,补体、急性期蛋白等随血浆外渗,并激活血管内皮细胞及白细胞,使细胞表面黏附分子表达增加,加强白细胞与血管内皮细胞的黏附,使大量中性粒细胞和单核细胞外渗,释放一系列炎性介质导致严重的组织病理损伤[7]。IFN-γ主要由Th1细胞分泌,能结合细胞表面受体,诱导病毒感染细胞产生多种抗病毒蛋白,从而提高机体对病毒的清除能力[8]。虎杖具有利湿退黄、清热解毒、散瘀止痛、化痰止咳等功效。虎杖及其活性成分能直接抑制流感病毒的增殖,增加TLR9诱导的IFN-β的表达[9],并且在感染流感病毒的初期与后期均可减少小鼠血清中促炎性细胞因子的分泌[10]。
本实验发现,感染后第3、5天,虎杖组肺指数较模型组降低,其中第5天差异具有统计学意义;光镜下观察发现虎杖组小鼠肺组织较模型组病灶小、炎症细胞浸润密度较低。感染后第5天,虎杖组小鼠气管纤毛及微绒毛较模型组增多。结果表明虎杖对流感病毒感染小鼠肺组织及气管具有保护作用。肺匀浆RT-PCR检测发现,虎杖组感染后第1天IFN-γ mRNA较模型组显著升高,第3天IL-1 mRNA较模型组显著降低,第3天IL-10 mRNA表达较模型组有升高趋势,TNF-α mRNA较模型组无明显变化。这表明虎杖能通过上调早期IFN-γ mRNA水平提高机体的抗病毒能力,下调感染病程中期IL-1 mRNA的过度表达,从而减轻了肺组织的炎症损伤,降低了小鼠的肺指数。
流感病毒感染属于中医急性外感热病范畴。外感风热,初起见咳嗽、发热、咽痛、口渴,继而邪热入里,热盛成毒,灼津成痰,痰热互结,阻滞肺之宣发肃降,出现咳嗽喘促、痰多难咯,形成痰热壅肺证[11],治当清热解毒、宣肺化痰。肺热不解,易与湿邪相干,使病程进展更加复杂多变。《外感温热》论述“湿与温合,蒸郁而蒙蔽于上,清窍为之壅塞,浊邪害清也”[12],提出了邪热与湿相合,迅速传变。《温病条辨》论述“脾郁发黄,黄极则诸窍为闭,秽浊塞窍者死”[13],提出湿热盘踞中焦,土壅木塞,郁而发黄;湿热蕴浊,秽浊塞窍,见小便涩滞、神识昏蒙等危重证候。新冠肺炎患者早期表现为发热、咳嗽为主,进见食欲差、恶心、便溏、腹泻,舌苔普遍为腻苔,之后快速发展为痰瘀壅肺、邪毒闭肺、内闭外脱等证候,湿、热、毒、瘀即是其主要证候要素[14]。
《灵枢·本输》论述“肺合大肠,大肠者,传道之腑”,提出了肺与大肠密切相关的认识。肺主一身之气,肺气郁闭则肠腑不通,肠道壅滞也会导致肺气宣降失常。廖荣鑫等[15]以96例铜绿假单胞菌肺炎患者为研究对象,对照组给予常规西药治疗,治疗组在此基础上给予白虎承气汤,结果发现治疗组白细胞计数(WBC)、降钙素原(PCT)、C反应蛋白(CRP)水平均显著降低,病原菌的清除率显著高于对照组。林新锋等[16]通过对ICU46例重症肺炎患者的临床观察,发现西医治疗基础上加用调胃承气汤较单纯西药组能显著降低患者血清WBC、CRP、PCT、血清淀粉样蛋白A(SAA)、IL-6水平,提示调胃承气汤可减轻机体炎症反应,有利于重症肺炎的早期康复。临床试验发现[17],通腑法能使肺泡内巨噬细胞增多,提高机体免疫功能,并能增强胃肠蠕动,提高新陈代谢、降低腹压、改善微循环。
由此可见,外感热病以热毒郁肺为主要病理因素,故清热解毒为首要治则法。热盛灼津,肺失宣降,痰瘀内结,故以化痰行瘀助气机升降。邪热壅结上焦,恐有伤及中焦、传变下焦之势,故以利湿法清肝胆、健中焦,先按未受邪之地,防止湿与热相胶结。肺合大肠,表里相连,肺热壅盛,肠腑失司,传道不利,故以通腑泻热,下开结滞、上启化源,亦给邪以出路。综上所述,虎杖功兼解肺之热毒、化肺之痰瘀、利肝胆之湿、通大肠之结,能显著改善小鼠肺组织病理损伤。清热利湿、化痰通腑法在外感热病治疗中具有重要作用,亦能显著降低促炎因子、升高抗病毒因子,减轻机体过度的免疫反应。

