高渗盐水保护血脑屏障减轻脑出血大鼠脑水肿的相关机制研究
第五飞虎,赵志靖,邓毅恒
(1.长安医院神经外科,西安710016;2.长安医院重症医学科,西安710016)
脑出血(intracerebral hemorrhage,ICH)是临床常见危重症之一,其致残率和致死率较高,因此ICH治疗成为神经外科领域研究的一个重点。临床观察发现,有效控制脑水肿的形成是提高ICH患者救治成功率的关键[1-2]。血脑屏障的破坏是ICH后脑水肿形成的始动因素,ICH后局部基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)与基质金属蛋白酶组织抑制剂-1(metallopeptidase inhibitor-1,TIMP-1)比 例 下降,可减少紧密连接蛋白如claudins、occludin和zonula occludens(ZO)蛋白的表达,促进血脑屏障的破坏[3-4]。
众多研究表明,高渗盐水(hypertonic saline)在治疗多种病因所致的脑水肿和颅内高压方面均较经典的甘露醇效果更显著[5]。尽管国内外关于高渗盐水减轻脑水肿的相关研究较多,例如国内胡晓露等[6]证明高渗盐水可通过上调紧密连接蛋白occudin的表达,抑制ICH大鼠血脑屏障通透性升高,减轻脑水肿;然而,高渗盐水是否能够通过影响MMP-9/TIMP-1比例,改善ICH后血脑屏障破坏的相关研究尚少。因此,本研究组制作大鼠ICH模型,并施加高渗盐水干预,然后对比各组大鼠脑组织病理学、MMP-9/TIMP-1比例及紧密连接蛋白表达的差异,旨在为将来HS治疗ICH后脑水肿提供更多的理论依据。
1 材料与方法
1.1 动物及主要试剂仪器
成年雄性清洁级SD大鼠60只,体质量(250±50)g,购自空军军医大学实验动物中心[SCXK(陕)2019-001]。大鼠饲养于屏障设施[SYXK(陕)2019-001],相对湿度50%~60%,温度(21±2)℃,通风良好,自由饮食。动物实验在空军军医大学唐都医院药剂科实验室进行,符合相关伦理要求并给予人道关怀。本实验方案得到空军军医大学实验动物中心福利与伦理委员会的批准(IACUC-20200417)。
用浓氯化钠注射液作为高渗盐水,购自正大天晴药业集团股份有限公司(规格为10 mL/支);腹腔麻醉用水合氯醛,购自青岛宇龙海藻有限公司(国药准字H37022673);HE染色试剂盒购自江苏碧云天生物技术研究所(批号分别为C0105);组织总蛋白提取试剂盒购自陕西西安安美生物公司;山羊抗兔IgG二抗、兔抗大鼠MMP-9、TIMP-1、claudin-5、occludin以及ZO-1抗体均购自英国Abcam公司(批号分别为ab31412、ab55875、ab24362、ab43542和ab56714)。聚丙烯酰胺凝胶电泳装置和凝胶成像系统购自美国Bio-Rad公司;酶标仪购自美国Bio-Tek公司;微量移液器购自德国Eppendorf公司。
1.2 动物模型的建立与分组
根据文献[7]方法制作大鼠ICH模型:用30 mg/kg水合氯醛腹腔麻醉后,将实验大鼠固定于立体定位仪,暴露实验大鼠前囟,旁开在前囟右侧3 mm处将颅骨钻开,微量注射器注射20 μL常温10%胎牛血清,深度为5 mm,注射速度为1μL/min。最终40只大鼠造模成功,随机分为模型组及治疗组,每组各20只。其中,治疗组实验大鼠造模后,按0.3 mL/h经尾静脉泵入10%高渗盐水,共48 h。另外设置对照组,即选取实验大鼠20只,同模型组步骤钻开颅骨后,仅微量注射20μL生理盐水(即0.9%氯化钠溶液),未出现死亡。造模后48 h以脊椎脱臼法处死3组大鼠,收集脑组织,提取总蛋白后置于-70℃冰箱中保存。
1.3 脑含水量测定
采用干湿质量法[8],将脑组织称湿重后,立即放入恒温电烤箱内,设置温度为120℃,烘烤8 h后称取干质量。按公式计算脑含水量:脑含水量=(湿质量-干质量)/湿质量×100%。
1.4 脑组织学观察
实验结束后,冰上迅速切取受压中心部位脑组织,用体积分数为10%的甲醛溶液固定,梯度乙醇溶液脱水,二甲苯溶液浸泡透明,浸蜡包埋,使用切片机切成5µm薄片,置入60℃烤箱中烘烤后脱蜡,进行苏木精和伊红染色,水洗后脱水,二甲苯溶液浸泡透明,封固,光学显微镜下观察。
1.5 蛋白免疫印迹法测定脑组织相关蛋白表达的变化
脑组织总蛋白用100 g/L聚丙烯酰胺凝胶电泳分离,转膜、室温封闭后,分别加入兔抗MMP-9、兔抗TIMP-1、兔抗claudin-5、兔抗occludin及兔抗ZO-1抗体(均按1∶1 000比例配制),4℃孵育过夜,洗膜后加入羊抗兔二抗(体积稀释比例为1∶2 500)孵育2 h,洗膜后,用增强化学发光法显色、显影,凝胶成像分析系统摄像分析各条带灰度值,并以β-actin为内参,计算各目的蛋白的相对表达水平。
1.6 统计学分析
采用SPSS 26.0软件包进行统计分析。计量资料服从正态分布,用均数±标准差±s表示;多组间比较采用单因素方差分析,组内两两比较采用LSD-t检验。以P<0.05认为差异有统计学意义。
2 结果
2.1 各组大鼠死亡率、脑组织含水量以及肉眼观察差异
造模过程中因麻醉效果不佳,大鼠挣扎,造成脑损伤死亡20只。造模后实验过程中,模型组大鼠死亡8只,死亡率为40.00%;治疗组大鼠死亡5只,死亡率为25.00%;对照组大鼠死亡0只,死亡率为0.00%。结果说明,治疗组大鼠死亡率明显降低,差异有统计学意义(P<0.05)。
模型组大鼠脑组织含水量为(80.89±0.25)%,高于治疗组大鼠脑组织含水量(78.44±0.32)%,差异有统计学意义(P<0.05)。
肉眼观察结果显示,模型组大鼠脑中线明显从病灶侧移向对侧,治疗组大鼠脑中线未见明显偏移(图1A、B)。
显微镜下可见模型组大鼠脑组织水肿明显,炎性细胞渗出较多;而治疗组大鼠脑组织水肿明显减轻,炎性细胞渗出明显减少(图1C、D)。
2.2 各组大鼠脑组织中MMP-9/TIMP-1蛋白表达比例差异
与对照组相比,模型组与治疗组大鼠脑实质MMP-9/TIMP-1比例均明显升高,差异有统计学意义(P<0.05);与模型组相比,治疗组大鼠脑实质MMP-9/TIMP-1比例明显降低,差异有统计学意义(P<0.05,图2)。
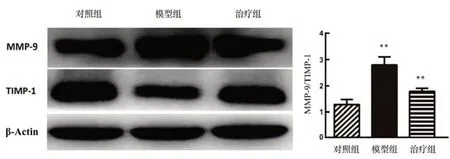
图2 各组大鼠脑组织中TIMP-1、MMP-9蛋白表达差异Figure2 Differencesin theexpression of TIMP-1 and MMP-9 proteinsin thebrain tissuesof theratsin each group
2.3 各组大鼠脑组织中claudin-5、occludin以及ZO-1蛋白表达差异
与对照组相比,模型组与治疗组大鼠脑实质claudin-5、occludin以及ZO-1蛋白表达水平均明显降低,差异有统计学意义(P<0.05);与模型组相比,治疗组大鼠脑实质claudin-5、occludin以及ZO-1蛋白表达水平明显增加,差异有统计学意义(P<0.05,图3)。

图3 各组大鼠脑组织中claudin 5、occludin以及ZO-1蛋白表达差异Figure 3 Difference of claudin 5,occludin and ZO-1 protein expressions in brain tissues of rats in each group
3 讨论
血脑屏障主要是以脑微血管内皮细胞及紧密连接蛋白作为基础结构,基底膜辅以周细胞、星形胶质细胞和小胶质细胞等细胞结构,专门负责维持血脑屏障最基本生理功能,让大脑组织免受外周血液循环中病原体以及有毒物质的侵犯,并可将营养物质输送至大脑各处,稳定神经系统内环境及微循环。在发生ICH损伤后,能量代谢紊乱、自由基的生成、细胞内钙超载、功能细胞凋亡等等均可造成胶质细胞肿胀、内皮细胞水肿、基底膜断裂以及细胞间连接发生解离,最终导致血脑屏障完整性与功能遭受破坏[9-10]。血脑屏障完整性被破坏进一步导致脑水肿形成失控,血肿周围水肿在4~5 d后仍持续增加,甚至延续至14 d左右,这是ICH后致残致死的重要病理基础。因此,稳定血脑屏障状态及完整性是改善ICH患者预后的关键策略。
MMP-9是金属蛋白酶类超家族中的一员,它可通过特异性地与细胞外基质成分结合来降解细胞外基质,在发生血管源性水肿的过程中起关键作用。而TIMP-1是具有抑制MMP-9活性作用的一组多功能因子家族,其通过对MMP-9的抑制,参与正常细胞外基质改建,在多种病理过程包括ICH过程中发挥举足轻重的作用。众多研究显示,MMP-9/TIMP-1比例动态变化可影响血脑屏障的稳定性[11-13]。本研究结果也表明,模型组MMP-9/TIMP-1比例明显高于对照组(P<0.05)。另外有研究表明,高渗盐水在治疗多种病因所致的脑水肿和颅内高压时均较经典的甘露醇效果更显著。然而,高渗盐水是否能通过影响MMP-9/TIMP-1比例改善ICH预后,这在国内外相关研究中涉及甚少。本研究结果表明,高渗盐水能明显减少ICH大鼠脑组织中MMP-9/TIMP-1比例(P<0.05),且治疗组大鼠死亡率明显降低(P<0.05);另外,治疗组大鼠脑组织含水量(78.44±0.32)%明显低于模型组脑组织含水量(80.89±0.25)%,差异有统计学差异(P<0.05);肉眼观察结果显示,模型组大鼠脑中线明显从病灶侧移向对侧,治疗组大鼠脑中线未见明显偏移。以上结果显示,高渗盐水能明显降低MMP-9/TIMP-1比例,从而减轻造模后大鼠脑水肿程度及ICH大鼠的死亡率。
内皮细胞间的紧密连接蛋白包括claudins、occludin和ZO蛋白,均是血脑屏障重要的基础结构成分,是保证血脑屏障功能稳定与结构完整性的关键要素,其表达水平和功能下降在脑水肿形成过程中起重要作用[14]。其中紧密连接蛋白claudin-5、occludin是影响血脑屏障通透性的重要蛋白。ZO-1的表达是稳定细胞间TJs结构稳定和功能完整的重要保证,在连接跨膜蛋白与细胞骨架蛋白之间起着重要作用[15]。研究表明,MMP-9/TIMP-1比例改变会引起内皮细胞间的紧密连接蛋白claudins、occludin和ZO表达水平发生改变[16]。因此笔者推测,高渗盐水可能也影响紧密连接蛋白如claudin-5、occludin以及ZO-1蛋白的表达。本研究结果显示,ICH大鼠脑组织claudin-5、occludin和ZO-1蛋白表达水平明显降低,而通过HS治疗后ICH大鼠脑组织claudin-5、occludin和ZO-1蛋白表达水平明显升高(P<0.05)。以上研究结果提示,高渗盐水可影响血脑屏障内皮细胞间的紧密连接蛋白claudin-5、occludin和ZO-1的表达,该机制可能是通过影响MMP-9/TIMP-1比例的改变所实现。
综上所述,高渗盐水可通过降低MMP-9/TIMP-1比例,稳定紧密连接蛋白claudin-5、occludin和ZO-1的表达,维持血脑屏障结构完整性,从而改善ICH后脑水肿的严重程度,降低实验模型大鼠的死亡率。本研究为日后用高渗盐水治疗ICH后脑水肿提供了重要的理论依据。

